
内容提要
- 肺炎是动态过程,而胸部影像学和化验结果仅为疾病活动状态的短暂表现,如果一味等待病原学结果往往可能延误病情
- 本病例中泛耐药肺炎克雷伯菌抗生素的应用问题也值得关注。对于产超广谱β-内酰胺酶(ESBLs)克雷伯菌,应结合药敏试验结果和患者临床表现的严重程度确定抗菌药物治疗方案
- 本例患者疑诊为ICU-AW后即应用免疫球蛋白及营养神经治疗,并加强肢体功能锻炼,后患者成功脱机且四肢肌力及功能恢复正常
ICU获得性肌病(ICU-acquired weakness,ICU-AW)是在20世纪80年代被首次描述为败血症和多器官衰竭的一种罕见并发症,排除其他原因以四肢肌无力为主要临床表现的综合征,其中主要包括危重症肌病(critical illness myopathy,CIM)、危重症多发性周围神经病(critical illness polyneuropathy,CIP)和危重症多发性神经肌肉病(critical illness polyneuromyopahy,CIPNM),其发病率尚不明确,不同种疾病发生率从20%到80%不等。ICU-AW严重影响危重症患者的住院时间、并发症发生率及病死率,然而,目前临床医师对ICU-AW的认识程度尚不够,常常导致其被忽视、误诊和低估。
1、临床资料
一般情况
患者男,33岁,以“咳嗽10 d余,发热7 d,胸闷4 d”于2016年4月13日急诊入住郑州大学第一附属医院呼吸与危重症医学科。
病史情况
患者入院10余天前受凉后出现流涕、鼻塞、干咳,无发热、畏寒,至当地诊所就诊,考虑为“上呼吸道感染”,予以对症支持治疗,无明显好转。7 d前出现发热,体温最高39.4℃,伴畏寒、寒战、咳嗽,至当地县医院就诊,考虑“肺部感染”,予抗感染治疗(具体用药不详),效果差。4 d前出现胸闷、呼吸困难,活动时加重,不能平卧,转诊至当地市医院,行胸部CT(图1),双肺可见弥漫性磨玻璃影,双下肺为著。给予持续鼻导管吸氧10 L/min,SpO2波动于82%~85%,口唇发绀,呼吸急促,于4月13日21:11急诊入我院。
患者自发病来,神志清,精神差,饮食、睡眠差,大小便如常,体重无明显变化。既往体健,个人史、婚姻史、家族史均无特殊。
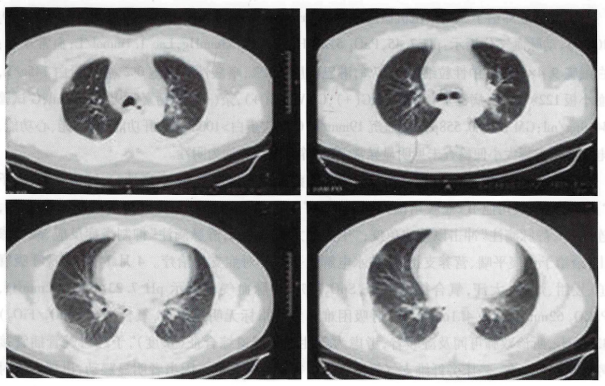
图1 患者外院胸部CT
入院查体
体型肥胖,神志清,精神差,口唇发绀,呼吸窘迫,肺部叩诊清音,双肺听诊呼吸音粗,未闻及明显干/湿啰音,心率116次/分,律齐,各瓣膜听诊区未闻及病理性杂音。
辅助检查
入院后立即给予无创正压机械通气(NIPPV)(FiO2 100%)。动脉血气分析:pH 7.45,PaO2 51 mmHg,PaCO2 33 mmHg,Lac 1.1 mmo/L。血常规:WBC 9.4×10^9/L,NEU% 91.7%,LYM% 5.2%,EOS% 0%,Hb 145 g/L,PLT 122×10^9/L。病毒全套:EBV-IgG(+),CMV-IgG(+),余(-)。PCT 0.223 ng/ml;G试验34.9 pg/ml,GM试验 0.558 μg/L;ESR 19 mm/h:CRP>100 mg/L。肝功能、肾功能、心功能、电解质及常规大小便检查未见明显异常,痰培养及血培养均为阴性。
初步诊断
结合患者病史及相关检查,初步诊断为重症社区获得性肺炎(病毒性?),呼吸衰竭。
2、诊治经过
予患者更昔洛韦+奥司他韦+亚胺培南西司他丁等抗感染;静脉滴注人免疫球蛋白300 mg/kg,连续3 d,冲击以重建免疫;静脉滴注甲泼尼龙40 mg qd抑制炎症反应,减少渗出;以及化痰平喘、营养支持、维持水电解质平衡等对症支持治疗。
4月14日出现呼吸窘迫、发绀、烦躁、大汗,氧合持续下降,SpO2 75%,动脉血气分析示pH 7.23,PaO2 32 mmHg,PaCO2 62 mmHg,Lac 4.1 mmol/L。呼吸困难和血气指标无明显改善,氧合指数(PaO2/FiO2)32 mmHg,听诊双肺可闻及湿啰音,考虑为重度ARDS,予经口气管插管接呼吸机辅助通气,经床旁纤维支气管镜吸出中等量稀薄黏液。
因患者明显躁动,出现人机对抗,予咪达唑仑、芬太尼等镇静药及罗库溴铵等神经肌肉阻滞剂(NMBAs)。采取小潮气量、适宜水平PEEP、允许性高碳酸血症的肺保护性通气策略,并且在机械通气基础上采用肺复张以促进塌陷的肺泡复张,改善氧合,但患者血氧饱和度无明显改善,SpO2波动于70%左右,HR 110~140次/分,BP 105~130/60~70 mmHg,动脉血气分析:pH 7.396,PaO2 38.1 mmHg,PaCO2 39.4 mmHg,Lac 1.5 mmol/L,与家属沟通后于4月15日行VV-ECMO治疗。
患者体温较前升高,复查血常规:WBC 17.2×10^9/L,NEU% 95.2%,LYM% 1.9%,PLT 120×10^9/L,G试验35.1 pg/ml,GM试验0.476 μg/L,ESR 37 mm/h,CRP>100 mg/L,PCT 1.561 ng/ml。床旁胸片示:两肺感染,心影增大(图2)。床旁纤维支气管镜肺泡灌洗液送检结果回示:肺炎克雷伯杆菌(仅对多黏菌素B、替加环素敏感)、铜绿假单胞菌(仅对多黏菌素B、哌拉西林+他唑巴坦敏感)。

图2 患者床旁胸片
调整治疗方案为替加环素50 mg q12h ivgtt+头孢哌酮舒巴坦3.0 g q8h ivgtt抗感染。4月21日(ECMO第7天)逐步降低ECMO支持力度,并试验性停止ECMO供氧1 h,患者生命体征平稳,未见明显低氧血症,停止ECMO支持,继续机械通气。但患者短期内无法撤离呼吸机,为便于气道管理,予床旁经皮气管切开术,呼吸机辅助通气。
患者痰液量减少,体温下降,WBC降低,双肺听诊呼吸音较前好转,血流动力学稳定,逐步减低呼吸机支持力度,加强营养,鼓励患者自主呼吸及排痰,每天试验性脱机,但无法成功脱机。为明确脱机困难原因,在转运呼吸机支持下外出行胸部CT平扫,结果显示:两肺炎症伴空洞形成,右侧胸腔积液(图3)。考虑到患者体型肥胖,且呼吸机辅助通气,穿刺引起气胸等并发症的风险较大,因此给予CT引导下胸腔穿刺置管术,引流液送化验,结果示:胸腔积液呈黄色,微混,无凝块,体液有核细胞数619×10^6/L,多个核细胞比率92.7%,单个核细胞比率7.3%,红细胞数0.001×10^12/L,间皮细胞计数0,血浆葡萄糖3.1 mmol/L,CRP 10.3 mg/L,CEA 5.89 ng/ml。

图3 患者胸部CT
患者停用NMBAs 4 d,胸腔积液引流后,每天试验性脱机,仍有四肢肌无力、脱机困难,双侧脑神经无异常,四肢肌容积减小,肌张力减弱,双上肢肌力Ⅱ级,双下肢肌力Ⅲ级,四肢深浅反射减弱,腱反射减弱,病理征未引出,请神经内科会诊,考虑为周围神经病变(吉兰-巴雷综合征?)。
积极与家属沟通,经家属同意后行腰椎穿刺术,脑脊液检查未见明显异常,基本排除吉兰-巴雷综合征。请示上级医师后考虑为ICU获得性肌病,患者及家属拒绝行肌电图及腓肠肌活检术。给予免疫球蛋白冲击治疗,同时应用甲钴胺、甲硫氨酸维B1、注射用鼠神经生长因子等加强营养神经治疗,避免神经损害,加强功能锻炼,避免肢体畸形。
5月9日脱机2 h,5月10日肌张力较前明显好转,双上肢肌力Ⅲ级,双下肢肌力Ⅳ级,四肢深浅反射及腱反射正常。5月16日患者成功脱机并复査胸部CT:两肺炎症,较2016年5月6日片有所好转,右侧胸腔积液引流术后,较前减少(图4)。

图4 患者复查胸部CT
5月18日拔出气切套管,给予鼻导管吸氧3 L/min,RR 18次/分,SpO2 100%,查体四肢肌力Ⅳ级。患者一般情况可,生命体征平稳,于6月2日出院。7月4日复查胸部CT,双肺炎症较前减轻(图5)。
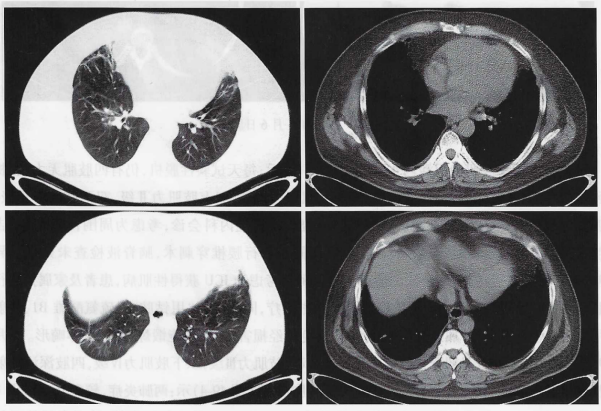
图5 患者出院后复查胸部CT
3、讨论
本例患者社区发病,有新近出现的咳嗽、咳痰、发热症状,胸部影像学检查显示新发的斑片状浸润影,并除外肺结核、肺部肿瘤等其他疾病,符合社区获得性肺炎(CAP)的诊断。该患者在无创机械通气情况下氧合持续恶化,需要有创机械通气治疗,呼吸频率>30次/分、氧合指数≤250 mmHg,多肺叶浸润,可诊断为重症肺炎。
CAP的临床表现多样,病情严重程度不同。重症肺炎常并发ARDS、脓毒性休克、MODS,甚至死亡。肺炎是动态过程,而胸部影像学和化验结果仅为疾病活动状态的短暂表现,如果一味等待病原学结果往往可能延误病情,早期给予准确的病情评估及恰当的抗生素治疗尤为重要。因此,作为呼吸危重症医学科医师,应在最短时间内获得正确的诊疗方向,早期给予经验性治疗以控制疾病进展,后期结合病原学检查及时调整用药以改善患者预后。
结合本例患者的流行病学资料、临床表现、胸部CT及实验室检查结果,考虑早期为病毒感染,后期并发肺炎克雷伯菌及铜绿假单胞菌感染。病毒感染诊断较困难,确诊有赖于病原学检查,而早期抗病毒治疗能减轻症状、缩短病程。因此,如果有感染的证据宜尽早抗病毒治疗。
本病例中泛耐药肺炎克雷伯菌抗生素的应用问题也值得关注。对于产超广谱β-内酰胺酶(ESBLs)克雷伯菌,应结合药敏试验结果和患者临床表现的严重程度确定抗菌药物治疗方案。对严重的产ESBLs肠杆菌科细菌感染及医院发生的产ESBLs肠杆菌科细菌感染,首选碳青霉烯类抗菌药物联合治疗。对于本病例,我们首先选用碳青霉烯类亚胺培南西司他丁钠经验性治疗,后续根据痰培养结果调整为替加环素对抗肺炎克雷伯菌感染。
呼吸机的应用在重症患者治疗中也很重要。本例患者入院前持续鼻导管高流量吸氧,呼吸窘迫,氧合低,但神志清,血流动力学稳定,有自主咳痰能力,依从性好,因此入院后采用NPPV,后病情进展,呼吸困难症状无改善,氧合持续下降,且有ARDS证据,此时应果断给予有创机械通气并采用肺保护性通气策略。
ECMO作为一种持续体外生命支持手段,用于部分或完全替代患者心肺功能,从而为原发病的诊治争取时间,对原发病本身没有直接治疗作用。因此在给予ECMO支持之前,应综合判断原发疾病的潜在可逆性、严重程度及进展情况,可根据条件选用。对于本例患者,诊断为SCAP、呼吸衰竭、重度ARDS,病情危重,尽管该患者给予强有力及针对性的抗感染治疗、有创机械通气等处理后,氧合仍未改善,氧合指数小于80 mmHg,有应用ECMO的指征。后该患者成功撤离ECMO,但在管理过程中患者四肢无力、脱机困难是我们面临的巨大挑战。患者入住ICU后,行气管插管和机械通气,并发ARDS,后出现四肢不同程度的对称性迟缓性无力,查体表现为四肢肌容积减小、四肢深反射减弱。遗憾的是,该家属拒绝行肌电图及腓肠肌活检,未获得明确的病理结果。
ICU-AW是ICU中发生率最高的急性多神经肌病,可导致机械通气时间和住院时间延长,增加病死率。目前研究发现,ICU-AW的相关危险因素主要包括药物相关危险因素和非药物相关危险因素。前者主要是糖皮质激素和NMBAs,长期大剂量的糖皮质激素能够诱导肌肉的分解代谢并抑制其合成代谢,从而导致促肌丝的缺失以及类固醇相关肌病的发生。NMBAs能够阻断神经肌肉接头处的突触传递,使肌肉及其支配神经的联系中断,从而阻断神经调节蛋白对于肌细胞的营养作用,而且NMBAs也会降低运动终板钠离子通道的活性,从而降低肌细胞膜兴奋性,产生肌松作用。NMBAs所致肌无力的时效维持数小时,如果出现持续数天的肌无力则应考虑是否合并ICU-AW。
本例患者在治疗过程中应用大剂量甲泼尼龙抑制炎症反应,减少渗出,有创机械通气期间间断应用罗库溴铵等非去极化NMBAs及丙泊酚、咪达唑仑、芬太尼、地西泮等镇静药物,而过度镇静也会降低肌肉的兴奋性,可能导致ICU-AW的发生。
非药物相关危险因素主要包括制动、机械通气等治疗措施。ICU患者一般采用保护性约束带以防止患者烦躁意外拔管,制动或活动受限可能会导致失用性肌萎缩和肌力的下降,从而导致患者严重的肢体功能残障。本例患者入院即应用无创机械通气(4月13-14日),后因病情变化改为有创机械通气(4月14日-5月16日),于5月16日成功脱机,共使用机械通气1月余。膈肌在机械通气过程中主动做功减少,可能引起膈肌失用性萎缩和无力,且该患者间断应用保护性约束带,这些非药物相关危险因素都可能导致ICU-AW的发生。
除了上述两大类危险因素外,脓毒血症、SIRS以及MODS等严重基础疾病以及机械通气的应用被证实为ICU-AW的独立危险因素。本例患者为SCAP、呼吸衰竭、ARDS,起病急、进展快、较长时间应用机械通气及保护性约束带,且有大剂量糖皮质激素、镇静药、NMBAs等用药史,这些都是可能导致ICU-AW发生的危险因素。
CIM是ICU-AW的一种,是一种有独特电生理和形态的初级肌病。2011年提出CIM诊断标准如下:①存在原发危重病(包括脓毒症、MODS等);②病程中出现急性四肢无力和/或呼吸机撤机困难;③在两条或两条以上运动神经中,CMAP波幅低于正常下限的80%且无传导阻滞;④感觉神经动作电位波幅高于正常下限的80%;⑤在意识清醒且能够配合的患者中,EMG示短时程、低波幅多相运动单位电位,伴或不伴纤颤电位;在昏迷等不配合患者中,CMAP时程延长或直接刺激肌肉肌膜的兴奋性减低;⑥重频刺激无递减反应;⑦肌肉病理示选择性Ⅱ型纤维萎缩、粗肌丝缺失或不同程度的肌纤维坏死等特征。该标准认为:肯定CIM诊断需满足上述7条诊断标准,而可能CIM诊断需满足第1条及第3~6条诊断标准。如果患者仅满足第1和第2条诊断标准,则可以诊断ICU-AW。本例患者属于危重症患者,肢体无力、脱机困难,并排除神经肌肉等原因引起的心肺疾病,满足ICU-AW的诊断标准。
ICU-AW的治疗:目前ICU-AW尚无特效的治疗方案,及时识别并尽早控制该病的危险因素,是预防ICU-AW发生发展的最有效措施。首先,要积极治疗脓毒症等严重基础疾病,并加强支持疗法,包括营养支持、抗氧化应激及免疫球蛋白的应用等,以预防MODS的发生。其次,要争取尽早撤除呼吸机,并早期加强康复锻炼。在ICU危重症患者中进行早期的康复锻炼应该与减少或避免使用镇静药物相结合,这种策略已在临床试验中被证实能够减少机械通气的持续时间、昏迷的时间以及ICU住院时间。据此,有研究提出一系列ICU干预措施以减少CIM的发生,简称为ABCDE,即唤醒(awakening)、自主呼吸(breathing)、唤醒与自主呼吸相结合(coordination of awakening and breathing)、评估谵妄(delirium assessment)以及早期康复锻炼(early exercise)。ICU-AW常导致危重症患者的严重致残性,可能持续数月或数年,甚至有近1/3不能够恢复独立行走或自主呼吸,经过积极营养支持、抗氧化应激、免疫球蛋白及激素疗法等治疗下,四肢肌力及膈肌肌力恢复正常。本例患者疑诊为ICU-AW后即应用免疫球蛋白及营养神经治疗,并加强肢体功能锻炼,后患者成功脱机且四肢肌力及功能恢复正常。
ICU-AW诊断难度较大,易漏诊,需要医师缜密的临床思维。对于危重症患者,既往无神经系统疾患,有ICU-AW易感因素,不能用原发病解释的四肢迟缓、无力,甚至瘫痪者,脱机困难或脱机后再次出现不明原因的呼吸衰竭者,或机械通气时间>7 d,不能用原发病解释者,临床医师应引起重视,提高诊断意识,警惕ICU-AW的发生。
从本例患者的成功救治中我们可以总结出以下经验和教训:①积极寻找病原学证据,结合经验性治疗,必要时联合应用抗生素对危重症患者的抢救十分重要;同时,患者感染的病原菌在整个住院期间并非一成不变,要根据患者的症状体征变化及病原学证据及时调整用药。②ECMO可部分或完全替代患者心肺功能,从而为原发病的诊治争取时间,在治疗重症肺炎合并ARDS的患者时可发挥关键的生命支持作用。③重症肺炎患者在整个治疗过程中有很多可致ICU-AW的危险因素,因此,重症患者在治疗时应注意预防,如在病情允许的情况下应尽量减少或避免NMBAs、镇静药等的应用,保持适宜的镇静状态,早期苏醒以缩短机械通气持续时间、昏迷时间以及ICU住院时间;糖皮质激素视情况使用,一旦炎症控制,逐步减少剂量;病情好转后尽早活动、加强康复锻炼等,以促进脏器和肢体功能恢复。④免疫球蛋白在控制原发病、重建机体免疫方面也起到一定的作用,宜尽早应用。⑤多学科医师之间及医护之间的密切合作非常重要,多学科诊治为患者的健康保驾护航,医师的精细治疗和良好的护理是患者渡过难关的保障。
参考文献
[1] Bolton C F. The discovery of critical illness polyneuropathy: a memoir[J]. Can J Neurol Sci, 2010, 37(4):431-438.
[2] Latronico N, Bolton C F. Critical illness polyneuropathy and myopathy: a major cause of muscle weakness and paralysis[J]. Lancet Neurology, 2011, 10(10):931-941.
[3] Tennila A, Salmi 'T, Peuila V, et al. Early signs of critical iliness polyneuropathy in ICU patients with systemicinflammatory response syndrome or sepsis[J]. Intensive Care Med, 2000, 26(9):1360-1363.
[4] Mandell L A, Wunderink R G, Anzueto A, et al. Infectious Diseases Society of America/American Thoracic Soci-ety consensus guidelines on the management of community-acquired pneumonia in adults[J]. Clin Infect Dis, 2007, 44(Suppl 2):S27-S72.
[5] 中华医学会呼吸病学分会, 中国成人社区获得性肺炎诊断和治疗指南(2016年版)[J].中华结核和呼吸杂志. 2016, 39(4):241-242.
[6] Ferguson N D, Fan E, Camporota L, et al. The Berlin definition of ARDS: an expanded rationale, justification.and supplementary material[J]. Intensive Care Med, 2012, 38(10):1573-1582.
[7] Schakman O, Gilson H, Thissen JP. Mechanisms of glucocorticoid-induced myopathy[J]. Bone, 2009, 45(3):S123-S124.
[8] Latronico N, Bolton C F. Critical illness polyneuropathy and myopathy: a major cause of muscle weakness and paralysis[J]. Lancet Neurology, 2011, 10(10):931-941.
[9] 戴廷军, 焉传祝. 危重症肌病的研究进展[J]. 中华医学杂志, 2016, 96(33):2686-2688.
[10] Strgm T, Martinussen T, Toft P. A protocol of no sedation for critically ill patients receiving mechanical ventilation: a randomised trial[J]. Lancet, 2010, 375(9713):475-480.
[11] Vasilevskis E E, Ely E W, Speroff T, et al. Reducing iatrogenic risks: ICU-acquired delirium and weakness-crossing the quality chasm[J]. Chest, 2010, 138(5):1224-1233.
作者:訾亚楠,赵玉苗,许爱国;单位:郑州大学第一附属医院呼吸与危重症医学科
本文转载自订阅号「重症肺言」(ID:RCCRC_0067)
原链接戳:重症肺炎合并ICU获得性肌病
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


