
对于慢阻肺病与新冠感染,我们有所思考。首先,作为全球三大死因之一、全球每年约有300万人死于慢性阻塞性肺病;据估计,到2060年,低收入国家吸烟率的上升与高收入国家的人口老龄化将导致每年超过540万人死于慢阻肺病和相关疾病;近年来,随着GOLD的更新,其定义也在发生变化,然而,无论如何,它都是一种由于气道(气管炎、支气管炎)和或肺泡(肺水肿)的病理改变所导致的以持续性、进行性的气流受限为特征的异质性肺疾病,临床表现为慢性呼吸道症状,包括呼吸困难、咳嗽、咳痰和或急性加重。
而谈到新冠感染,大家依旧记忆犹新,是由SARS-CoV-2引起的自2019年末在全球爆发的新型传染病。
为什么关注“慢阻肺病和新冠感染”这个话题?我们都知道,呼吸道病毒感染是导致慢阻肺病急性加重的主要原因,COVID-19 是一种“新”的病毒,那么慢阻肺病与新冠感染的关系如何?又有哪些机制在其中发挥作用呢?
一、慢阻肺病与新冠感染相关的流行病学
2020年,广州医科大学附属第一医院开展了第一个系统评估合并症对中国新冠感染患者预后影响的全国性调查。该研究纳入了1590例患者的近期暴露史、临床症状、体征、合并症和入院时的实验室检查结果等相关数据,以入住ICU、有创通气或死亡为结局进行分析。
结果发现,在新冠感染的人群中,最常见的合并症是高血压与糖尿病,患病率分别为16.9%与8.2%,慢阻肺病仅为1.5%。但慢阻肺病与高血压、糖尿病类似都是导致“新冠感染患者不良预后”的危险因素。

上海瑞金医院的研究纳入了476例新冠感染患者,并按照病情的轻、中、重度进行分组,结果表明高血压、糖尿病患病率分别为23.7%、10.3%,慢阻肺病为4.6%。这项研究发现慢阻肺病患者占重度组的比率(15.7%)远高于中度组(2.3%)(p<0.001)。
再来看看国外的相关研究。韩国和我们同是东亚人群,2021年,韩国一项包含7590例新冠感染患者的研究,该研究将受试者分为慢阻肺病组(141例)与非慢阻肺组(4469例),慢阻肺病组的例数并不多,而两组中最常见的合并症均为高血压与糖尿病。研究进一步将慢阻肺组分为非重度组(114例)和重度组(27例),结果表明,慢阻肺病是韩国新冠感染患者全因死亡率的独立危险因素。
另外,Alberto M. Borobia等欧洲学者开展了针对欧洲第一批新冠感染住院患者的研究,收集了2226例患者的临床数据进行分析。其受试群体中高血压患病率为41.3%、糖尿病为17.1%、慢阻肺病为6.9%,相对较低。但是,与其他合并症相比,入住ICU的患者排列前三的分别是高血压(52% vs 41.3%)、糖尿病(28.0% vs 17.1%)、慢阻肺病(17.3% vs 6.9%)。
美国学者Cummings MJ等对纽约人群开展了一项前瞻性研究,纳入了257例新冠感染患者的临床数据,也发现最常见的合并症为高血压与糖尿病,慢阻肺病患者新冠患病率仅为9%,但发现慢阻肺病与院内死亡率独立相关(aHR 2.94[1.48–5.84]) 。
上述研究结果揭示,慢阻肺病与新冠感染后不良结局相关。
也有相应的荟萃分析支持慢阻肺病为新冠感染不良结局的独立危险因素,研究纳入了18项研究,共涉及14 558名受试者结果表明,新冠感染患者合并症的汇总患病率中,高血压为 22.9%(95% CI:15.8-29.9),糖尿病为 11.5%(95% CI 9.7-13.4),而慢阻肺病低于4%,但慢阻肺病与重症新冠感染风险显著相关(RR 1.53 [1.03, 2.28] )。
另一项荟萃分析在对15项研究中2473名受试者的数据进行分析后,发现虽然慢阻肺病汇总患病率仅为2% (95% CI, 1–3),但慢阻肺患者进展为重症新冠感染的风险高于非慢阻肺的患者 (RR 1.88[1.4-2.4])。
二、慢阻肺重症新冠感染机制探讨
流行病学研究揭示了慢阻肺病为重症新冠感染的独立危险因素。在新冠感染后,慢阻肺病患者有更差的临床结局。为何会出现这种情况?源于新冠感染后机体发生的各项病理生理改变与之直接相关,主要包括以下几方面:患者在新冠感染后,会出现呼吸储备功能受损、气道粘液高分泌、免疫防御功能失调、氧化应激失衡以及血管内皮功能障碍,这些加剧了慢阻肺病患者已经存在的病生理状态,进而发展到重症新冠感染。分别看看其机制。
机制1:呼吸储备功能受损
研究发现,合并慢阻肺病的新冠感染患者更可能出现呼吸困难、呼吸急促等症状,更易接受氧疗或无创通气。研究表明新冠感染患者的肺功能受损,主要表现为通气功能、小气道功能和弥散功能障碍,其中影响最大是“弥散功能”,而且,这种负面影响将持续存在于新冠感染转阴后的一段时间内。我们在临床上也发现过类似情况。
图:新冠感染患者的肺功能变化
新冠感染引起的“肺血管内血栓和肺泡水肿”最终会导致肺内分流,影响肺换气功能,这与急性呼吸窘迫综合征的发生密切相关,加剧了病程恶化的风险。下图提示,死亡组和幸存者组的通气与灌注比,没有明显统计学的差异(图左),但死亡组和幸存者组的肺内分流(图中)差异明显,且肺内分流水平与死亡率存在明显的正相关关系(图右)。
机制2:气道粘液高分泌
新冠感染时,会导致粘液分泌过多、纤毛清除受损,引起细支气管黏液阻塞,进而痰量增加、缺氧、肺部炎症、继发细菌感染缺氧,这些情况在慢阻肺病的发病过程中同样存在。

图:a图(未感染的气道上皮) 示杯状细胞染色(橙色)和完整的多层上皮(蓝色);b图(新冠感染的气道上皮) 示组织感染了COVID-19(粉红色),特别是在纤毛细胞(绿色)和产生粘液的细胞(橙色),并且观察到其细胞核高度碎裂(蓝色)。
新冠感染的肺组织中,93%在远端气道表现出粘液积聚,明显高于正常对照组(图 Ci红色柱),并观察到气道/肺有 >50% 表现出粘液积聚(图Cii)。气道黏液蓄积与上皮 MUC5B 增加有关,但与 MUC5AC 表达无关(图3Ciii、Cv)。在远端气道上皮中也检测到 XBP1S 升高,而XBP1S作为 MUC5B 表达的选择性调节因子,与粘蛋白合成增加有关。

图:Ci:对照组与 COVID-19 尸检对象肺的粘液阻塞气道数量;Cii:尸检肺标本内被粘液阻塞的气道在对照组和 COVID-19 肺的远端气道百分比;Ciii、Civ、Cv:MUC1B、MUC5AC 和XBP19S分别在对照组和COVID-19肺的远端气道表达的形态定量
机制3:免疫防御功能失调
新冠感染会引起免疫功能紊乱,包括适应性免疫(淋巴细胞和嗜酸性细胞减少;中性粒细胞计数增加)、固有免疫(单核巨噬细胞、自然杀伤细胞和树突状细胞数量、活动增强;干扰素(IFN)反应减弱;抗菌肽的释放受到抑制),这种免疫功能紊乱使慢阻肺病患者发生细菌或真菌合并感染、感染性休克可能性更高。
研究显示,可见下图,新冠感染患者死亡病例中,LYM%在发病后5周内降低到低于2%(a),重症患者LYM%最初下降,然后增加到2%以上(b),中度患者的LYM%在发病后波动很小(c)。
机制4:氧化应激失衡
新冠感染常通过以下方式促进氧化应激:首先,与ACE2的结合抑制Ang II转化为Ang 1-7,从而促进氧自由基的产生,第二,通过上调中性粒细胞与淋巴细胞的比例使自由基增加,同时,降低机体SOD、GSH等抗氧化酶的水平。这几者会使ROS水平急剧增加,触发氧化应激 - NF-kB - toll样受体(主要是TLR4)信号通路,进一步放大宿主炎症反应,最终导致急性肺损伤。
机制5:血管内皮功能障碍
组织病理学研究表明,新冠感染是一种微血管和内皮疾病,其中“内皮功能障碍”在病程中起主要作用。新冠感染后通过直接机制(经ACE2、L-SIGN和TMPRSS2等受体感染宿主细胞)和间接机制(引发细胞因子风暴、补体活化、氧化应激、线粒体功能障碍)导致包括内皮细胞的损伤、衰老和死亡,尤其是内皮糖萼的降解,内皮通透性和血管生成增加等多种内皮功能障碍,进而引起凝血与抗凝血系统失衡。

2020年,华中科技大学同济医院的研究分析了183例新冠感染患者的实验室数据后发现,死亡病例的D-二聚体和FDP水平更高、PT更长、纤维蛋白原和AT水平也显著降低(p<0.05),证实了“凝血参数异常与新冠患者患者预后显著相关”。
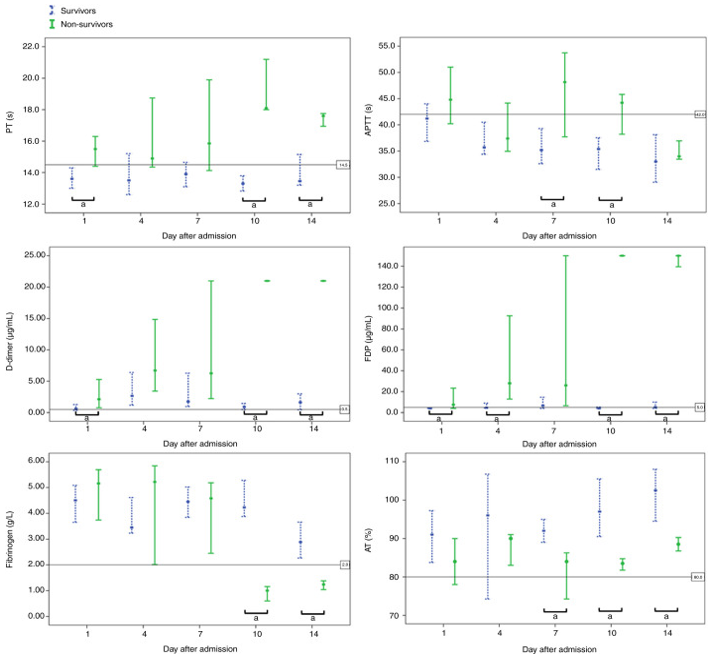
图:新冠感染患者凝血参数的动态分布
三、慢阻肺病与新冠感染的治疗
目前在新冠治疗方面,包括药物治疗和非药物治疗,虽然目前新冠已经处于“乙类乙管”的阶段,但高危人群保持社交距离、戴口罩、勤洗手仍应是常态化的非药物治疗手段,并且严格管理有潜在风险的患者(FEV 1< 50%,mMRC ≥ 3;有因加重而住院的病史,或需要长期氧疗或无创通气的),必要时可进行隔离;还可以考虑远程康复干预,如网络平台或电话会诊。
药物治疗主要分为几类,包括皮质类固醇激素、支气管扩张剂、以及抗凝药物、免疫调节剂、抗氧化剂。
1、皮质类固醇激素
皮质类固醇的使用在治疗新冠感染中的积极作用。研究发现,使用吸入性皮质类固醇患者的ACE2(血管紧张素转换酶2)和TMPRSS2(跨膜蛋白酶丝氨酸2)的表达显著低于未使用吸入性皮质类固醇的对照组。表明皮质激素可以下调ACE2基因的表达,抑制COVID-19的复制。

图:多变量混合效应模型显示吸入性皮质类固醇使用对痰基因表达的影响
看看相关研究,Horby P等一项纳入了6425名受试者的临床试验,该实验将受试者随机分为接受地塞米松治疗(2104例)与常规治疗组(4321例),其中地塞米松组的给药方案为持续10天或以上,每日一次口服或静脉注射地塞米松6mg,并以28天的死亡率为主要结局,经过分析后证实,地塞米松可降低接受有创机械通气或单独吸氧的患者的28天死亡率。
lRamakrishnan S等一项纳入了146名新冠感染患者的研究,将纳入的人员随机分为布地奈德组(73例)与常规治疗组(73例),发现早期给予吸入性布地奈德可能会降低入院或死亡的发生率。
在荟萃分析中,lGriesel M等纳入了三项共3607名受试者的评估吸入性皮质类固醇治疗新冠感染的随机对照实验(RCT),两项RCT(3207名受试者)将布地奈德加标准治疗与单独标准治疗进行比较,另一项RCT(400名受试者)则分为环索奈德加标准治疗与标准治疗加安慰剂组。其中皮质类固醇治疗组1343例,标准治疗组2264例,最终证明吸入皮质类固醇会降低入院或死亡的综合终点,并提高第14天所有初始症状的好转率。
目前,皮质类固醇的使用在治疗新冠感染中的存在争议,有报道称,使用吸入性皮质激素(ICS)可能会增加患者对新冠感染的易感性,一项使用OpenSafely平台的研究在分析148 557名慢阻肺病患者的数据后发现,与LABA-LAMA 联合用药组相比,服用ICS的慢阻肺病患者发生新冠感染相关死亡的风险增加(HR 1.39(1.10-1.76))。
2、支气管扩张剂
有一项体外研究,表明单独支气管扩张剂或联合吸入皮质类固醇抑制HCoV-229E冠状病毒复制,但西班牙的研究则表明,在接受支气管扩张剂和未接受支气管扩张剂的新冠感染患者中,未观察到死亡率的差异(9.7% vs. 11.3%, p = 0.639)。
3、抗凝药物
研究表明,对于中重度患者使用肝素的标准预防剂量(普通肝素 22 500 IU每天两或三次;依诺肝素30 mg /40 mg每天一或两次;达肝素每天2500 IU 或 5000 IU)进行血栓预防“有益于其临床结局”。阿哌沙班也具有相似的疗效,而肝素的治疗剂量(CrCl>=30 mL/min/1.73 m2,予依诺肝素1 mg/kg;CrCl <=15-29 mL/min/1.73 m2,予依诺肝素0.5 mg/kg)可以在减少血栓栓塞事件的同时,不引起D-二聚体升高的患者大出血。
然而,其在ICU患者中的治疗效果有待进一步研究。
4、免疫调节剂、抗氧化剂
一些研究提示,免疫调节剂可以降低死亡率并显著改善临床状态、口服抗氧化剂与新冠感染住院患者死亡率降低有关,然而在部分研究中尚缺乏相关临床数据、有待进一步证实。
小结及展望
流行病学研究提示,新冠感染中似乎慢阻肺病较高血压与糖尿病人群患病率低,但慢阻肺病是新冠感染患者死亡风险的独立危险因素。
慢阻肺病患者感染后易发展为重症,源于新冠感染后机体发生的各项病生理改变与之直接相关包括:肺功能储备不足、气道粘液高分泌、免疫反应受损、氧化与抗氧化机制失衡、内皮细胞功能障碍等。
针对慢阻肺病合并新冠感染的特异治疗尚不明确,但皮质类固醇、支气管扩张剂、抗凝药物、免疫调节剂、抗氧化剂等可以改善新冠患者临床结局。
参考文献
[1]WHO Coronavirus (COVID-19) Dashboard
[2]2023 Global Initiative for Chronic Obstructive Lung Disease
[3]Seemungal TA, Donaldson GC, Paul EA, et al.Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1998 May.
[4]Li J, Sun S, Tang R, Qiu H, et al.Major air pollutants and risk of COPD exacerbations: a systematic review and meta-analysis. Int J Chron Obstruct Pulmon Dis. 2016 Dec.
[5]Ritchie AI, Farne HA, Singanayagam A, et al. Pathogenesis of Viral Infection in Exacerbations of Airway Disease. Ann Am Thorac Soc. 2015 Nov.
[6]Guan WJ, Liang WH, Zhao Y, et al. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. EurRespir J. 2020 May 14
[7]Lee SC, Son KJ, Han CH, et al. Impact of COPD on COVID-19 prognosis: A nationwide population-based study in South Korea. Sci Rep. 2021 Feb 12
[8]Feng Y, Ling Y, Bai T, et al..COVID-19 with Different Severities: A Multicenter Study of Clinical Features. Am J Respir Crit Care Med. 2020 Jun 1
[9]Borobia AM, Carcas AJ, Arnalich F, et al.A Cohort of Patients with COVID-19 in a Major Teaching Hospital in Europe. J Clin Med. 2020 Jun 4
[10]Cummings MJ, Baldwin MR, Abrams D, et al.Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet. 2020 Jun 6
[11]Singh AK, Gillies CL, Singh R, et al. Prevalence of co-morbidities and their association with mortality in patients with COVID-19: A systematic review and meta-analysis. Diabetes ObesMetab. 2020 Oct
[12]Alqahtani JS, Oyelade T, Aldhahir AM, et al. Prevalence, Severity and Mortality associated with COPD and Smoking in patients with COVID-19: A Rapid Systematic Review and Meta-Analysis. PLoS One. 2020 May 11
[13]Gómez Antúnez M, Muiño Míguez A, Bendala Estrada AD, et al. Clinical Characteristics and Prognosis of COPD Patients Hospitalized with SARS-CoV-2. Int J Chron Obstruct Pulmon Dis. 2021 Jan 5
[14]梁华英,陆蓉莉,李毅 & 潘频华.(2022).重型新型冠状病毒肺炎合并慢性阻塞性肺疾病患者临床特征. 中南大学学报(医学版)(12),1695-1703.
[15]Torres-Castro R, Vasconcello-Castillo L, Alsina-Restoy X, et al. Respiratory function in patients post-infection by COVID-19: a systematic review and meta-analysis. Pulmonology. 2021 Jul-Aug.
[16]Ye L, Yao G, Lin S, Fang Y, et al.The Investigation of Pulmonary Function Changes of COVID-19 Patients in Three Months. J Healthc Eng. 2022 Jan.
[17]Tamminen P, Kerimov D, Viskari H, Lung function during and after acute respiratory infection in COVID-19 positive and negative outpatients. Eur Respir J. 2022 Mar.
[18]Kotwica A, Knights H, Mayor N, et al. Intrapulmonary shunt measured by bedside pulse oximetry predicts worse outcomes in severe COVID-19. Eur Respir J. 2021 Apr
[19]Posch W, Lass-Flörl C, Wilflingseder D,SARS-CoV-2-infected primary human airway epithelia illustrate mucus hypersecretion. J Allergy Clin Immunol. 2021 Sep.
[20]Kato T, Asakura T, Edwards CE, et al. NIH COVID-19 Autopsy Consortium. Prevalence and Mechanisms of Mucus Accumulation in COVID-19 Lung Disease ,Am J Respir Crit Care Med. 2022 Jul 11.
[21]Tan L, Wang Q, Zhang D, Ding J, Huang Q, Tang YQ, et al. Lymphopenia predicts disease severity of COVID-19: a descriptive and predictive study. Signal Transduct Target Ther.
[22]Finney LJ, Belchamber KBR, Fenwick PS, et al. Human Rhinovirus Impairs the Innate Immune Response to Bacteria in Alveolar Macrophages in Chronic Obstructive Pulmonary Disease.
[23]Alam MS, Czajkowsky DM. SARS-CoV-2 infection and oxidative stress: Pathophysiological insight into thrombosis and therapeutic opportunities. Cytokine Growth Factor Rev. 2022 Feb
[24]Delgado-Roche L, Mesta F. Oxidative Stress as Key Player in Severe Acute Respiratory Syndrome Coronavirus (SARS-CoV) Infection. Arch Med Res. 2020 Jul;
[25]Xu SW, Ilyas I, Weng JP. Endothelial dysfunction in COVID-19: an overview of evidence, biomarkers, mechanisms and potential therapies. Acta Pharmacol Sin. 2023 Apr
[26]Tang N, Li D, Wang X, et al. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020 Apr
[27]Halpin DMG, Global Initiative for the Diagnosis, Management, and Prevention of Chronic Obstructive Lung Disease. The 2020 GOLD Science Committee Report on COVID-19 and Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med. 2021 Jan 1
[28]Peters MC, et al . COVID-19-related Genes in Sputum Cells in Asthma. Relationship to Demographic Features and Corticosteroids. Am J Respir Crit Care Med. 2020 Jul 1
[29]RECOVERY Collaborative Group; Horby P, et al . Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med. 2021 Feb
[30]Ramakrishnan S, et al . Inhaled budesonide in the treatment of early COVID-19 (STOIC): a phase 2, open-label, randomised controlled trial. Lancet Respir Med. 2021 Jul
[31]Singanayagam A, Glanville N, Girkin JL, et al. Corticosteroid suppression of antiviral immunity increases bacterial loads and mucus production in COPD exacerbations. Nat Commun. (2018) 9.
[32]Schultze A, Walker AJ, MacKenna B, et al. Risk of COVID-19-related death among patients with chronic obstructive pulmonary disease or asthma prescribed inhaled corticosteroids: an observational cohort study using the OpenSAFELY platform. Lancet Respir Med. (2020) 8.
[33]Yamaya M., Nishimura H., Deng X., et al. Inhibitory effects of glycopirronium, formoterol, and budesonide on coronavirus RNA replication and cytokine production by primary cultures of human nasal and tracheal epithelial cells. Respir Investig. 2020
[34]Villamañán E, Sobrino C, Carpio C, et al.Inhaled bronchodilators use and clinical course of adult inpatients with Covid-19 pneumonia in Spain: A retrospective cohort study. Pulm Pharmacol Ther. 2021 Aug
[35]Spyropoulos AC, Goldin M, Giannis D, et.al Efficacy and Safety of Therapeutic-Dose Heparin vs Standard Prophylactic or Intermediate-Dose Heparins for Thromboprophylaxis in High-risk Hospitalized Patients With COVID-19: The HEP-COVID Randomized Clinical Trial. JAMA Intern Med. 2021 Dec 1;
[36]Billett HH, Reyes-Gil M, Szymanski J, et.al Anticoagulation in COVID-19: Effect of Enoxaparin, Heparin, and Apixaban on Mortality. Thromb Haemost. 2020 Dec;
[37]RECOVERY Collaborative Group. Baricitinib in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial and updated meta-analysis. Lancet. 2022 Jul 30;400(10349):359-368. doi: 10.1016/S0140-6736(22)01109-6
[38]Marconi VC, Ramanan AV, de Bono S, et al .Efficacy and safety of baricitinib for the treatment of hospitalised adults with COVID-19 (COV-BARRIER): a randomised, double-blind, parallel-group, placebo-controlled phase 3 trial. Lancet Respir Med. 2021 Dec;
[39]Furqan M, Mukhi N, Lee B, et al .Dysregulation of JAK-STAT pathway in hematological malignancies and JAK inhibitors for clinical application. Biomark Res. 2013 Jan 16
[40]Luo P, Liu Y, Qiu L, et al .Tocilizumab treatment in COVID-19: A single center experience. J Med Virol. 2020 Jul;
[41]O'Halloran J, Kedar E, Anstrom KJ, et al . Infliximab for Treatment of Adults Hospitalized with Moderate or Severe Covid-19. medRxiv [Preprint]. 2022 Sep 26
[42]Matthew P. Velez & Matthew W. McCarthy (2023) Infliximab as a potential treatment for COVID-19, Expert Review of Anti-infective Therapy, 21
[43]Galindo-Andúgar MA. Impact of N-Acetylcysteine in the mortality of patients hospitalized with COVID-19: a retrospective cohort study. Rev Clin Esp (Barc). 2023 Jul 21
[44]Horowitz RI, Freeman PR, Bruzzese J. Efficacy of glutathione therapy in relieving dyspnea associated with COVID-19 pneumonia: A report of 2 cases. Respir Med Case Rep. 2020 Apr 21;
[45]Topal F., Nar M., Gocer H., et al. Antioxidant activity of taxifolin: an activity-structure relationship. Journal of Enzyme Inhibition and Medicinal Chemistry . 2016
[46]Adhikari B, Marasini BP, Rayamajhee B, et al. Potential roles of medicinal plants for the treatment of viral diseases focusing on COVID-19: A review. Phytother Res. 2021 Mar
[47]Fischer A, Sellner M, Neranjan S, et al Potential Inhibitors for Novel Coronavirus Protease Identified by Virtual Screening of 606 Million Compounds. Int J Mol Sci. 2020 May
专家介绍

曹洁
天津医科大学总医院呼吸与危重症医学中心主任,二级教授、主任医师、博士生导师;中华医学会呼吸病学分会常委、中国医师协会呼吸分会常委、中国慢阻肺联盟常委、中华医学会肺功能学组副组长、天津医学会呼吸分会主任委员、天津慢阻肺联盟主席、天津基层呼吸联盟主席;国家卫健委疾控局呼吸专家委员会委员、美国胸科学会会员、中华医学会专家会员;Thorax中文版、中华结核呼吸、国际呼吸、临床内科等杂志编委。
本文由《呼吸界》编辑 Jerry 整理,感谢曹洁教授的审阅修改!
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


