摘要
近年来随着新检出病原体的出现和细菌耐药性的增加,感染性疾病的诊断和治疗面临着严峻挑战。四环素类药物在临床应用广泛,药物品种也在不断更新,我国尚缺乏四环素类药物临床合理应用的指导性文件,部分医务人员对其药学特点和临床应用时机及用法存在疑惑。为进一步规范四环素类药物的临床应用,为各级医疗机构医务人员提供专业的循证医学建议,中华预防医学会医院感染控制分会和中国药理学会临床药理分会牵头,组织感染科、呼吸科、重症医学科、急诊科、感染控制中心、药学部等多个学科领域专家经过共识会议制订了临床常用四环素类药物合理应用多学科专家共识。本专家共识以国内常用的四环素类药物的药学特性为基础,以四环素类药物作用机制和耐药现状为依据,结合感染部位、病原体特点及细菌耐药性,关注特殊人群和超说明书用药,整合国内外指南推荐意见和最新循证医学证据,形成可供医疗机构临床医师、临床药师等专业人员参考的17条专家共识意见。鉴于感染性疾病的特殊性、复杂性及患者的个体差异性,为使患者获益,本专家共识形成的意见需实施个体化的抗感染策略。
关键词:四环素类;耐药菌;特殊病原体;合理用药;专家共识
四环素类药物是临床常用的一类抗菌药物,其对包括非典型病原体如支原体、衣原体、军团菌在内的多种病原体均有很强的抗菌活性。国内外指南推荐其作为社区获得性肺炎的一线治疗药物。虽已临床应用70余年,但对四环素类药物的药效学、药代动力学等相关研究并不充分,且缺乏大样本的随机对照研究评价其疗效和安全性。甘氨酰环素类药物替加环素在临床上常用于多重耐药菌感染的治疗,但存在超说明书用药和超剂量使用的情况,需要规范用药。新型四环素类药物奥马环素和依拉环素已在中国上市,但临床应用经验十分有限。如何合理使用四环素类药物,其适应证和启动时机、特殊人群用药等问题均困扰着一线临床医生,需要多学科共同探讨。因此,为优化四环素类药物的临床应用,尽可能减少不良反应,延缓耐药性的发生,在参阅国内外四环素类药物的临床应用研究进展及相关指南共识基础上,特制订本共识,为临床医生合理使用四环素类药物提供切实可行的参考。
本专家共识采用国际通用的德尔菲法,过程包括(1)题目的选定;(2)成立共识意见编写组、指导专家组、工作组;(3)提出关键问题;(4)任务分工与执行。在系统检索Medline、Embase、Cochrane 图书馆和中国知网、万方数据库的基础上,共识编写组根据循证医学证据和临床经验,提出27个临床关键问题。组织感染科、呼吸科、重症医学科、急诊科、感染控制科、药学部等多个学科领域专家进行五轮线上线下讨论,初拟20条专家意见。邀请所有编写组和指导组专家进行投票,对共识意见推荐级别评定为 6个等级:非常同意(A+),同意但有少许保留意见(A),同意但有较多保留意见(A-),不同意但有较多保留意见(D-),不同意但有少许保留意见(D),完全不同意(D+)。投票程序规定,同意推荐(A+,A,A-)比率≥60%的条目方可通过,<60%的条目将被删除,最终围绕四环素类药物治疗各部位感染的临床地位、特殊人群用药、不良反应与治疗药物浓度监测、超说明书用药等形成 17条专家共识意见,为四环素类药物的临床合理应用提供参考。
一、四环素类代表药物及其作用机制
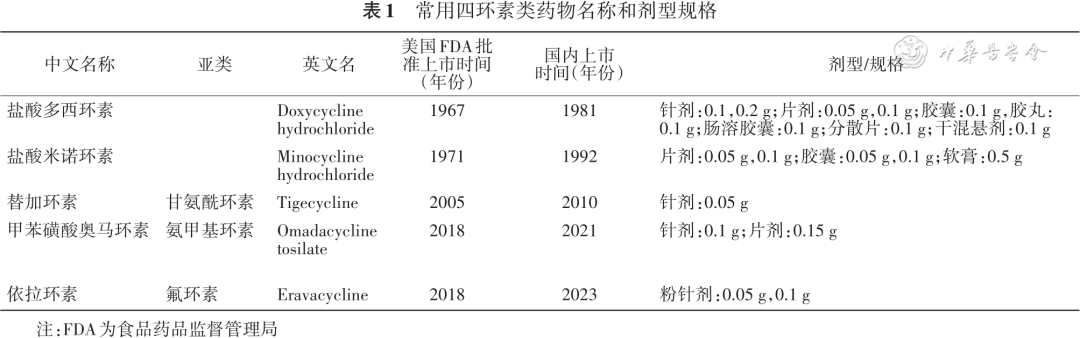
1948 年首个四环素类药物金霉素被发现,后通过分离或衍生获得多种其他四环素类药物,如美他环素、多西环素、米诺环素、赖甲环素。通过四环素侧链的结构改造,分别获得了甘氨酰环素类药物替加环素、氨甲基环素类药物奥马环素、氟环素类药物依拉环素,上述产品均已获批上市[ 1 ]。本共识涉及的临床常用四环素类药物见表1 。
四环素类药物经被动扩散和依赖能量的主动转运两种方式通过细菌细胞壁进入细胞内,能可逆地与细菌核糖体30 S 亚基 A位结合,阻止氨酰基-tRNA 与 mRNA-核糖体复合物受体部位结合,抑制细菌蛋白质的合成,达到抑制细菌生长的作用。广谱的甘氨酰环素类药物作用机制与四环素类似,其与细菌核糖体30 S亚基结合位点的亲和力是四环素的 5倍[ 2 ],能对抗细菌外排及核糖体保护所导致的四环素耐药性,对常见致病菌和多重耐药菌均具有良好的抗菌活性,广泛覆盖革兰阳性菌和阴性菌,包括耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)、产超广谱β-内酰胺酶(extended Spectrum Beta-Lactamases,ESBLs)的肠杆菌属细菌、嗜麦芽窄食单胞菌及多重药耐药鲍曼不动杆菌[ 3-4 ]。临床常用四环素类药物对常见微生物的抗菌活性见 表2 。

二、四环素类药物的药敏试验方法和药敏折点
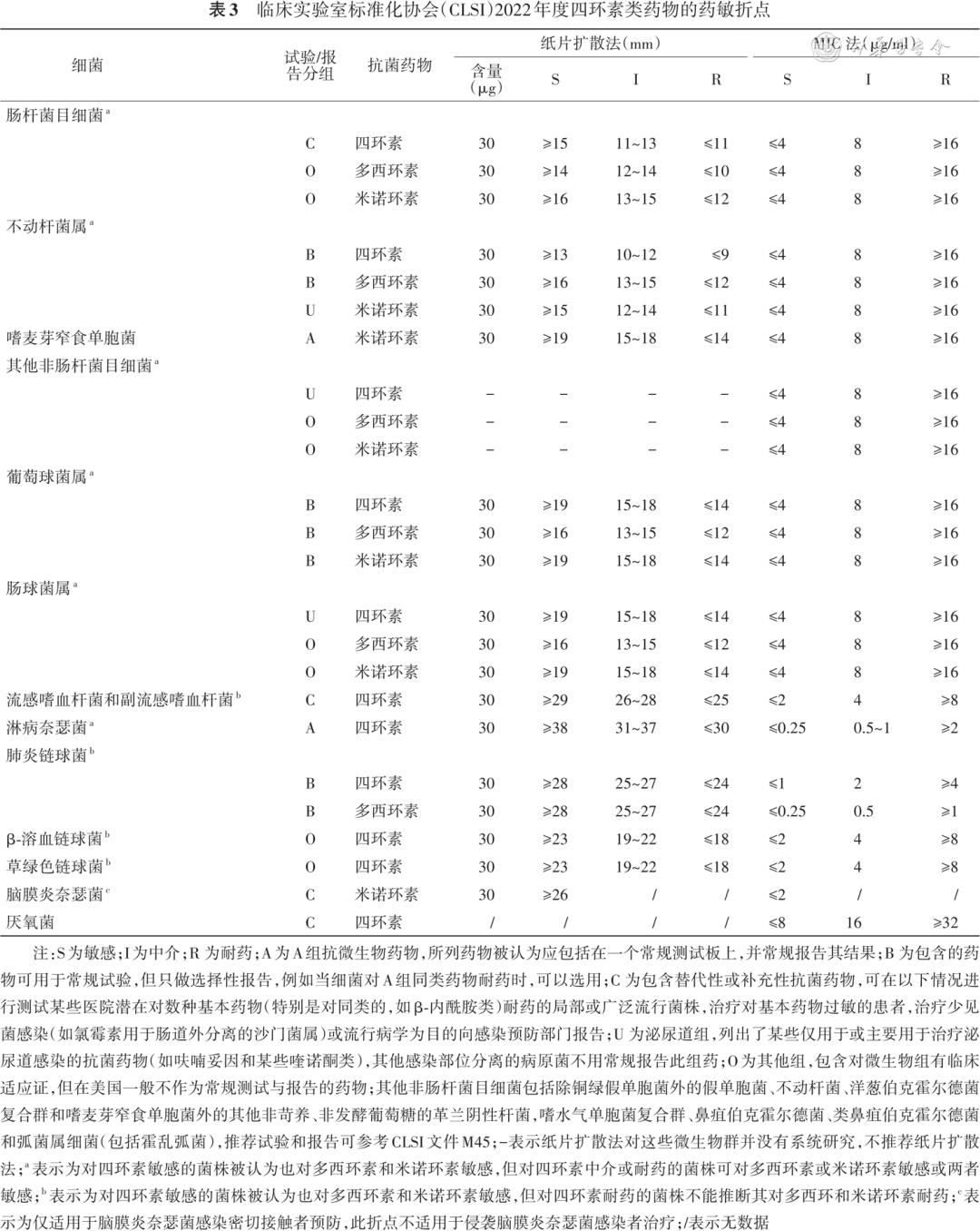
肠杆菌目细菌、不动杆菌属细菌等多种病原体推荐使用纸片扩散法、肉汤或琼脂稀释法[即最小抑菌浓度(minimum inhibitory concentration,MIC)法]进行四环素类药物的药敏试验,对其他非肠杆菌目细菌只推荐 MIC 法。临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)没有替加环素的药敏折点,建议使用美国食品药品监督管理局(Food and Drug Administration,FDA)或中国国家药物监督管理局(National Medical Products Administration,NMPA)折点[ 5 ]。不应常规报告四环素类药物对于脑脊液分离株的药敏结果,因为这类药物并非临床可选药物,可能无法有效治疗流感嗜血杆菌等引起的中枢神经系统感染。对四环素敏感的细菌通常也对多西环素和米诺环素敏感;但对四环素耐药的菌株不能推断其对多西环素和米诺环素耐药。天然对四环素类耐药细菌包括铜绿假单胞菌、摩氏摩根菌、变形杆菌属细菌、普罗威登斯菌等。CLSI 2022 年度四环素类药物的药敏折点推荐见 表3 [ 6 ]。
三、四环素类药物的耐药现状与耐药机制
据中国细菌耐药监测网2014—2019 年细菌耐药性监测报告[ 7 ],肺炎链球菌(非脑脊液)对米诺环素耐药率较高(约89%);鲍曼不动杆菌对各抗菌药物的耐药率大多数>50%,但对米诺环素的耐药率为18.7%~22.2%;嗜麦芽窄食单胞菌对米诺环素的耐药率为1.6%~2.8%;洋葱伯克霍尔德菌对米诺环素的耐药率为7.8%~11.0%;耐药率均相对较低。2021年全国细菌耐药监测报告(简要版)(http://www. carss.cn/Report/Details?aId=862)显示大肠埃希菌对替加环素耐药率为0.1%,肺炎克雷伯菌对替加环素耐药率为2.5%,鲍曼不动杆菌属对米诺环素耐药率为17.3%。奥马环素和依拉环素上市时间较短,国内暂无针对奥马环素、依拉环素药敏监测数据。
长期应用四环素类药物可使细菌产生四环素类抗性基因(TRGs),主要包括:一是细菌获得外排基因,例如外排基因tet(A)~tet(D)和tet(K)~tet(L),导致外排泵高表达,将四环素泵出胞外以减少细胞内药物;另一是产生核糖体保护基因,核糖体保护蛋白改变了核糖体构象,从而逃逸四环素对蛋白合成的抑制作用[ 3 ]。其他如修饰酶等机制也会对四环素类药物产生耐药性[ 3 ]。新型四环素类药物主要通过修饰基团克服细菌耐药性,如替加环素在C9使用D环甘氨酰环素取代N-烷基-氨酰氨基[ 8 ],奥马环素是在米诺环素结构基础上进行C9 位氨甲基修饰[ 9 ],依拉环素是在四环素核心D环上完成C-9位吡咯烷酰氨基和C-7位氟原子修饰[ 10 ]。
四、四环素类药物的药学特点
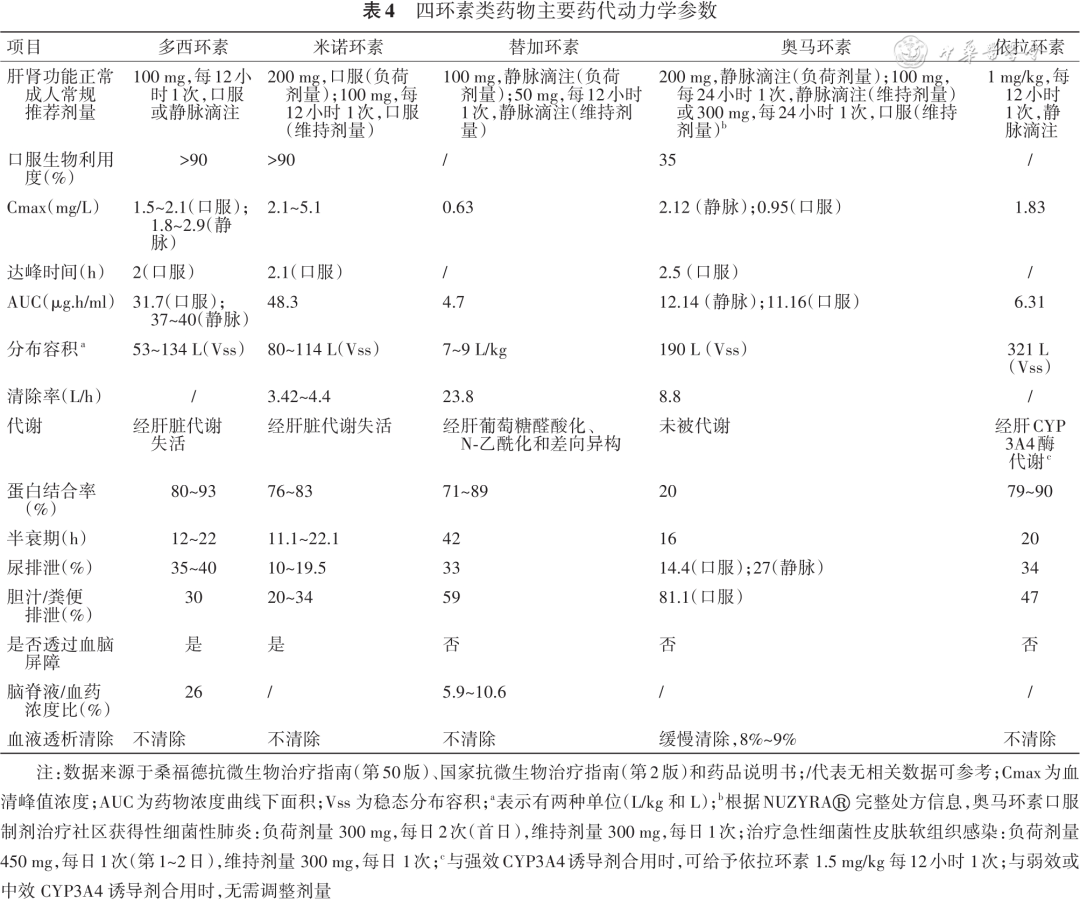
四环素类药物生物利用度有差异,多西环素和米诺环素口服吸收完全,生物利用度超过90%。在禁食的健康受试者中,口服奥马环素生物利用度为34.5%,由于肠道吸收不足,替加环素和依拉环素目前只有注射剂型。四环素类药物组织分布广泛,超过其血清容积。多西环素、米诺环素、替加环素和依拉环素经肝脏代谢,人肝微粒体和肝细胞的体外研究显示奥马环素不被代谢,以原型或活性产物形式通过尿液和胆汁/粪便排泄。四环素类药物为时间依赖性抗菌药物,且具有较长的抗菌药物后效应(postantibiotic effect,PAE),24小时血药浓度-时间曲线下面积(24 h area under the plasma concentration- time curve,AUC0~24)/MIC是预测治疗反应的药代动力学/药效学(pharmacokinetics/pharmacodynamics,PK/PD)参数[ 4 ]。四环素类药物药代动力学参数见表4 。
五、四环素类药物临床合理应用
专家共识意见1:针对疑似或确诊 MRSA所致的复杂皮肤软组织感染(cSSSI),可选择多西环素或米诺环素抗感染治疗;另外,可覆盖 MRSA 的口服药物还有奥马环素,静脉药物包括奥马环素和替加环素;诊断皮肤软组织感染后尽早给予抗感染治疗,疗程 一般为 7~14 d,需根据局部恢复情况决定。
2020年美国外科感染学会(Surgical Infection Society,SIS)更新发布了复杂皮肤软组织感染的管理指南[ 11 ]推荐,急性细菌性皮肤和皮肤软组织感染应考虑经验性覆盖 MRSA,尤其是化脓性感染。一项双盲试验中,将患有急性细菌性皮肤和皮肤软组织感染的成人(以1∶1的比例)随机分配接受奥马环素(100 mg静脉滴注,每12小时1次;然后 100 mg静脉滴注,每24小时1次)或利奈唑胺(600 mg静脉滴注,每12小时1次)治疗;输注3 d 后,过渡到口服奥马环素(300 mg,每24小时 1次)或口服利奈唑胺(600 mg,每12小时 1次);总治疗时间为 7~14 d。结果显示,在改良意向治疗人群中,奥马环素在临床反应方面不劣于利奈唑胺;且针对 MSSA 和 MRSA 感染,试验药物疗效相似[ 12 ]。另外一项欧洲的Ⅲ期随机对照试验显示,标准剂量替加环素(100 mg 首剂+50 mg 每12小时 1次)与万古霉素(1 g 静脉滴注,每12小时 1次)联合氨曲南(2 g 静脉滴注,每12小时 1次)治疗 cSSSI,两组治疗成功率相似[ 13 ]。目前依拉环素尚无cSSSI治疗的适应证,有待进一步临床应用验证。
专家共识意见2:针对非典型病原体如支原体、衣原体和军团菌,四环素类药物抗菌活性强、敏感性高。四环素类药物可作为非典型病原体引起的 CAP 的一线治疗药物,也可作为肺炎链球菌、金黄色葡萄球菌等常见病原体导致CAP患者的治疗药物,诊断 CAP后应尽早使用抗感染药物开始经验性治疗。轻症CAP患者可选用多西环素或米诺环素单药治疗;重症或有耐药菌感染风险患者可选用四环类药物联合治疗,此处四环素类包括多西环素、米诺环素、替加环素和奥马环素,通常轻、中度 CAP 者疗程为 5~7 d,非典型病原体治疗反应较慢者疗程延长至 10~14 d。针对泌尿系支原体、衣原体感染首选多西环素、次选米诺环素,连续给药 7 d;针对淋球菌尿道炎感染应经验性针对沙眼衣原体感染进行治疗。替加环素、奥马环素和依拉环素可用于快生长型非结核分枝杆菌感染的治疗。针对布鲁菌感染通常需要多西环素与其他抗菌药物联用,用药时应考虑长期用药的安全性和口服剂型序贯性。
中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[ 14 ]推荐:肺炎支原体肺炎和鹦鹉热衣原体肺炎,可选多西环素,首剂 200 mg 口服,此后 100 mg 口服,每天2次;米诺环素,100 mg 口服,每天2次。伯氏考克斯体感染(Q 热),可选多西环素,200 mg 口服,每天1次;米诺环素,100 mg 口服,每天2次。而在肺炎衣原体、军团菌、鼠疫耶尔森菌 感染的治疗中,二者为次选抗菌药物。一项Ⅲ期临床研究结果显示,对于死亡风险较高CAP患者(年龄≥50岁,肺炎严重度指数(pneumonia severity index,PSI)评分≥3分或存在肺炎链球菌菌血症),替加环素治疗组与左氧氟沙星治疗组效果接近[ 15 ]。奥马环素在治疗急性CAP方面疗效不逊于莫西沙星和利奈唑胺。一项Ⅰ期开放性研究显示,依拉环素在上皮衬液(epithelial lining fluid,ELF)和肺泡巨噬细胞(AM)中的浓度较血浆浓度高,可应用于肺部感染治疗,目前仍需进一步临床应用来验证[ 16 ]。
基于指南的尿路感染诊治方案推荐,针对泌尿系衣原体、支原体感染首选单独给予多西环素,次选米诺环素,均口服,连续 7 d;对于可能患有淋病性急性附睾炎的男性,必须使用抗淋球菌和沙眼衣原体的联合治疗方案:头孢曲松 500 mg 肌内注射单剂,加多西环素 200 mg初始剂量口服,后 100 mg 口服,每天2次,疗程 10~14 d[ 17 ]。一项随机研究显示,使用多西环素治疗直肠衣原体感染的微生物学治愈率为 100%,而使用阿奇霉素则为 74%[ 18 ]。另一项随机多中心研究显示,盐酸米诺环素和左氧氟沙星对细菌清除率分别为 94.92%、93.85%,临床有效率分别为 86.84%、84.43%,两组差异无统计学意义[ 19 ]。
有研究显示,替加环素和奥马环素对支原体和解脲脲原体的抗菌活性不受四环素耐药机制的影响,对人型支原体、解脲脲原体敏感性高[ 20-21 ]。多西环素、替加环素和奥马环素对肺炎衣原 体、沙眼衣原体体外敏感性高[ 9 , 22 ]。多西环素、替加环素、依拉环素和奥马环素对军团菌均具有良好的体外抗菌活性[ 23-25 ]。替加环素、依拉环素和奥马环素对快生长型分枝杆菌属(包括脓肿分枝杆菌、龟分枝杆菌、偶发分枝杆菌等)具有良好体外抗菌活性[ 10 , 26 ]。脓肿分枝杆菌复合群对依拉环素则高度敏感,而奥马环素对所有快生长型非结核分枝杆菌均有效[ 27 ]。替加环素对慢生长型分枝杆菌属(如鸟胞 内分枝杆菌复合体、海分枝杆菌、堪萨斯分枝杆菌等)抗菌活性差,奥马环素对慢生长型非结核分枝杆菌的MIC值高于替加环素[ 28 ]。针对布鲁菌所致的感染,治疗原则为早期、联合、足量、足疗程,一线治疗方案为多西环素联合利福平或链霉素;难治性病例可加用喹诺酮类或第三代头孢菌素;一般疗程为6周,部分病例需 2~3个疗程[ 29-30 ]。
专家共识意见3:针对碳青霉烯类耐药肠杆菌(carbapenem-resistant Enterobacteriaceae,CRE)和碳青霉烯类耐药鲍曼不动杆菌(carbapenem-resistant Acinetobacter baumannii,CRAB)所致的医院获得性肺炎(hospital-acquired pneumonia,HAP)/呼吸机相关肺炎(ventilator associated pneumonia,VAP)患者,由于替加环素在肺组织中分布不足,标准剂量单药治疗一般疗效不佳,需与碳青霉烯类、黏菌素等联合应用,疗程一般7 d以上;在治疗成人重症医院HAP时,推荐使用大剂量替加环素方案联合治疗,重症患者可适当延长疗程。
一项Ⅱ期临床研究显示,与 75 mg 剂量的替加环素或常规治疗剂量的亚胺培南/西司他丁治疗 HAP相比,替加环素 100 mg 每12小时1次治疗呈现更多获益的趋势[ 31 ]。标准剂量(100 mg 首剂+50 mg 每12小时1次)替加环素治疗组 HAP患者的治愈率低于亚胺培南/西司他丁治疗组患者[ 32 ]。因此,对于严重感染及多重耐药菌肺部感染患者,临床推荐使用大剂量替加环素(HDT)方案,初始剂量200 mg,随后100 mg 静脉滴注,每12小时 1次[ 33 ]。大剂量替加环素在病原体清除和病死率改善方面具有优势,并且未见明显的不良反应[ 34 ]。一项体外药效学模型模拟替加环素和美罗培南在肺炎患者上皮衬液中的作用,研究显示两种药物联合对碳青霉烯类耐药肺炎克雷伯菌(carbapenem-resistant klebsiella pneumoniae,CRKP)具有协同效应[ 35 ]。有研究表明,替加环素与多黏 菌素E联用治疗CRKP引起的 HAP/VAP较单药治疗能获得更好的临床治愈率[ 36-37 ]。嗜麦芽窄食单胞菌是HAP/VAP的病原体之一,四环素类体外对嗜麦芽窄食单胞菌具有抗菌活性,治疗其引起的感染可选米诺环素、多西环素或替加环素,临床经验均十分有限,严重感染、混合感染及耐药菌感染需联合其他抗菌药物治疗[ 38 ]。奥马环素和依拉环素无HAP/VAP适应证,仍需进一步研究。一项多中心回顾性研究表明依拉环素超适应证治疗肺部感染和皮肤软组织感染有效[ 39 ]。
专家共识意见4:针对CRE和 CRAB引起的腹腔感染,替加环素治疗效果较好,在耐药菌感染或其他抗菌药物疗效不佳的情况下,可选择含替加环素的联合用药方案;依拉环素对常见病原体(包括对其他四环素耐药者)引起的腹腔感染较替加环素有更高的临床疗效和 更好的耐受性;疗程一般为 5~14 d。
《中国腹腔感染诊治指南(2019版)》[ 40 ]强调,替加环素用于腹腔感染推荐的给药方案为标准剂量(100 mg首剂+50 mg 每12小时1次),疗程一般为 5~14 d,具体可根据感染严重程度及部位、患者的临床情况而定[ 12 , 13 , 41 ]。体外药敏试验显示,依拉环素对临床常见和重要的耐药菌均表现出良好的抗菌活性,其 MIC分布普遍低于替加环素,甚至对 CRE表现出良好的抗菌活性[ 23 ],且与碳青霉烯类抗生素和左氧氟沙星治疗腹腔感染的疗效相当[ 42 ]。两项双盲多中心研究显示,静脉滴注依拉环素治疗成人复杂腹腔内感染(cIAI)的疗效不劣于厄他培南或美罗培南,耐受性良好[ 41 , 43 ]。对于cIAI的早期经验性治疗,尤其是医院内获得感染,依拉环素是否比替加环素更具优势和安全性仍有待确定[ 44 ]。IDSA推荐在β-内酰胺类药物无效或无法耐受时,替加环素和依拉环素可作为CRE导致的腹腔感染的替代治疗方案[ 45 ]。根据患者血流动力学是否稳定,对于ICU术后腹腔感染可选择依拉环素单药或联合治疗。奥马环素无腹腔感染适应证,需进一步研究。
专家共识意见5:针对 CRE 和 CRAB 引起的复杂性尿路感染(complicated urinary tract infections,cUTI)以及尿路感染来源的全身脓毒症,无其他更好选择的情况下可选择替加环素;如果选择替加环素,建议联用其他组织药物浓度高且具有抗菌活性的药物。疗程至少10~14 d,需根据患者恢复情况来确定。奥马环素和依拉环素治疗泌尿系统感染的有效性和安全性仍需要进一步研究和评估。
有研究表明,替加环素可治疗cUTI并获得成功,但仅限于非对照小样本的临床病例研究和个案报道,且其单药治疗效果结论不统一,还需要进一步的随机对照试验评估替加环素治疗cUTI的疗效[ 18,46-47 ]。奥马环素在人体内基本不被代谢,口服 300 mg奥马环素后,81.1%从粪便中排泄,14.4% 经尿液排泄[ 48 ]。一项奥马环素治疗女性膀胱炎的随机、开放性Ⅰb期研究结果显示,患者使用奥马环素 5 d后,获得了预期的临床疗效,且微生物学反应良好[ 49 ]。一项Ⅰ期临床试验结果显示,单次静注依拉环素60 g后约34%在尿中排出,47%在粪便中排出[ 16 ]。但是,用于治疗cUTI的Ⅲ期临床试验未达到统计学非劣效性的主要终点[ 50 ]。
专家共识意见6:针对CRE和CRAB引起的中枢神经系统感染,一旦确诊或疑似颅内感染应尽早给予抗感染治疗,如高度怀疑碳青霉烯类耐药菌感染,尽管替加环素脑脊液穿透性较弱,如无其他更好选择时可选择替加环素静脉联合鞘内或脑室内注射给药,一般需与其他药物联合用药;疗程一般 4~8周,符合临床治愈标准后应继续抗感染1~2 周。替加环素鞘内/脑室内给药在其他药物治疗无效时可以有效治疗多重耐药菌颅内感染,但多为个案报道,其安全性和有效性有待更大规模的研究[ 51 ]。
参考《神经外科中枢神经系统感染诊治中国专家共识(2021版)》[ 52 ]推荐,针对 CRE中枢神经系统感染,可选择替加环素+阿米卡星或美罗培南或磷霉素,替加环素+多黏菌素;针对CRAB中枢神经系统感染,可选择替加环素+舒巴坦(或含舒巴坦制剂)、美罗培南或多黏菌素。由于脑脊液穿透能力弱,替加环素可静脉用药联合鞘内或脑室内注射给药,剂量1~10 mg/12 h,具体疗程需根据患者反应决定。Sipahi等[ 53 ]报道单用或联合应用替加环素治疗CRAB引起的脑膜炎,治疗成功率为70%。邱炳辉等[ 54 ]报道基于多黏菌素或替加环素联合舒巴坦的治疗能够提高多重耐药鲍曼不动杆菌颅内感染的治愈率。但替加环素鞘内/脑室内给药多为个案报道,其安全性和有效性有待更大规模的研究。奥马环素和依拉环素中枢神经系统感染效果有待进一步研究。
专家共识意见7:针对CRE和CRAB引起的血流感染不推荐首选四环素类药物,如无其他更好选择时可联合用药。四环素类药物应用于中重度血流感染时可以与舒巴坦或含舒巴坦的复方制剂、碳青霉烯类、多黏菌素等多种药物联合。疗程通常为2周。依拉环素或奥马环素由于缺少临床数据支持,暂不作推荐。
MDRO诊治专家共识[ 55 ]建议以替加环素为基础的联合治疗方案可作为CRE和CRAB的备选治疗方案,在替加环素MIC<1 mg/L时选择使用,对于重症患者必要时可予三药联合治疗,血流感染疗程通常为2周。针对 CRAB 导致的感染,基于替加环素的常规剂量治疗方案病死率高于其他治疗方案[ 56-57 ]。一项前瞻性、观察性、多中心研究显示,在治疗 CRAB(替加环素 MIC>2 μg/ml)菌血症时,相比黏菌素+碳青霉烯类治疗组,黏菌素+替加环素治疗组14 d病死率增加(P=0.009)[ 58 ]。治疗失败的部分原因可能是 CRAB对替加环素 MIC的升高,以及替加环素 使用剂量不足[ 59 ]。基于循证医学证据,国外最新指南推荐,使用大剂量替加环素(200 mg 静脉注射,随后 100 mg 静脉注射,每12小时1次)治疗CRAB导致的中重度感染。应基于患者特点个体化选择四环素类药物联合抗菌方案[ 60 ]。当替加环素的 MIC值>2 μg/ml时,无论是单独使用还是联合使用均应谨慎选择替加环素。
体外实验结果显示,四环素类药物与黏菌素、阿米卡星和碳青霉烯类等其他药物联合使用时具有协同抑制 CRAB的作用[ 61-65 ]。72 h的体外药效学模型研究结果显示,高剂量的米诺环素(游离药物fAUC0~24h/MIC=21.2)、多黏菌素B(游离药物fAUC0~24h/MIC=15.6)和持续输注舒巴坦(游离药物浓度高于MIC的时间,fT>MIC=67%)的三联疗法对CRAB具有明显的杀伤作用[ 66 ]。与多黏菌素B单独使用相比,多黏菌素B和替加环素联合使用在8 h内导致细菌数量明显减少,两者具有协同作用[ 67 ]。一项米诺环素对XDR-AB医院感染(肺炎占比80.6%)作用的系统综述显示,使用米诺环素的患者91.7%(200/218)采用了联合抗菌方案,最常见的联合药物为黏菌素或碳青霉烯类,临床和微生物学成功率 分别为72.6%、60.2%[ 68 ]。另一项针对CRAB抗菌药物治疗策略的多中心研究纳入282例(91.1%为肺炎)患者,相比其他方案,含米诺环素的治疗方案显示出最佳的抗微生物作用[ 69 ]。
六、四环素类药物在特殊人群的用药建议
专家共识意见8:不建议妊娠期妇女使用四环素类药物。但在某些特殊感染如落基山斑疹热(Rocky Mountain spotted fever,RMSF)时,在权衡利弊后,可以使用多西环素。
因对母亲有肝毒性风险,大多数四环素类药物在妊娠期禁用,且四环素类药物可透过胎盘屏障进入胎儿体内,对胎儿的骨骼与牙齿发育有不良影响,如中期和晚期妊娠的宫内暴露导致乳牙永久性变色和进入胎儿的长管状骨引起暂时性生长抑制[ 70 ]。但另一项系统评 价研究显示,妊娠期使用多西环素与致畸作用或儿童牙齿染色之间并无关联,有限的数据和缺乏对照研究使得结论存在局限性[ 71 ]。此外,多西环素被认为是治疗孕妇RMSF的可选药物[ 72 ]。
专家共识意见9:哺乳期妇女应避免长期使用四环素类药物,单次或短期(1周内)使用多西环素相对安全。基于药物半衰期,多西环素、米诺环素、奥马环素和依拉环素治疗期间和末次给药后4 d内不应进行母乳喂养,替加环素半衰期较长需更谨慎使用。
四环素类药物可在人类母乳中排泄,但接受母乳喂养的婴儿对四环素类药物的吸收程度尚不清楚。因婴儿牙齿染色和骨生长抑制的可能性,哺乳期妇女应避免长期使用四环素,但单次或短期(1周内)使用多西环素治疗RMSF是安全的。对于莱姆病的治疗,哺乳期妇女是多西环素的相对禁忌证[ 73 ]。
专家共识意见10:不建议婴幼儿和8岁以下的儿童使用四环素类药物。无其他抗菌药物可用情况下,在权衡利弊后,允许所有年龄段儿童短疗程(≤21 d)使用多西环素。
8岁以下儿童使用较长疗程的四环素类药物可引起永久性牙变色。但与其他四环素相比,多西环素不太容易与钙结合,如果短疗程使用,多西环素引起牙齿染色的风险很低[ 71,74 ]。美国CDC和儿科学会推荐多西环素作为所有年龄段儿童疑似立克次体病的首选治疗方法,允许对所有年龄儿童使用疗程≤21 d的多西环素[ 72 ]。一项观察性研究纳入53例儿童,均8岁前接受过约2个疗程多西环素治疗 RMSF,发现其恒牙均未出现牙齿染色[ 75 ]。因尚未确定18岁以下儿童患者的安全性和有效性,不建议18岁以下的患者首选替加环素。在无其他抗菌药物可用的情况下,基于少量儿童药代动力学研究数据,8~17岁的儿童患者可参考药品说明书调整剂量使用,不建议8岁以下的儿童用药[ 76 ]。
专家共识意见11:对于轻度至中度肝功能不全的患者(Child Pugh 分级A和B级),四环素类药物无需调整剂量。严重肝功能不全(Child Pugh分级C级)的患者应谨慎用药,并监测治疗反应:替加环素的首剂为100 mg,维持剂量在常规剂量50 mg,每12小时1次的基础上减半为25 mg,每12小时1次;依拉环素首日剂量1 mg/kg,每12小时1次,第2天开始减少给药频次为1 mg/kg,每24小时1次;奥马素无需调整用药剂量。多西环素和米诺环素在重度肝功能不全患者中的推荐 剂量尚无可靠依据,仍需开展更多高质量的临床研究。
由不同程度肝损伤患者和对照组组成的单剂量试验结果显示,中度和重度肝损伤患者替加环素清除率分别降低 25%、55%,半衰期分别延长 23%、43%[ 77 ]。因此,建议重 度肝损伤患者替加环素初始剂量为100 mg,随后 25 mg,每12小时1次维持;轻度或中度肝损伤患者无需调整剂量。一项肝功能损伤患者与健康受试者奥马环素的药代动力学特点研究显示,轻度肝功能损伤者给药方案为奥马环素100 mg 静脉滴注 每天1次或300 mg口服每天1次;中度和重度肝功能损伤者给药方案为奥马环素50 mg静脉滴注每天1次或150 mg口服每天1次[ 78 ]。奥马环素在不同肝功能损伤程度、不同给药途径下,不良反应差异无统计学意义。依拉环素的药代动力学数据显示,与健康受试者相比,轻度(Child-Pugh A级)、中度(Child-Pugh B 级)和重度(Child-Pugh C级)肝损伤受试者,依拉环素的血清峰值浓度(Cmax)分别升高13.9%、16.3%、19.7%[ 78 ];与健康受试者相比,轻度、中度和重度肝损伤受试者依拉环素的从0到无穷大时间的血药浓度-时间曲线下面积(area under the concentration-time curve from time 0 extrapolated to infinite time,AUC0~inf)分别升高 22.9%、37.9%、110.3%[ 78 ]。基于这些药代动力学数据,建议无需调整轻度或中度肝损伤患者依拉环素用药剂量,但重度肝功能不全患者适当减量,首日剂量为1 mg/kg,每12小时1次,继以1 mg/kg,每24小时1次维持。
专家共识意见12:肾功能不全、接受血液透析、腹膜透析或持续血液滤过的患者无需对多西环素、替加环素、奥马环素和依拉环素进行剂量调整。目前证据不足以确定肾功能 不全患者使用米诺环素是否需要调整剂量,建议每日总剂量不超过 200 mg。考虑到四环素类药物的抗合成代谢作用,用药期间监测尿素氮和肌酐。
目前证据表明,多西环素、替加环素、奥马环素以及依拉环素的应用不受肾功能的影响。米诺环素在肾功能损伤患者中的药代动力学数据尚未明确,目前证据不足以确定是否需要调整剂量。对于肾功能损伤患者,使用米诺环素缓释剂型时建议减少总剂量或延 长给药间隔,其他剂型建议 24 h 内总给药剂量不超过 200 mg。
七、四环素类药物的药物不良反应及治疗药物浓度监测
四环素类药物对于非特殊人群安全性较好,最常见的不良事件是胃肠道症状,如上腹部不适和恶心。牙齿发育期间使用四环素类药物,可能导致牙齿黄染及釉质发育不全[ 79 ]。
多西环素可引起药疹、日光皮炎,静脉用药可发生静脉炎,大多数表现为轻度,减慢输液速度或局部湿敷可缓解症状,其余不良反应包括消化道不适、肝毒性及二重感染[ 80 ]。米诺环素的主要不良反应是过敏反应和消化道反应,大剂量长期使用米诺环素可引起皮肤色素沉着、肝损伤[ 81 ]。替加环素的不良反应临床表现复杂多样,主要累及血液系统(36.21%)、消化系统(20.69%)、皮肤软组织及附件(17.24%)[ 82 ]。替加环素导致的一般不良反应为牙齿永久性变色、胆红素水平升高、胃肠道不适以及静脉炎等。严重不良反应包括急性胰腺炎、肝衰竭、血细胞减少、低血糖和凝血功能障碍等[ 83 ]。替加环素会引起剂量依赖性血液系统异常,通常包括血浆纤维蛋白原降低、凝血酶原时间和活化部分凝血活酶时间增加,以及血小板减少。危险因素包括治疗时间>2周,以及肝或肾功能降低导致替加环素清除率降低[ 84-85 ]。临床试验中CAP患者使用奥马环素出现的药物不良反应主要是转氨酶升高、血压升高、失眠、恶心、呕吐、便秘及头痛[ 86 ]。口服奥马环素恶心和呕吐的发生率分别为30.2%、16.9%[ 87 ]。临床试验中依拉环素耐受性良好,与其他四环素相比,恶心、呕吐和腹泻的发生率更低,发生率分别为<5%、4%、3%[ 41,88 ]。早期真实世界多中心临床研究中依拉环素主要不良反应包括消化道反应(6.7%)、肝毒性(2.4%)、肾毒性(1.2%)、皮肤过敏(0.6%),3.6%导致停药,整体耐受性良好[ 39 ]。
专家共识意见13:使用四环素类药物无需皮试,但因其可引起多种机制的过敏反应,用药前应做好严重过敏反应的预案。对于曾发生四环素类药物严重不良反应的患者,因可能交叉过敏,应避免再次使用四环素类药物。
四环素类药物的说明书均未要求在使用前进行皮试。与β-内酰胺类药物相比,四环素类药物通常被认为较少发生过敏反应,现阶段关于四环素类药物过敏反应的数据大部分来源于个案报道[ 89 ]。四环素类药物可引起多种机制的过敏反应,IgE介导的Ⅰ型超敏反应临床表现为荨麻疹、喉头水肿、支气管痉挛和呼吸窘迫,甚至发展至过敏性休克[ 90 ]。米诺环素在体内的代谢产物包含亚氨基醌衍生物,可作为半抗原与人体大分子蛋白载体结合,引起抗原-抗体免疫反应[ 91 ],其引起的包括斑丘疹、超敏综合征(DRESS)、Stevens-Johnson 综合征(Stevens-Johnson syndrome,SJS)/中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)等严重过敏反应较其他四环素类更为常见。虽然目前国内尚未有四环素类药物严重交叉过敏反应的报道,但由于过敏反应可发生于共同内核或不同支链成分,因此同类药物之间可能存在交叉过敏反应。国外曾报告交叉过敏反应个案[ 92,93 ]。
专家共识意见14:建议有条件开展治疗药物浓度监测(TDM)的医疗机构针对危重症患者、严重肝功能不全患者开展替加环素的血药浓度监测,并根据 PK/PD 指导临床用药。使用替加环素治疗颅内感染时,可监测脑脊液药物浓度,如样本获取困难可监测血药浓度。
目前临床上未针对四环素类药物常规开展TDM,国内外可见替加环素血药浓度监测的个案报道和群体药代动力学研究。研究表明,替加环素 MIC升高和给药剂量不足可能是引起治疗失败的主要原因,临床上超说明书的高剂量替加环素给药方 案的广泛使用,也使得毒性反应风险更高[ 94 ]。鉴于超说明书用药经验有限,有临床专家认为 有必要针对危重患者开展替加环素TDM,并利用 PK/PD理论精准指导临床用药剂量[ 95 ]。群体药动学研究模型结果表明,严重肝功能障碍(Child-Pugh分级C级)患者替加环素清除率显著降低,需要依据血药浓度监测精准指导用药[ 96 ]。替加环素的 PK/PD呈现时间依赖性特点,且具有较长的PAE,AUC0~24/MIC 通常作为替加环素的药效学评价指标,目标值因感染疾病类型、细菌耐药性及患者人群不同而存在差异。目前未能就替加环素的治疗目标浓度范围达成共识。除了对有效性进行监测外,有研究推荐使用谷浓度预测肝毒性反应,结果显示发生肝毒性的折点为474.8 ng/mL,即当谷浓度大于该值时,替加环素诱导肝损伤的风险大大增加[ 97 ]。替加环素成功治疗颅内感染与脑脊液中有效药物浓度密切相关,脑脊液中抗菌药有效治疗浓度应为致病菌MIC的10~20倍[ 98 ]。一般而言,替加环素血脑屏障穿透性低(<5%),脑脊液渗透作用在血脑屏障受到神经外科损伤破坏的情况下可能会增强,但对于广泛耐药的鲍曼不动杆菌(XDR-AB)不推荐仅静脉使用替加环素治疗。对于此种感染类型,推荐使用静脉滴注联合鞘内注射的给药方式[ 52 ],血药浓度通常可以接近PK/PD目标[ 99 ]。液质联用测定替加环素脑脊液浓度的方法灵敏、准确且稳定[ 100 ],但临床脑脊液样本获取困难且目标浓度范围尚无可靠依据。
此外,有文献报道,在Q热和Whipple 病患者中使用超高效液相色谱法联合紫外线光谱监测米诺环素和多西环素的血药浓度,但此法尚未获得推广[ 97 ]。
八、四环素类药物超说明书用药
专家共识建议15:临床诊疗过程中,无其他合理的可替代药物治疗方案时,在充分的循证医学证据支持基础上,经患者知情同意后,选择四环素类药物超说明书用药方案,需经医疗机构药事管理部门批准并备案,并建立相应管理机制。
专家共识意见16:超适应证用药:替加环素治疗HAP(含VAP)、血流感染等均缺乏充分的循证医学的证据。基于现有的研究,建议不推荐替加环素作为首选治疗药物,对有广泛耐药(extensively drug resistant,XDR)阴性菌感染风险的 HAP(含 VAP)和继发性菌血症患者,且其他药物无法使用时,其初始经验性抗感染治疗或依据病原学结果,可考虑替加环素作为联合治疗药物之一。
基于有限的药物选择,国内指南提出替加环素可用于有 XDR 阴性菌感染风险的 HAP(含 VAP)患者[ 14 ]。一项多中心Ⅲ期临床研究包含 170例继发性菌血症患者(继发于 cSSSI、cIAI和社区获得性细菌性肺炎)的汇总结果显示,替加环素组的总体临床治愈率为 81.3%,对照组(包括万古霉素联合氨曲南、亚胺培南/西司他丁、左氧氟沙星、万古霉素或利奈唑胺)总体临床治愈率为 78.5%(P=0.702),安全性参数两组差异无统计学意义[ 101 ]。《替加环素临床应用评价细则》[ 102 ]中提到,替加环素可用于 MDR 鲍曼不动杆菌感染和 CRE 感染的治疗,但不包括中枢神经系统感染和尿路感染。
专家共识意见17:超剂量用药:治疗替加环素敏感菌所致 HAP(含 VAP)时,建议替加环素维持剂量加倍(100 mg,每12小时 1次)。治疗CRE、CRAB或替加环素MIC≥1 mg/L的鲍曼不动杆菌引起的重症感染可考虑维持剂量加倍(100 mg,每12小时 1次)。
IDSA[ 103 ]指出,相较于其他治疗药物,标准剂量的替加环素治疗 HAP(含 VAP)临床疗效降低,病死率增加,不建议使用标准剂量替加环素治疗不动杆菌属细菌引起的 HAP(含 VAP)。中国CRE感染诊治与防控专家共识[ 104 ]指出高剂量替加环素(100 mg 每12小时 1次)可用于确诊或高度怀疑CRE所致HAP(含 VAP)、皮肤软组织感染和腹腔感染,一般推荐两药或三药联合。对于替加环素MIC≥1 mg/L 的鲍曼不动杆菌感染应加量(200 mg 每日1次 或100 mg 每12小时 1次)或者联合治疗[ 105 ],加量治疗可能增加患者消化道不良反应,联合治疗宜根据体外药敏选用 MIC 值较低的药物。
本共识尚未解决的问题:未就四环素类药物治疗心内膜炎、眼内炎、骨关节炎等其他部位感染的临床地位形成推荐意见;由于缺乏真实世界研究和临床应用经验,且超说明书使用循证医学证据不足,本共识未就新型四环素类药物奥马环素和依拉环素超说明书使用形成专家意见。
本专家共识意见旨在规范常用四环素类药物的临床合理应用,在临床决策、抗菌药物选择等方面为临床医生提供参考及指导。任何指南或共识不可能涵盖所有临床现象。鉴于 感染性疾病的特殊性、复杂性及患者的个体差异性,临床实践中应在前述原则与框架内制订个体化治疗方案,使患者获益。
声明:随着用药经验的积累及相关临床研究的开展,本共识在发展中必然会表现出其在临床应用中的局限性。为此,专家组将与时俱进,继续跟进相关研究证据,并及时更新。本共识仅供临床医生和医疗机构参考,不作为法律依据及临床诊治准则,实际应用时应结合具体临床情况和患者自身状况。专家组不承担应用共识产生不良后果的任何法律责任。本共识以循证医学为依据,对四环素类药物的治疗地位及治疗方案、血药浓度监测、特殊人群用药、超说明书用药及过敏反应等方面进行了总结,为保证患者合理、安全地使用四环素 类药物提供推荐意见。专家组人员与所提及的相关医疗及药物机构并不存在利益往来,同时,此共识是所有专家组人员基于平等、互助、发展的前提下参与制订的,参与制订的人员之间不存在业务及经济方面的利益冲突。
临床常用四环素类药物合理应用多学科专家共识编写组成员
顾问:吴安华[中南大学湘雅医院医院感染控制中心 国家老年疾病临床医学研究中心(湘雅)];崔一民(北京大学第一医院药学部);刘昭前(中南大学湘雅药学院)
项目主持者:刘韶[中南大学湘雅医院药学部 国家老年疾病临床医学研究中心(湘雅)];黄勋[中南大学湘雅医院医院感染控制中心 国家老年疾病临床医学研究中心(湘雅)]
执笔统筹:胡琴[中南大学湘雅医院药学部 国家老年疾病临床医学研究中心(湘雅)];孟秀娟(中南大学湘雅医院医院感染控制中心)
共识编写组(按姓氏汉语拼音为序):郭舜奇(广东省汕头市中心医院急诊科);郭伟(首都医科大学附属北京天坛医院急诊科);胡琴(中南大学湘雅医院药学部);黄勋(中南大学湘雅医院医院感染控制中心);金朝辉(四川大学华西医院药学部);李春辉(中南大学湘雅医院医院感染控制中心);孟秀娟(中南大学湘雅医院医院感染控制中心);吴安华(中南大学湘雅医院医院感染控制中心);徐萍(中南大学湘雅二医院药学部);周华(浙江大学医学院附属第一医院呼吸与危重症医学科);左笑丛(中南大学湘雅三医院);宗志勇(四川大学华西医院感染性疾病中心)
共识专家组(按姓氏汉语拼音为序):卞晓岚(上海交通大学医学院附属瑞金医院药剂科);陈佰义(中国医科大学附属第一医院感染病科);陈宏(哈尔滨医科大学附属第二医院呼吸科);陈孝(中山大学附属第一医院药学部);程璘令(广州医科大学附属第一医院呼吸与危重症学科 国家呼吸系统疾病临床医学研究中心);程真顺(武汉大学中南医院呼吸与危重症医学科);崔一民(北京大学第一医院药学部);戴海斌(浙江大学医学院附属第二医院药学部);董宇超(上海长海医院呼吸与危重症医学科);范国荣(上海交通大学附属第一人民医院临床药学科);冯靖(天津医科大学总医院呼吸与危重症医学科);李六亿(北京大学第一医院感染管理-疾病预防控制处);李雯(浙江大学医学院附属第二医院呼吸与危重症医学科);刘东(华中科技大学同济医学院附属同济医院药学部);刘韶(中南大学湘雅医院药学部);刘运喜(中国人民解放军总医院第一医学中心疾病预防控制科);梁宗安(四川大学华西医院呼吸与危重症医学科);刘昭前(中南大学湘雅药学院);卢金星(中国疾病预防控制中心传染病预防控制所);吕永宁(华中科技大学同济医学院附属协和医院药学部);潘频华(中南大学湘雅医院呼吸与危重症医学科);曲仪庆(山东大学齐鲁医院呼吸与危重症医学科);沈爱宗(中国科学技术大学附属第一医院安徽省立医院药学部);孙耕耘(安徽医科大学第一附属医院呼吸与危重症医学科);吴安华(中南大学湘雅医院医院感染控制中心);王婧雯(空军军医大学西京医院药学部);谢宝松(福建省立医院呼吸与危重症医学科);邢丽华(郑州大学第一附属医院呼吸与危重症医学科);肖永红(浙江大学医学院附属第一医院传染病重症诊治全国重点实验室);杨拴盈(西安交通大学第二附属医院呼吸与危重症医学科);张弨(首都医科大学附属北京同仁医院药学部);张兰(首都医科大学宣武医院药学部)
利益冲突:所有共识制定者声明不存在利益冲突
基金项目:湖南省卫生健康委重大项目(20201422)
参考文献
[1]GE Stein , WA Craig . Tigecycline: a critical analysis[J]. Clin Infect Dis, 2006, 43(4):518-524. DOI: 10.1086/505494 .
[2]D Schnappinger , W Hillen . Tetracyclines: antibiotic action, uptake, and resistance mechanisms[J]. Arch Microbiol, 1996, 165(6):359-369. DOI: 10.1007/s002030050339 .
[3]TH Grossman . Tetracycline antibiotics and resistance[J]. Cold Spring Harb Perspect Med, 2016, 6(4):a025387. DOI: 10.1101/cshperspect.a025387 .
[4]S Yaghoubi , AO Zekiy , M Krutova , et al. Tigecycline antibacterial activity, clinical effectiveness, and mechanisms and epidemiology of resistance: narrative review[J]. Eur J Clin Microbiol Infect Dis, 2022, 41(7):1003-1022. DOI: 10.1007/s10096-020-04121-1 .
[5]中国医疗保健国际交流促进会临床微生物与感染分会, 中华医学会检验医学分会临床微生物学组, 中华医学会微生物学与免疫学分会临床微生物学组. 多黏菌素类与替加环素及头孢他啶/阿维巴坦药敏方法和报告专家共识[J]. 中华检验医学杂志, 2020, 43(10):964-972. DOI: 10.3760/cma.j.cn114452-20200719-00619 .
[6]P Wayne . Performance standards for antimicrobial susceptibility testingagents[EB/OL]. [ 2023-02-01]. https://clsi.org/media/3481/m100ed30_sample.
[7]全国细菌耐药监测网. 全国细菌耐药监测网2014—2019年细菌耐药性监测报告[J]. 中国感染控制杂志, 2021, 20(1):15-30. DOI: 10.12138/j.issn.1671-9638.20216170 .
[8]I Chopra . New developments in tetracycline antibiotics: glycylcyclines and tetracycline efflux pump inhibitors[J]. Drug Resist Updat, 2002, 5(3-4):119-125. DOI: 10.1016/s1368-7646(02)00051-1 .
[9]董璐瑶, 李国庆, 游雪甫, 等. 奥玛环素研究进展[J]. 中国医药生物技术, 2020, 15(1):48-56. DOI: 10.3969/j.issn.1673-713X.2020.01.009 .
[10]GG Zhanel , D Cheung , H Adam , et al. Review of eravacycline, a novel fluorocycline antibacterial agent[J]. Drugs, 2016, 76(5):567-588. DOI: 10.1007/s40265-016-0545-8 .
[11]TM Duane , JM Huston , M Collom , et al. Surgical infection society 2020 updated guidelines on the management of complicated skin and soft tissue infections[J]. Surg Infect (Larchmt), 2021, 22(4):383-399. DOI: 10.1089/sur.2020.436 .
[12]FM Abrahamian , G Sakoulas , E Tzanis , et al. Omadacycline for acute bacterial skin and skin structure infections[J]. Clin Infect Dis, 2019, 69(Suppl 1):S23-S32. DOI: 10.1093/cid/ciz396 .
[13]W O′Riordan , C Cardenas , E Shin , et al. Once-daily oral omadacycline versus twice-daily oral linezolid for acute bacterial skin and skin structure infections (OASIS-2): a phase 3, double-blind, multicentre, randomised, controlled, non-inferiority trial[J]. Lancet Infect Dis, 2019, 19(10):1080-1090. DOI: 10.1016/S1473-3099(19)30275-0 .
[14]中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 255-280. DOI: 10.3760/cma.j.issn.1001-0939.2018.04.006 .
[15]C Tanaseanu , C Bergallo , O Teglia , et al. Integrated results of 2 phase 3 studies comparing tigecycline and levofloxacin in community-acquired pneumonia[J]. Diagn Microbiol Infect Dis, 2008, 61(3):329-338. DOI: 10.1016/j.diagmicrobio.2008.04.009 .
[16]KP Connors , ST Housman , JS Pope , et al. Phase I, open-label, safety and pharmacokinetic study to assess bronchopulmonary disposition of intravenous eravacycline in healthy men and women[J]. Antimicrob Agents Chemother, 2014, 58(4):2113-2118. DOI: 10.1128/AAC.02036-13 .
[17]B Ternes , F Wagenlehner . Guideline-based treatment of urinary tract infections[J]. Urologe A, 2020, 59(5):550-558. DOI: 10.1007/s00120-020-01174-0 .
[18]张建初, 辛建保, 向菲, 等. 注射用盐酸米诺环素治疗呼吸和泌尿系感染的多中心随机对照临床研究[J]. 中国抗生素杂志, 2008, 33(8):483-486, 498.
[19]G Wu , T Abraham , N Saad . Role of tigecycline for the treatment of urinary tract infections[J]. J Pharm Technol, 2014, 30(3):87-92. DOI: 10.1177/8755122513519332 .
[20]KB Waites , DM Crabb , Y Liu , et al. In vitro activities of omadacycline (PTK 0796) and other antimicrobial agents against human mycoplasmas and ureaplasmas[J]. Antimicrob Agents Chemother, 2016, 60(12):7502-7504. DOI: 10.1128/AAC.01734-16 .
[21]GE Kenny , FD Cartwright . Susceptibilities of mycoplasma hominis, m. pneumoniae, and ureaplasma urealyticum to gar-936, dalfopristin, dirithromycin, evernimicin, gatifloxacin, linezolid, moxifloxacin, quinupristin-dalfopristin, and telithromycin compared to their susceptibilities to reference macrolides, tetracyclines, and quinolones[J]. Antimicrob Agents Chemother, 2001, 45(9):2604-2608. DOI: 10.1128/AAC.45.9.2604-2608.2001 .
[22]PM Roblin , MR Hammerschlag . In vitro activity of GAR-936 against chlamydia pneumoniae and chlamydia trachomatis[J]. Int J Antimicrob Agents, 2000, 16(1):61-63. DOI: 10.1016/s0924-8579(00)00198-9 .
[23]BA Cunha . The atypical pneumonias: clinical diagnosis and importance[J]. Clin Microbiol Infect, 2006, 12Suppl 3∶12-24. DOI: 10.1111/j.1469-0691.2006.01393.x .
[24]A Assaidi , M Ellouali , H Latrache , et al. Antimicrobial susceptibility patterns of legionella spp. strains isolated from water systems in Morocco[J]. Microb Drug Resist, 2020, 26(8):991-996. DOI: 10.1089/mdr.2019.0218 .
[25]J Dubois , M Dubois , JF Martel . In vitro and intracellular activities of omadacycline against legionella pneumophila[J]. Antimicrob Agents Chemother, 2020, 64(5). DOI: 10.1128/AAC.01972-19 .
[26]D Felmingham . Tigecyclin--the first glycylcycline to undergo clinical development: an overview of in vitro activity compared to tetracycline[J]. J Chemother, 2005, 17Suppl 1:5-11. DOI: 10.1179/joc.2005.17.Supplement-1.5 .
[27]A Kaushik , NC Ammerman , O Martins , et al. In vitro activity of new tetracycline analogs omadacycline and eravacycline against drug-resistant clinical isolates of mycobacterium abscessus[J]. Antimicrob Agents Chemother, 2019, 63(6). DOI: 10.1128/AAC.00470-19 .
[28]BA Brown-Elliott , RJ Wallace Jr. In vitro susceptibility testing of omadacycline against nontuberculous mycobacteria[J]. Antimicrob Agents Chemother, 2021, 65(3). DOI: 10.1128/AAC.01947-20 .
[29]《中华传染病杂志》编辑委员会. 布鲁菌病诊疗专家共识[J]. 中华传染病杂志, 2017, 35(12):705-710. DOI: 10.3760/cma.j.issn.1000-6680.2017.12.001 .
[30]J Solís García del Pozo , J Solera . Systematic review and meta-analysis of randomized clinical trials in the treatment of human brucellosis[J]. PLoS One, 2012, 7(2):e32090. DOI: 10.1371/journal.pone.0032090 .
[31]K Vasilev , G Reshedko , R Orasan , et al. A Phase 3, open-label, non-comparative study of tigecycline in the treatment of patients with selected serious infections due to resistant gram-negative organisms including enterobacter species, acinetobacter baumannii and Klebsiella pneumoniae[J]. J Antimicrob Chemother, 2008, 62Suppl 1:i29-40. DOI: 10.1093/jac/dkn249 .
[32]AT Freire , V Melnyk , MJ Kim , et al. Comparison of tigecycline with imipenem/cilastatin for the treatment of hospital-acquired pneumonia[J]. Diagn Microbiol Infect Dis, 2010, 68(2):140-151. DOI: 10.1016/j.diagmicrobio.2010.05.012 .
[33]L Zha , L Pan , J Guo , et al. Effectiveness and safety of high dose tigecycline for the treatment of severe infections: a systematic review and meta-analysis[J]. Adv Ther, 2020, 37(3):1049-1064. DOI: 10.1007/s12325-020-01235-y .
[34]J Ramirez , N Dartois , H Gandjini , et al. Randomized phase 2 trial to evaluate the clinical efficacy of two high-dosage tigecycline regimens versus imipenem-cilastatin for treatment of hospital-acquired pneumonia[J]. Antimicrob Agents Chemother, 2013, 57(4):1756-1762. DOI: 10.1128/AAC.01232-12 .
[35]DE Wiskirchen , P Koomanachai , AM Nicasio , et al. In vitro pharmacodynamics of simulated pulmonary exposures of tigecycline alone and in combination against Klebsiella pneumoniae isolates producing a KPC carbapenemase[J]. Antimicrob Agents Chemother, 2011, 55(4):1420-1427. DOI: 10.1128/AAC.01253-10 .
[36]FG De Rosa , S Corcione , G Di Perri , et al. Re-defining tigecycline therapy[J]. New Microbiol, 2015, 38(2):121-136.
[37]SY Hou , D Wu , XH Feng . Polymyxin monotherapy versus polymyxin-based combination therapy against carbapenem-resistant Klebsiella pneumoniae: a systematic review and meta-analysis[J]. J Glob Antimicrob Resist, 2020, 23:197-202. DOI: 10.1016/j.jgar.2020.08.024 .
[38]周华, 李光辉, 卓超, 等. 中国嗜麦芽窄食单胞菌感染诊治和防控专家共识[J]. 中华医学杂志, 2013, 93(16):1203-1213. DOI: 10.3760/cma.j.issn.0376-2491.2013.16.002 .
[39]A Hobbs , MS Gelfand , KO Cleveland , et al. A retrospective, multicentre evaluation of eravacycline utilisation in community and academic hospitals[J]. J Glob Antimicrob Resist, 2022, 29:430-433. DOI: 10.1016/j.jgar.2021.10.020 .
[40]中华医学会外科学分会外科感染与重症医学学组, 中国医师协会外科医师分会肠瘘外科医师专业委员会. 中国腹腔感染诊治指南(2019版)[J]. 中国实用外科杂志, 2020, 40(1):1-16. DOI: 10.19538/j.cjps.issn1005-2208.2020.01.01 .
[41]JS Solomkin , J Gardovskis , K Lawrence , et al. IGNITE4: results of a phase 3, randomized, multicenter, prospective trial of eravacycline vs meropenem in the treatment of complicated intraabdominal infections[J]. Clin Infect Dis, 2019, 69(6):921-929. DOI: 10.1093/cid/ciy1029 .
[42]K Eljaaly , JK Ortwine , M Shaikhomer , et al. Efficacy and safety of eravacycline: a meta-analysis[J]. J Glob Antimicrob Resist, 2021, 24:424-428. DOI: 10.1016/j.jgar.2021.02.009 .
[43]J Solomkin , D Evans , A Slepavicius , et al. Assessing the efficacy and safety of eravacycline vs ertapenem in complicated intra-abdominal infections in the investigating gram-negative infections treated with eravacycline (IGNITE 1) Trial: A Randomized Clinical Trial[J]. JAMA Surg, 2017, 152(3):224-232. DOI: 10.1001/jamasurg.2016.4237 .
[44]LJ Scott . Eravacycline: a review in complicated intra-abdominal infections[J]. Drugs, 2019, 79(3):315-324. DOI: 10.1007/s40265-019-01067-3 .
[45]PD Tamma , SL Aitken , RA Bonomo , et al. Infectious diseases society of america guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa)[J]. Clin Infect Dis, 2021, 72(7): e169-e183. 10.1093/cid/ciaa1478 .
[46]MJ Satlin , CJ Kubin , JS Blumenthal , et al. Comparative effectiveness of aminoglycosides, polymyxin B, and tigecycline for clearance of carbapenem-resistant Klebsiella pneumoniae from urine[J]. Antimicrob Agents Chemother, 2011, 55(12):5893-5899. DOI: 10.1128/AAC.00387-11 .
[47]YX Liu , KJ Le , HY Shi , et al. Efficacy and safety of tigecycline for complicated urinary tract infection: a systematic review[J]. Transl Androl Urol, 2021, 10(1):292-299. DOI: 10.21037/tau-20-959 .
[48]JA Karlowsky , J Steenbergen , GG Zhanel . Microbiology and preclinical review of omadacycline[J]. Clin Infect Dis, 2019, 69(Suppl 1):S6-S15. DOI: 10.1093/cid/ciz395 .
[49]JS Overcash , P Bhiwandi , L Garrity-Ryan , et al. Pharmacokinetics, safety, and clinical outcomes of omadacycline in women with cystitis: results from a phase 1b study[J]. Antimicrob Agents Chemother, 2019, 63(5)DOI: 10.1128/AAC.02083-18 .
[50]Tetraphase. Tetraphase announces top-line results from IGNITE2 phase 3 clinical trial of eravacycline in cUTI [EB/OL]. [ 2023-02-01]. https://www.fiercebiotech.com/biotech/tetraphase-announces-top-line-results-from-ignite2-phase-3-clinical-trial-of-eravacycline.
[51]陈玥, 李佳安, 朱曼, 等. 替加环素鞘内/脑室内给药治疗多重耐药菌颅内感染的文献分析[J]. 中国临床药学杂志, 2021, 30(1):46-50. DOI: 10.19577/j.1007-4406.2021.01.012 .
[52]中国医师协会神经外科医师分会神经重症专家委员会, 北京医学会神经外科学分会神经外科危重症学组. 神经外科中枢神经系统感染诊治中国专家共识(2021版)[J]. 中华神经外科杂志, 2021, 37(1):2-15. DOI: 10.3760/cma.j.cn112050-20200831-00480 .
[53]OR Sipahi , S Mermer , T Demirdal , et al. Tigecycline in the treatment of multidrug-resistant Acinetobacter baumannii meningitis: Results of the Ege study[J]. Clin Neurol Neurosurg, 2018, 172:31-38. DOI: 10.1016/j.clineuro.2018.06.008 .
[54]邱炳辉, 漆松涛, 曾浩, 等. 神经外科ICU耐药鲍曼不动杆菌颅内感染的治疗[J]. 中华神经外科杂志, 2014, 30(6):586-588. DOI: 10.3760/cma.j.issn.1001-2346.2014.06.014 .
[55]CL Sy , PY Chen , CW Cheng , et al. Recommendations and guidelines for the treatment of infections due to multidrug resistant organisms[J]. J Microbiol Immunol Infect, 2022, 55(3):359-386. DOI: 10.1016/j.jmii.2022.02.001 .
[56]CA Liang , YC Lin , PL Lu , et al. Antibiotic strategies and clinical outcomes in critically ill patients with pneumonia caused by carbapenem-resistant Acinetobacter baumannii[J]. Clin Microbiol Infect, 2018, 24(8):908.e1-908.e7. DOI: 10.1016/j.cmi.2017.10.033 .
[57]YT Lee , YC Wang , SC Kuo , et al. Multicenter study of clinical features of breakthrough acinetobacter bacteremia during carbapenem therapy[J]. Antimicrob Agents Chemother, 2017, 61(9). DOI: 10.1128/AAC.00931-17 .
[58]A Cheng , YC Chuang , HY Sun , et al. Excess mortality associated with colistin-tigecycline compared with colistin-carbapenem combination therapy for extensively drug-resistant acinetobacter baumannii bacteremia: a multicenter prospective observational study[J]. Crit Care Med, 2015, 43(6):1194-1204. DOI: 10.1097/CCM.0000000000000933 .
[59]JN O′Donnell , V Putra , TP Lodise . Treatment of patients with serious infections due to carbapenem-resistant Acinetobacter baumannii: How viable are the current options?[J]. Pharmacotherapy, 2021, 41(9):762-780. DOI: 10.1002/phar.2607 .
[60]PD Tamma , SL Aitken , RA Bonomo , et al. Infectious diseases society of america guidance on the treatment of ampc β-lactamase-producing enterobacterales, carbapenem-resistant acinetobacter baumannii, and stenotrophomonas maltophilia infections[J]. Clin Infect Dis, 2022, 74(12):2089-2114. DOI: 10.1093/cid/ciab1013 .
[61]GA Denys , SM Callister , MJ Dowzicky . Antimicrobial susceptibility among gram-negative isolates collected in the USA between 2005 and 2011 as part of the Tigecycline Evaluation and Surveillance Trial (T.E.S.T.)[J]. Ann Clin Microbiol Antimicrob, 2013, 12:24. DOI: 10.1186/1476-0711-12-24 .
[62]H Wu , H Feng , L He , et al. In Vitro Activities of tigecycline in combination with amikacin or colistin against carbapenem-resistant acinetobacter baumannii[J]. Appl Biochem Biotechnol, 2021, 193(12):3867-3876. DOI: 10.1007/s12010-021-03664-z .
[63]A Sertcelik , I Baran , E Akinci , et al. Synergistic activities of colistin combinations with meropenem, sulbactam, minocycline, disodium fosfomycin, or vancomycin against different clones of carbapenem-resistant acinetobacter baumannii strains[J]. Microb Drug Resist, 2020, 26(5):429-433. DOI: 10.1089/mdr.2019.0088 .
[64]WH Sheng , JT Wang , SY Li , et al. Comparative in vitro antimicrobial susceptibilities and synergistic activities of antimicrobial combinations against carbapenem-resistant Acinetobacter species: Acinetobacter baumannii versus Acinetobacter genospecies 3 and 13TU[J]. Diagn Microbiol Infect Dis, 2011, 70(3):380-386. DOI: 10.1016/j.diagmicrobio.2011.03.003 .
[65]KR Peck , MJ Kim , JY Choi , et al. In vitro time-kill studies of antimicrobial agents against blood isolates of imipenem-resistant Acinetobacter baumannii, including colistin-or tigecycline-resistant isolates[J]. J Med Microbiol, 2012, 61(Pt 3):353-360. DOI: 10.1099/jmm.0.036939-0 .
[66]M Beganovic , KE Daffinee , MK Luther , et al. Minocycline alone and in combination with polymyxin b, meropenem, and sulbactam against carbapenem-susceptible and-resistant acinetobacter baumannii in an in vitro pharmacodynamic model[J]. Antimicrob Agents Chemother, 2021, 65(3)DOI: 10.1128/AAC.01680-20 .
[67]GG Rao , NS Ly , J Diep , et al. Combinatorial pharmacodynamics of polymyxin B and tigecycline against heteroresistant Acinetobacter baumannii[J]. Int J Antimicrob Agents, 2016, 48(3):331-336. DOI: 10.1016/j.ijantimicag.2016.06.006 .
[68]PC Fragkou , G Poulakou , A Blizou , et al. The role of minocycline in the treatment of nosocomial infections caused by multidrug, extensively drug and pandrug resistant acinetobacter baumannii: a systematic review of clinical evidence[J]. Microorganisms, 2019, 7(6)DOI: 10.3390/microorganisms7060159 .
[69]H Seok , WS Choi , S Lee , et al. What is the optimal antibiotic treatment strategy for carbapenem-resistant Acinetobacter baumannii (CRAB)? A multicentre study in Korea[J]. J Glob Antimicrob Resist, 2021, 24:429-439. DOI: 10.1016/j.jgar.2021.01.018 .
[70]AS Chapman , JS Bakken , SM Folk , et al. Diagnosis and management of tickborne rickettsial diseases: Rocky Mountain spotted fever, ehrlichioses, and anaplasmosis--United States: a practical guide for physicians and other health-care and public health professionals[J]. MMWR Recomm Rep, 2006, 55(RR-4):1-27.
[71]R Cross , C Ling , NP Day , et al. Revisiting doxycycline in pregnancy and early childhood--time to rebuild its reputation?[J]. Expert Opin Drug Saf, 2016, 15(3):367-382. DOI: 10.1517/14740338.2016.1133584 .
[72]HM Biggs , CB Behravesh , KK Bradley , et al. Diagnosis and management of tickborne rickettsial diseases: rocky mountain spotted fever and other spotted fever group rickettsioses, ehrlichioses, and anaplasmosis-United States[J]. MMWR Recomm Rep, 2016, 65(2):1-44. DOI: 10.15585/mmwr.rr6502a1 .
[73]GP Wormser , RJ Dattwyler , ED Shapiro , et al. The clinical assessment, treatment, and prevention of lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2006, 43(9):1089-1134. DOI: 10.1086/508667 .
[74]H Pöyhönen , M Nurmi , V Peltola , et al. Dental staining after doxycycline use in children[J]. J Antimicrob Chemother, 2017, 72(10):2887-2890. DOI: 10.1093/jac/dkx245 .
[75]SR Todd , FS Dahlgren , MS Traeger , et al. No visible dental staining in children treated with doxycycline for suspected Rocky Mountain Spotted Fever[J]. J Pediatr, 2015, 166(5):1246-1251. DOI: 10.1016/j.jpeds.2015.02.015 .
[76]WA Peters 3rd, PY Liu , RJ Barrett 2nd, et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix[J]. J Clin Oncol, 2000, 18(8):1606-1613. DOI: 10.1200/JCO.2000.18.8.1606 .
[77]JM Korth-Bradley , SJ Baird-Bellaire , AA Patat , et al. Pharmacokinetics and safety of a single intravenous dose of the antibiotic tigecycline in patients with cirrhosis[J]. J Clin Pharmacol, 2011, 51(1):93-101. DOI: 10.1177/0091270010363477 .
[78]SJ Kovacs , L Ting , J Praestgaard , et al. An open-label study of the impact of hepatic impairment on the pharmacokinetics and safety of single oral and intravenous doses of omadacycline[J]. Antimicrob Agents Chemother, 2020, 64(11). DOI: 10.1128/AAC.01650-20 .
[79]李俊. 临床药理学[M]. 4版. 北京:人民卫生出版社, 2008.
[80]贾蓓, 卓超, 黄文祥, 等. 注射用盐酸多西环素随机对照治疗细菌性感染多中心临床研究[J]. 重庆医科大学学报, 2007, 32(9):963-968, 973. DOI: 10.3969/j.issn.0253-3626.2007.09.018 .
[81]韩朝宏, 梁月冬. 米诺环素不良反应的国内文献综述[J]. 药物流行病学杂志, 2001, 10(3):143-144. DOI: 10.3969/j.issn.1005-0698.2001.03.012 .
[82]李春钰, 贾自力, 邢丽秋. 北京地区2013~2018年替加环素不良反应回顾性分析[J]. 药物流行病学杂志, 2019, 28(9):581-585.
[83]钟雪, 陈东科, 许宏涛, 等. 替加环素研究新进展[J]. 中国抗生素杂志, 2015, 40(11):870-875. DOI: 10.3969/j.issn.1001-8689.2015.11.015 .
[84]N Cui , H Cai , Z Li , et al. Tigecycline-induced coagulopathy: a literature review[J]. Int J Clin Pharm, 2019, 41(6):1408-1413. DOI: 10.1007/s11096-019-00912-5 .
[85]HA Hakeam , Z Al Duhailib . Tigecycline-induced coagulopathy: a literature review[J]. Int J Clin Pharm, 2020, 42(3):846-847. DOI: 10.1007/s11096-020-00974-w .
[86]A Markham , SJ Keam . Omadacycline: first global approval[j]. drugs, 2018, 78(18):1931-1937. DOI: 10.1007/s40265-018-1015-2 .
[87]SH Lan , SP Chang , CC Lai , et al. The efficacy and safety of omadacycline in treatment of acute bacterial infection: A systemic review and meta-analysis of randomized controlled trials[J]. Medicine (Baltimore), 2019, 98(51):e18426. DOI: 10.1097/MD.0000000000018426 .
[88]JS Solomkin , A Sway , K Lawrence , et al. Eravacycline: a new treatment option for complicated intra-abdominal infections in the age of multidrug resistance[J]. Future Microbiol, 2019, 14:1293-1308. DOI: 10.2217/fmb-2019-0135 .
[89]LA Hamilton , AJ Guarascio . Tetracycline allergy[J]. Pharmacy (Basel), 2019, 7(3). DOI: 10.3390/pharmacy7030104 .
[90]JW Jang , YJ Bae , YG Kim , et al. A case of anaphylaxis to oral minocycline[J]. J Korean Med Sci, 2010, 25(8):1231-1233. DOI: 10.3346/jkms.2010.25.8.1231 .
[91]B Lebrun-Vignes , C Kreft-Jais , A Castot , et al. Comparative analysis of adverse drug reactions to tetracyclines: results of a French national survey and review of the literature[J]. Br J Dermatol, 2012, 166(6):1333-1341. DOI: 10.1111/j.1365-2133.2012.10845.x .
[92]O Correia , L Delgado , J Polónia . Genital fixed drug eruption: cross-reactivity between doxycycline and minocycline[J]. Clin Exp Dermatol, 1999, 24(2):137. DOI: 10.1046/j.1365-2230.1999.00436.x .
[93]HL Chan , SN Wong , FL Lo . Tetracycline-induced fixed drug eruptions: influence of dose and structure of tetracyclines[J]. J Am Acad Dermatol, 1985, 13(2Pt 1):302-304. DOI: 10.1016/s0190-9622(85)80289-9 .
[94]G Fan , L Jin , H Bai , et al. Safety and efficacy of tigecycline in intensive care unit patients based on therapeutic drug monitoring[J]. Ther Drug Monit, 2020, 42(6):835-840. DOI: 10.1097/FTD.0000000000000784 .
[95]陈洁, 胡章勇. 替加环素治疗多重耐药菌感染的药物监测[J]. 生命的化学, 2019, 39(3):521-526. DOI: 10.13488/j.smhx.20190012 .
[96]CC Zhou , F Huang , JM Zhang , et al. Population pharmacokinetics of tigecycline: a systematic review[J]. Drug Des Devel Ther, 2022, 16:1885-1896. DOI: 10.2147/DDDT.S365512 .
[97]N Armstrong , M Richez , D Raoult , et al. Simultaneous UHPLC-UV analysis of hydroxychloroquine, minocycline and doxycycline from serum samples for the therapeutic drug monitoring of Q fever and Whipple′s disease[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2017, 1060:166-172. DOI: 10.1016/j.jchromb.2017.06.011 .
[98]AR Tunkel , R Hasbun , A Bhimraj , et al. 2017infectious diseases society of america′s clinical practice guidelines for healthcare-associated ventriculitis and meningitis[J]. Clin Infect Dis, 2017, 64(6):e34-e65. DOI: 10.1093/cid/ciw861 .
[99]夏利新, 毛知兰, 苏秋平, 等. 颅内鲍曼不动杆菌感染患者脑脊液中替加环素的药物浓度监测[J]. 中国处方药, 2021, 19(11):46-48. DOI: 10.3969/j.issn.1671-945X.2021.11.020 .
[100]梅升辉, 罗旭颖, 李倩, 等. HPLC-MS/MS测定替加环素脑脊液浓度及临床应用[J]. 中国药师, 2016, 19(1):21-25. DOI: 10.3969/j.issn.1008-049X.2016.01.006 .
[101]D Gardiner , G Dukart , A Cooper , et al. Safety and efficacy of intravenous tigecycline in subjects with secondary bacteremia: pooled results from 8 phase III clinical trials[J]. Clin Infect Dis, 2010, 50(2):229-238. DOI: 10.1086/648720 .
[102]国卫办医函. 关于印发碳青霉烯类抗菌药物临床应用专家共识等3个技术文件的通知[EB/OL]. [ 2023-02-01]. http://www.nhc.gov.cn/yzygj/s7659/201809/95f65ca473b44746b24590e94468b8ff.shtml.
[103]AC Kalil , ML Metersky , M Klompas , et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the infectious diseases society of america and the american thoracic society[J]. Clin Infect Dis, 2016, 63(5): e61-e111. DOI: 10.1093/cid/ciw353 .
[104]中国碳青霉烯耐药肠杆菌科细菌感染诊治与防控专家共识编写组, 中国医药教育协会感染疾病专业委员会, 中华医学会细菌感染与耐药防控专业委员会. 中国碳青霉烯耐药肠杆菌科细菌感染诊治与防控专家共识[J]. 中华医学杂志, 2021, 101(36):2850-2860. DOI: 10.3760/cma.j.cn112137-20210219-00438 .
[105]周华, 周建英, 俞云松. 中国鲍曼不动杆菌感染诊治与防控专家共识解读[J]. 中国循证医学杂志, 2016, 16(1):26-29. DOI: 10.7507/1672-2531.20160006 .
通信作者:刘韶,中南大学湘雅医院药学部,长沙 410008,Email:nc.ude.usc999oahsuil;黄勋,中南大学湘雅医院医院感染控制中心,长沙 410008,Email:nc.ude.uscnuxgnauh.
引用本文:临床常用四环素类药物合理应用多学科专家共识编写组, 中华预防医学会医院感染控制分会, 中国药理学会临床药理分会. 临床常用四环素类药物合理应用多学科专家共识[J]. 中华医学杂志, 2023, 103(30): 2281-2296. DOI: 10.3760/cma.j.cn112137-20230313-00389.
本文转载自订阅号「中华医学杂志」(ID:nmjc1915)
原链接戳:标准与规范 | 临床常用四环素类药物合理应用多学科专家共识
本文完
责编:Jerry