中国医师协会呼吸医师分会 中华医学会呼吸病学分会 中国康复医学会呼吸康复专业委员会 《中华健康管理学杂志》编辑委员会
中华健康管理学杂志, 2021,15:网络预发表. DOI: 10.3760/cma.j.cn115624-20211011-00595
摘要
我国慢性呼吸道疾病(chronic respiratory diseases,CRD)患病率、致残率、致死率高,疾病负担重。呼吸康复是CRD长期管理的核心组成部分,是基于全面患者评估、为患者量身定制的综合干预措施,是最具成本效益的非药物治疗手段之一。该指南适用于常见的CRD和其他的一些呼吸相关疾病导致的慢性呼吸道症状或者类似综合征,需排除严重的认知功能障碍,不稳定心绞痛等。采用量表分析、影像学检查、肺功能检查等方式进行呼吸康复评定是呼吸康复的重要环节。呼吸康复技术包括不依赖设备的运动训练、手法排痰和体位引流、主动循环呼吸技术、自主引流,依赖设备的呼气正压/振荡呼气正压治疗、高频胸壁振荡。同时,可通过应用呼吸支持技术如氧疗、高流量氧疗、无创通气,以及辅助使用支气管扩张剂等措施,保证上述康复技术的安全性和有效性。营养作为呼吸康复重要组成部分推荐采用营养风险筛查2002或主观整体评价量表进行CRD患者的营养筛查与评估,推荐以增强骨骼肌力量,从而改善呼吸肌力为目标。此外,通过对CRD患者进行心理干预、自我管理教育和日常生活指导,可提高患者的依从性,改善合并症,消除不良情绪与行为。目前,远程医疗和移动医疗技术的普及为呼吸康复的施展提供了可行性保障。
引用本文: 中国医师协会呼吸医师分会, 中华医学会呼吸病学分会, 中国康复医学会呼吸康复专业委员会, 等. 中国慢性呼吸道疾病呼吸康复管理指南(2021年) [J] . 中华健康管理学杂志, 2021, 15(6) : 521-538. DOI: 10.3760/cma.j.cn115624-20211011-00595.
2017年全球慢性呼吸道疾病(chronic respiratory diseases,CRD)的患病率约为7.1%,总患病人数达5.449亿[1],我国慢性阻塞性肺疾病(简称慢阻肺)患病人数约1亿[2],CRD成为致残、致死的主要疾病负担[1]。呼吸康复对CRD患者是一种非常有效的治疗方法,是CRD长期管理的核心组成部分,它是基于全面患者评估的为患者量身定制的综合干预措施,包括但不局限于运动训练、患者教育和行为改变,旨在改善CRD患者的身心状况,促进其对增进健康行为的长期依从性。呼吸康复能够提高运动能力、减轻呼吸困难症状、提高与健康相关的生活质量和减少住院率。
近年来,呼吸康复越来越受到国内外同行的重视,但是其可及性、接受度和完成程度均很差,无论是在发达国家还是中低收入国家,呼吸康复远未得到充分的利用。基于此,由中国医师协会呼吸医师分会、中华医学会呼吸病学分会、中国康复医学会呼吸康复专业委员会、《中华健康管理学杂志》编辑委员会组织相关专家,基于当前的循证医学证据,制定了《慢性呼吸道疾病呼吸康复与管理指南》,旨在规范CRD管理,更好地发挥呼吸康复在CRD管理中的作用。
第一部分 指南编写方法
指南的设计和制订步骤遵循世界卫生组织2014年发布的《世界卫生组织指南制订手册》[3]及2016年中华医学会发布的《制订/修订<临床诊疗指南>的基本方法及程序》[4]。
本指南的报告和撰写参考卫生保健实践指南的报告条目(Reporting Items for Practice Guidelines in Healthcare,RIGHT)[5]。证据和推荐意见的评价方法采用推荐分级的评估、制定与评价(Grading of Recommendations Assessment,Development and Evaluation,GRADE)分级系统(表1、2)[6]。

表1:GRADE推荐强度分级与定义[6]

表2:GRADE证据质量分级与定义[6]
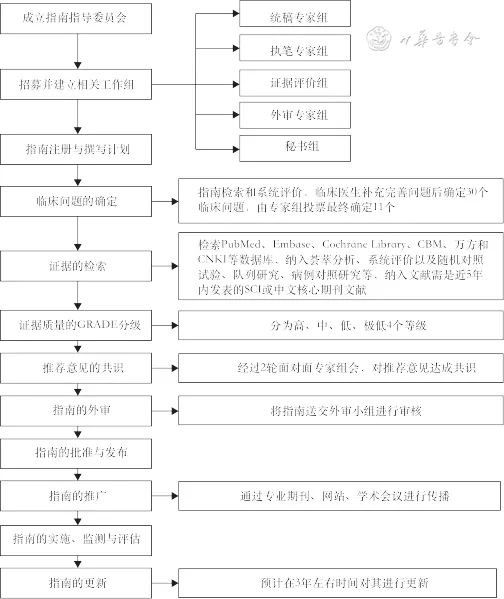
图1:本指南整体技术路线图
1.指南注册:本指南已在国际实践指南注册平台(www.guidelines-registry.cn)上注册(注册号IPGRP-2020CN128)。
2.指南使用者与目标人群:本指南供中国呼吸与危重症医学科医生、全科医生,以及康复治疗师、护士等与呼吸康复相关的专业人员使用。指南推荐意见的应用目标人群为中国需要进行呼吸康复的CRD患者。
3.指南工作组:本指南委员会成立了多学科专家工作组,包括呼吸与危重症医学科、康复科、营养科等。工作组具体分为5个:统稿专家组、执笔专家组、证据评价组、外审专家组、秘书组。
4.利益冲突声明:本指南工作组成员均填写了利益冲突声明表,不存在与本指南撰写内容直接相关的利益冲突。
5.临床问题遴选和确定:通过系统检索呼吸康复领域已经发表的指南和系统评价,收集了30个临床问题,由包括呼吸与危重症医学科,康复医学科,营养科,健康管理学科和全科医学科专家50人共同组成的专家团队对30个问题进行讨论,并对其重要性按1~7分进行评分,最后确定本指南需要解决的11个临床问题(分别对应本指南第二至十二部分)。
6.证据检索:针对最终纳入的临床问题,按照“人群、干预、对照和结局”对其进行解构,并根据解构的问题:(1)检索PubMed、Embase、Cochrane Library、中国生物医学文献数据库、万方和中国知网等数据库,纳入荟萃分析、系统评价以及随机对照试验、队列研究、病例对照研究等,检索时间为建库至2020年10月25日;(2)检索策略:根据前期筛选的临床问题确定相应的检索策略。
7.证据评价:使用GRADE方法对证据体进行评价和推荐意见进行分级。
8.推荐意见形成:专家组基于国内外循证医学证据与证据评价,经过2轮面对面专家组会,对推荐意见达成共识,最终形成32条推荐意见。
本指南推荐内容的主要特点:(1)将欧美指南的格式和表述方法与中国临床实际情况结合起来。(2)提出符合中国临床实践的针对CRD患者呼吸康复的推荐意见。(3)纳入了一些最新技术在CRD患者呼吸康复中的应用指导,例如,经鼻高流量氧疗(high-flow nasal cannula oxygen therapy,HFNC)、物联网技术的应用等。
本指南表述方式的特点:(1)指南中将每条推荐意见单独列出,以便读者迅速发现与阅读;(2)推荐意见后清楚标记GRADE分级符号,明确区分推荐意见的方向与强度,并应用“建议”或“推荐”字样,以便读者进一步明确推荐级别;(3)清晰显示主题、标题、推荐意见、推荐意见说明、推荐依据,备注相应的说明文字,以解释该条推荐意见的理由;推荐依据是为了清楚呈现支持该条推荐意见的主要证据与来源。
9.指南更新:指南工作组计划在3年左右时间对本指南进行更新。更新方法按照国际指南更新流程进行[7, 8]。
10.传播与实施:指南发布后,指南工作组将主要通过以下方式对指南进行传播与推广:(1)在相关学术期刊发表;(2)在国内不同区域、不同学科组织指南推广专场,确保临床专业人员充分了解并正确应用本指南;(3)通过微信、网络和其他媒体进行推广。
第二部分 呼吸康复的适应证和禁忌证
【推荐意见1】推荐的呼吸康复适应证和禁忌证见表3【2B】。

表3:呼吸康复的适应证
【推荐意见说明】(1)呼吸康复可缓解呼吸困难和疲劳,改善情绪,并增强患者的控制感。获得中等度改善,具有重要的临床意义;(2)呼吸康复的主要目标是减少患者呼吸困难症状,增加肌力和耐力(包括周围肌和呼吸肌),增加运动能力,改善日常功能,确保锻炼长期进行,缓解恐惧和焦虑,提高生活质量,并增长肺部疾病知识,加强自我管理;(3)中度至重度慢阻肺稳定期或慢阻肺急性加重出院后的患者接受呼吸康复,可减少加重住院治疗。轻度慢阻肺患者应根据症状推荐呼吸康复。向慢阻肺患者提供居家呼吸康复,以代替常规护理;(4)哮喘患者可接受呼吸康复;(5)支气管扩张症患者可接受呼吸康复;(6)其他任何因呼吸道症状而残疾、患有慢性肺疾病的稳定期患者,均适用呼吸康复[9];(7)呼吸康复的禁忌证较少,但包括任何使患者在呼吸康复期间风险显著增加的病症,或严重干扰呼吸康复过程的任何病症。健康教育可让大多数患者获益。对于运动方案,某些患者或可遇到难以克服的困难(例如,严重的关节炎、神经系统疾病),甚至可能给患者带来危险(例如,无法控制的心脏病)。实际上,许多看似禁忌的问题确实可被解决,或者通过调整呼吸康复过程而让患者参与。
第三部分 康复评估
【推荐意见2】推荐对所有参与呼吸康复的患者进行呼吸康复评估【1A】。常用呼吸康复评估内容见表4。

表4:常用呼吸康复评估
【推荐意见说明】(1)影像学检查:在进入康复流程前应通过影像学检查等方法了解呼吸系统结构损害及损害程度;根据条件及患者病情等可选择胸部X线、胸部CT及肺血管影像学检查等方法;(2)共患病信息采集:在进入到呼吸康复流程前需要了解患者的共患病信息;进入到呼吸康复后要关注患者共患病情况的稳定性,是否会影响呼吸康复的进行;(3)肺功能[10, 11, 12]:CRD患者定期进行肺功能检查是必要的。肺功能检查可用于评估患者是否存在通气功能障碍、障碍类型及严重程度;肺功能还可用于呼吸系统弥散功能评估,对于间质性肺疾病十分重要;如条件有限也可采用简易肺功能仪进行评估;应熟练掌握肺功能检查的相对和绝对禁忌证;(4)其他呼吸功能评估[10, 11, 12]:如有条件可通过测量咳嗽时的呼气峰流速评估CRD患者的气道廓清能力;可使用视觉模拟评分法评估患者的排痰容易程度;可使用圣乔治呼吸问卷(St.George′s respiratory questionnaire,SGRQ)评估患者的咳嗽症状及痰液;(5)呼吸功能相关感觉[10, 11, 12]:可以在静态、运动前、运动后几种状态下进行评估;在康复治疗中,呼吸困难是以患者回忆活动中呼吸困难程度来评估。在采集呼吸困难病史时,应包括呼吸困难相关持续时间、症状的变化、感受、部位、加重和缓解因素;(6)总呼吸肌功能[10, 11, 12]:最大吸气压(maximal inspiratory pressure,MIP)和最大呼气压(maximum expiratory pressure,MEP)测定是临床最常用的、可信的、非创伤性的评价呼吸肌功能的指标。MIP反映的是全部吸气肌的综合吸气力量;MEP反映的是呼气肌的综合呼气力量;MIP可用于指导吸气肌训练(inspiratory muscle training,IMT);测量时患者不能很好的配合和呼吸肌疲劳可能会导致测定值比实际值低;(7)膈肌功能[10, 11, 12]:有经验的医疗机构可通过膈肌超声检查评估CRD患者的膈肌功能;膈肌超声检查可通过测量膈肌厚度、膈肌增厚比率、膈肌活动度评估膈肌功能;膈肌的活动度受很多外在因素影响,单纯依靠膈肌运动诊断膈肌麻痹存在一定的假阳性和假阴性的情况,结合膈肌厚度的检查可以提高阳性率。跨膈压指的是腹内压与胸内压的差值,可间接反映膈肌功能,可作为呼吸肌功能训练前后的客观评估指标;(8)运动耐力[13]:运动能力评估可以采用6 min步行试验(6-minute walking test,6MWT)、递增穿梭步行试验等现场步行测试方法,也可以采取需要仪器设备的运动心肺功能测试;(9)肌力[13]:肌力包含评估肌力的最大值和肌肉的耐力;力量评估结果的对比需要采取相同的设备和评估方法,如果提供口头指令,需要保持一致;对于手持等长测力计,推荐最好进行三次测试,中间休息1 min,每次收缩持续4~5 s,要求在第一秒内完全发力;等张测试的方法可以应用于量化运动负荷;(10)焦虑抑郁程度[10, 11, 12]:医院焦虑抑郁量表是常用的焦虑抑郁评估方法,可用于CRD患者自评,应在康复治疗开始前,对患者进行评估;(11)睡眠情况[10, 11, 12]:匹兹堡睡眠质量指数量表(Pittsburgh sleep quality index,PSQI)可用于评估CRD患者最近1个月的睡眠质量,由19个自评条目和5个他评条目,PSQI得分越高,表明睡眠质量越差;CRD患者PSQI得分可能与其疲劳情况及生活质量密切相关,较差的睡眠质量还可能引起CRD急性发作;(12)日常生活能力:可使用改良巴氏指数评估CRD患者的基本日常生活活动能力;使用工具性日常生活活动能力量表评估工具性日常生活活动能力;可重点评估患者的步行及完成家务的能力;(13)健康相关生活质量:对于CRD患者,SGRQ、慢性呼吸疾病问卷(chronic respiratory disease questionnaire,CRQ)及慢阻肺评估测试(COPD assessment test,CAT)是常用的健康相关生活质量评估方法,根据临床实践情况,可单一使用或组合使用;SGRQ可用于慢阻肺、哮喘及支扩症患者,CRQ及CAT可用于慢阻肺患者,是否适用于其他CRD,目前尚不清楚;SGRQ可用于电话及计算机随访。
第四部分 呼吸康复技术
【推荐意见3】推荐对CRD患者进行有氧运动训练【1A】。
【推荐意见说明】(1)有氧运动训练适用于各种CRD人群;(2)对于CRD患者,推荐的运动频率为每周最少3~5次;(3)对于CRD患者,训练强度与疾病严重程度高度相关,对于不同患者应基于评估进行个性化的强度,参见表5[14];(4)对于CRD患者,推荐的运动时间为每天20~60 min的持续运动或间歇运动,持续4~12周;(5)对于CRD患者,推荐的运动方式主要为步行,因为步行是日常生活中最高频率的体力活动。恒定功率自行车训练可作为一种替代选择;(6)有氧运动训练中指脉血氧饱和度(SpO2)应始终≥88%,如果患者运动中SpO2<88%或下降超过4%,应停止训练,并补充氧疗。

表5:慢性呼吸道疾病患者有氧和抗阻运动训练的运动处方建议[13]
【推荐依据】有氧训练是呼吸康复治疗的基础,其主要目的是提高有氧运动能力、增强参与步行肌肉的力量以及改善日常活动能力[15]。这些功能的改善通常是由于通过提高心肺和外周肌肉细胞功能的适应性,从而在给定的运动水平上使呼吸困难程度和外周肌肉不适感有所缓解。有证据表明,持续8~10周的有氧训练可有效降低由运动引起的动态过度通气程度和呼吸困难程度[16];同时,改善了摄氧量和心率对有氧耐力运动的动力学反应,使得心血管和肌肉细胞功能得以改善[17]。此外,已证明有氧运动可以逆转慢阻肺患者运动肌肉形态和生化异常,并增加肌肉生物能量[18]。
【推荐意见4】推荐对CRD患者进行抗阻力量训练【1A】。
【推荐意见说明】(1)抗阻运动训练适用于各种CRD人群。(2)对于CRD患者,推荐的运动频率为至少2~3次/周或隔天1次;(3)对于CRD患者,训练强度与疾病严重程度高度相关,对于不同患者应基于评估进行个性化的强度,参见表4;(4)对于CRD患者,推荐的运动频次为1~3组/d,8~10次/组;(5)对于CRD患者,推荐的运动方式主要为哑铃或者弹力带;(6)抗阻运动训练应避免患者屏气。
【推荐依据】抗阻训练是有氧训练的有益补充,其主要目的是改善肌肉质量和力量。由于老年人群中常伴随骨折风险,在呼吸康复治疗中优化患者的肌肉力量十分重要[19]。此外,据报道,抗阻训练可改善或至少保持骨密度水平,约50%的慢阻肺患者骨密度水平较低[20]。同时,抗阻训练对通气需求依赖较低,因此非常适合严重气流阻塞和重度呼吸困难患者。与进行有氧训练相比,抗阻训练能缓解患者的呼吸困难[20]。应鼓励合并高血压和肺动脉高压(pulmonary arterial hypertension,PAH)等CRD患者进行抗阻训练,它提供的有益刺激足以改善日常生活活动能力和生活质量,且不会对心血管系统产生明显的压力[21]。
【推荐意见5】推荐对CRD患者进行体位引流【1C】。
【推荐意见说明】(1)体位引流有增加食管反流的风险,建议在进食2 h后进行。(2)体位引流会对颅内压、心输出量和活动性出血产生影响,建议采取头低位时,应对体位引流的治疗性体位进行改良。
【推荐依据】体位引流可以通过使患者处于特定的体位,利用重力来帮助支气管分泌物从气道内排出。同时,改善分泌物所在的特定区域的通气,利用该区域通气量的增加来帮助分泌物的清除[22]。体位引流在支气管扩张和其他肺部疾病患者中已被证明是清除分泌物的有效方法[23, 24]。
【推荐意见6】推荐对CRD患者进行手法治疗,但不建议作为CRD的基础治疗【2A】。
【推荐意见说明】(1)手法治疗有使血氧饱和度(oxygen saturation,SaO2)下降的风险,对气道高反应性或氧饱和度下降的患者应进行严密的监测;(2)手法治疗会对疼痛、骨质疏松和凝血功能障碍产生影响,在治疗强度上应进行改良。
【推荐依据】手法治疗的可能机制是通过手法在胸壁产生一定的振动波,并通过胸壁向肺部传送。振动波可以帮助气道分泌物从支气管壁松动、促进纤毛运动和引起刺激咳嗽。徒手手法治疗结合体位引流可能会更有效[22]。徒手手法治疗的疗效更依赖于其治疗过程中所产生的治疗频率而不是强度[22]。徒手手法治疗,需要由治疗人员提供,不利于CRD患者进行长期的自我管理,现在已经被更多的气道廓清技术所替代,不作为常规治疗[25]。
【推荐意见7】推荐CRD患者进行主动循环呼吸治疗【1B】。
【推荐意见说明】主动循环呼吸技术(active cycle of breathing technique,ACBT)依赖于呼气流速和患者的注意力,可能很难在加重期间进行。
【推荐依据】ACBT利用胸廓扩张运动期间,塌陷区域的肺泡重新通气,并通过肺泡旁路通气增加了肺泡间气体的流动,降低了通气的不均匀性;同时在呼气相,通过高肺容量位的压力提高了呼气流速来帮助气道分泌物的清除[26]。ACBT已经被证明在肺囊性纤维化和其他肺部疾病患者中能有效帮助气道分泌物清除[27, 28]。
【推荐意见8】推荐对CRD患者进行自主引流治疗【2A】。
【推荐意见说明】自主引流依赖于呼气流速和患者的注意力,可能很难在加重期间进行。
【推荐依据】自主引流利用不断叠加的潮气量,改善肺泡旁路通气,使肺泡内的气体重新通向被阻塞的区域,调节呼气气流,并在不引起气道动态塌陷的情况下最大化呼气气流速度[29]。
【推荐意见9】推荐对CRD患者进行呼气正压(positive expiratory pressure,PEP)/振荡呼气正压(oscillation positive expiratory pressure,OPEP)治疗【1B】。
【推荐意见说明】(1)在治疗期间应监测压力,以确保应用于气道的PEP的有效性和安全性;(2)PEP/OPEP有增加气胸的风险,对严重肺大泡的患者治疗前需要经过准确的评估;(3)面罩PEP可能会诱发幽闭恐惧症,治疗前应询问患者的病史。
【推荐依据】PEP通过呼气时产生10~20 cmH2O(1 cmH2O=0.098 kPa)的压力维持气道稳定性,从而改善通气、气体交换,并帮助气道内分泌物的清除[30]。OPEP还能在此基础上额外产生6~26 Hz的气道内振动,促进气道内壁上的分泌物松动[31]。PEP治疗已在气道廓清中获得了广泛的实践,特别是对慢阻肺和囊性纤维化的患者[2,32]。
【推荐意见10】推荐对CRD患者进行高频胸壁振荡(high-frequency chest wall oscillatory,HFCWO)治疗【1B】。
【推荐意见说明】HFCWO可能会引起胸部留置导管患者的不适,治疗前应进行充分的评估和镇痛。
【推荐依据】HFCWO能在胸壁上产生5~25 Hz频率的振动[33]。目前主要有两种机制来解释HFCWO对气道廓清的作用,一种机制指出振荡气流改变黏液黏稠度从而促进了分泌物的松动;另一种机制是呼气和吸气之间的速度差异产生的强大的剪切力足以松动和移动气道内痰液[34]。HFCWO治疗已在气道廓清中获得了广泛的实践,特别是对囊性纤维化的患者[35]。CRD常用气道廓清技术见表6[36, 37]。
表6 常用的气道廓清技术[36, 37]
【推荐意见11】推荐对存在吸气肌力减弱的CRD患者进行IMT【2A】。
【推荐意见说明】(1)IMT适用于各种吸气肌力量减弱(MIP<70%预计值)的CRD人群;(2)CRD患者的推荐运动频率为每周至少4~5次,训练起始强度为30%,每周递增5%,推荐的运动时间为每天30 min的间歇训练,可辅助使用阈值型呼吸训练器或者抗阻型呼吸训练器;(3)IMT应避免患者出现呼吸肌疲劳,应控制在症状限制Borg评分的4~6分。
【推荐依据】吸气肌的训练是适用于多数CRD患者的一种有效的独立干预手段,其主要目的是提高吸气肌的收缩力、耐力和速度。IMT已被证明,可以作为多维呼吸康复训练计划的一个环节,为呼吸困难和运动不耐受患者以及因害怕运动性呼吸困难而避免活动的患者提供一种过渡到有氧和抗阻训练的替代性治疗[38]。有报道在经过IMT后慢阻肺患者肋间外肌Ⅰ型纤维所占比例和Ⅱ型纤维的大小增加,呼吸困难症状、夜间缺氧时间减少,同时运动能力也有所改善[39]。除了运动训练之外,介入IMT比单独的运动训练更能改善运动的能力[40]。根据系统回顾与荟萃分析,IMT可以提高吸气肌力量和耐力,功能性运动能力和生活质量,同时也降低了呼吸困难程度[41]。
第五部分 呼吸康复中的呼吸支持技术
【推荐意见12】(1)呼吸康复患者使用实时SaO2检测仪或者可穿戴设备,监测SaO2和心率,以确保呼吸康复过程的安全性【2B】;(2)推荐存在严重低氧血症慢阻肺患者使用长期家庭氧疗【1B】;(3)对存在运动中低氧血症的CRD患者,在运动过程中补充氧气,但不应对所有呼吸康复患者常规补充氧气【2C】。
【推荐意见说明】静息状态下低氧血症的严重患者,长期氧疗(>15 h/d)对其血流动力学、呼吸生理、运动耐力和精神状态会产生有益影响,可改善患者生活质量,提高生存率。(1)氧疗指征,具备以下任一项即可:(1)静息时,动脉血氧分压(arterial partial pressure of oxygen,PaO2)≤55 mmHg或SaO2<88%,有或无高碳酸血症。(2)56 mmHg≤PaO2<60 mmHg(1 mmHg=0.133 kPa),SaO2<89%伴下述之一:继发红细胞增多(红细胞压积>55%);PAH(平均肺动脉压≥25 mmHg);右心功能不全导致水肿;(2)氧疗目标:对于大多数患者,SpO2目标为90%~94%;对于存在Ⅱ型呼吸衰竭风险的患者,推荐目标为88%~92%;(3)氧疗方法:长期氧疗,针对需进行长期氧疗的患者,每天低流量氧疗1~2 L/min吸氧;间歇性氧疗,针对活动时出现喘息和低氧情况的CRD[42]。静息状态未出现低氧血症的患者,不推荐使用长期氧疗[43]。慢阻肺等CRD患者,运动康复过程中氧饱和度低于90%,推荐在运动康复中使用氧气,可以提高氧饱和度、运动能力,减少呼吸困难等不适。尚无明显的证据表明运动中补充氧气能改善死亡率和对疾病转归方面的临床实用性和有效性[42]。
【推荐意见13】(1)建议伴有严重低氧血症的慢性呼吸衰竭(chronic respiratory failure,CRF)患者在稳定期使用HFNC,降低动脉血二氧化碳分压(artery partial pressure of carbon dioxide,PaCO2)水平,改善生活质量和减少再住院次数【2B】;(2)建议CRF患者运动锻炼期间使用HFNC,以改善呼吸康复锻炼效果,提高患者运动能力【2B】。
【推荐意见说明】(1)CRF患者满足以下长期氧疗指征即可考虑HFNC治疗:即PaO2≤55 mmHg或SaO2<88%,伴或不伴有高碳酸血症或55 mmHg<pao2≤60 mmHg,但合并有PAH、肺心病或红细胞压积>0.55;(2)运动锻炼期间应用HFNC,可增加患者呼吸康复运动强度的同时减少并发症的发生,改善高强度运动期间的临床结局;(3)CRF的患者使用HFNC联合无创正压通气(non-invasive positive pressure ventilation,NIPPV)序贯治疗能改善患者膈肌疲劳,促进呼吸肌力恢复,疗效优于单独使用NIPPV。
【推荐依据】HFNC作为一种新的呼吸支持技术近年来得到临床广泛应用,具有以下显著的生理学优势[3]:(1)提供良好温湿化气体;(2)维持正常黏液纤毛转运系统功能,促进气道分泌物的排出;(3)提供相对恒定的吸入气氧浓度(21%~100%);(4)低水平呼气末正压效应;(5)减少气道解剖死腔;(6)降低上气道阻力和呼吸功,改善患者呼吸形式。
目前临床证据主要支持HFNC在急性低氧性呼吸衰竭中的应用,但其在慢性高碳酸血症患者的应用亦逐渐增多。对于需要呼吸康复的CRF稳定期患者,长期应用HFNC可以改善低氧血症与CO2潴留的情况,显著减少患者急性加重与住院次数,缩短住院时间,以及有效提高患者生活质量;对于CRF患者(例如慢阻肺稳定期患者)进行运动训练时,HFNC可提高其运动耐力和氧合功能,可改善患者高强度运动期间的临床结局[4]。
在CRF患者家庭应用HFNC时,建议初始气体流量可设置20~30 L/min,根据患者耐受性和依从性逐渐增加。如果患者CO2潴留明显,流量可设置在45~55 L/min甚至更高,达到患者能耐受的最大流量。动态调整吸氧浓度或氧气流量维持SpO2在88%~92%;温度初始设置于31 ℃,结合患者舒适性、耐受性、痰液量与性状进行适当调节。
【推荐意见14】以降低PaCO2为目标导向的长期家庭NIPPV,建议用于持续伴有高碳酸血症型呼吸衰竭的慢阻肺患者【2C】。
【推荐意见说明】(1)长期家庭NIPPV建议用于持续伴有高碳酸血症(PaCO2>50 mmHg)的稳定期慢阻肺患者,特别是合并有阻塞性睡眠呼吸暂停低通气患者。(2)对伴有急性Ⅱ型呼吸衰竭的重度慢阻肺急性加重患者,在其恢复期建议序贯应用长期家庭NIPPV。(3)对慢性Ⅱ型呼吸衰竭患者的长期家庭NIPPV应以降低PaCO2为目标导向(维持PaCO2在48.1 mmHg以下或至少降低20%)进行滴定式调节。(4)长期家庭NIV时建议首选固定压力支持的通气模式。
【推荐依据】长期家庭NIPPV可以缓解呼吸肌疲劳、降低肺动态过度充气和减少吸气负荷。对于稳定期慢阻肺患者,长期家庭NIPPV能改善患者呼吸困难症状,提高运动耐力和改善生活质量,并且能够降低医疗费用,没有严重的不良反应。
家庭NIPPV在合并有阻塞性睡眠呼吸暂停低通气的稳定期慢阻肺患者中应用的研究证据较充分,建议首选持续气道正压通气。建议在重度慢阻肺急性加重后恢复期患者中序贯使用,应考虑到这部分患者肺功能的可复性,应在2~4周后重新评估以决定患者是否继续使用。以PaCO2降低为目标导向(PaCO2至少降低20%以上或48.1 mmHg以下)进行滴定式调节,吸气压力最大至30 cmH2O,高后备通气频率为特点的高强度NIPPV可以提高第一秒用力呼气容积(forced expiratory volume in the first second,FEV1)、6MWT和生活质量。短期观察性研究发现适应性自动压力调节通气模式能够降低PaCO2,提供耐受性和生活质量,但缺乏长期的RCT研究证实其优势,考虑到这些新模式疗效的不确定性和潜在的风险,长期家庭NIV时建议首选固定压力支持的通气模式[5]。
【推荐意见15】对无法耐受呼吸康复训练的慢阻肺患者,建议NIPPV辅助治疗缓解呼吸困难症状、改善运动耐力、提高生活质量【2C】。
【推荐意见说明】(1)慢阻肺患者呼吸康复过程中,不建议常规使用NIPPV;(2)对于已接受长期家庭NIPPV治疗或因呼吸困难无法耐受呼吸康复的慢阻肺患者,应尝试NIPPV辅助治疗;(3)慢阻肺呼吸康复治疗过程中、治疗后恢复期及夜间睡眠时辅助NIPPV治疗可改善呼吸困难症状和改善运动耐力。
【推荐依据】呼吸康复可以改善慢阻肺患者的生活质量和运动耐量,而运动强度是影响呼吸康复疗效的关键因素。慢阻肺患者由于肺功能严重受损,可能无法耐受适当强度的运动训练。运动过程中给予NIPPV治疗可以改善患者运动耐受能力和缓解呼吸困难症状,但NIPPV对6MWT的影响存在争议[44]。在重度慢阻肺患者的睡眠时加入NIPPV并结合呼吸康复治疗,可以改善运动耐力和生活质量,可能机制是NIPPV改善气体交换及夜间呼吸肌肉得到更好休息[45]。
第六部分 营养管理
【推荐意见16】推荐使用营养风险筛查2002(nutrition risk screening,NRS 2002)[46]或主观整体评价(subjective global assessment,SGA)量表[47],对CRD患者进行营养筛查及评估【1A】。
【推荐意见说明】(1)对于CRD患者,NRS 2002及SGA是常用的营养筛查及评估方法,根据临床实践情况,可单一使用或组合使用;(2)患者在接受康复治疗之前,必须进行营养筛查,符合营养支持适应证的患者给予营养支持,提高康复效果。
【推荐依据】与正常体重的CRD患者相比,低体质指数(body mass index,BMI)与运动能力降低和死亡风险增加有关[48, 49]。
由欧洲临床营养和代谢学会(European Society for Clinical Nutrition and Metabolism,ESPEN)开发的NRS 2002是迄今为止唯一一种基于证据的工具,具有良好的信度和效度[50]。在计划CRD患者的治疗时,可通过NRS 2002评估他们的营养状况以采取相应的措施预防呼吸困难的发生[51]。SGA是一种基于与临床病史和体检相关的特征的多维营养评估工具[52],不仅纳入了对CRD患者常见饮食问题(恶心、呕吐和厌食等)的评估,还涉及了对11个身体部位的肌肉质量、皮下脂肪下降和液体超载的测量,提高了营养不良评估的准确性[53]。
【推荐意见17】推荐营养不良的CRD患者达到每天30 kcal/kg能量和1.2 g/kg蛋白质的营养干预目标【2B】。
【推荐意见说明】(1)CRD患者营养干预目标是增加体重和去脂体重,以获得肺功能改善;(2)在CRD恶化期间可能需要额外的个体化建议,营养需求可能会相应增加;(3)建议营养不良的CRD患者达到每天至少1.2 g/kg的蛋白质摄入,高于中国居民膳食指南给普通人的推荐摄入量。
【推荐依据】CRD患者维持体重所需的能量约为30 kcal·kg―1·d―1[54],但如果要达到每天增加体重所需的能量可能要需要达到45 kcal·kg―1·d―1[55]。呼吸肌(吸气和呼气肌肉力量)力量的改善与体重增加超过2 kg(2.1~3.1 kg)有关[56]。而慢阻肺患者在8周内>2 kg的体重增加幅度,已被发现与4年后生存率的提高独立相关[57]。
冰岛对于住院患者的临床指南中推荐的蛋白质需要量下限为1.2 g·kg―1·d―1[58];而ESPEN对于营养不良或患有慢性病的老年人的蛋白质建议摄入量为1.2~1.5 g·kg―1·d―1[59]。Ingadottir等[60]的研究中发现蛋白质摄入量每增加20g,去脂体重指数增加1.2 kg/m2,而更高的去脂体重指数与慢阻肺患者更好的生存和更有利的健康结果相关[61]。而蛋白质摄入量与某些肺功能相关的指标[用力肺活量(forced vital capacity,FVC)和肺活量]的改善间也有一定相关性[62]。
【推荐意见18】推荐使用含有必需氨基酸或构建机体蛋白质所必需的支链氨基酸及其代谢物的补充剂【2B】。
【推荐意见说明】推荐口服亮氨酸或活性亮氨酸代谢物β-羟基-β-甲基丁酸酯(β-Hydroxy-β-methylbutyric acid,HMB),剂量为1~3 g/d。
【推荐依据】亮氨酸可以有效刺激骨骼肌的合成代谢[63]。富含维生素D和亮氨酸的乳清蛋白营养补充剂与改善功能能力(坐-站试验)和四肢肌肉质量有关[64]。活性亮氨酸代谢物HMB可以防止卧床期间去脂体重丢失[65]。除了锻炼外,口服HMB或必需氨基酸制剂,可能改善CRD患者身体成分、骨密度、肌肉力量、日常生活能力和生活质量[66]。
【推荐意见19】在饮食中添加n-3多不饱和脂肪酸【2C】。
【推荐意见说明】n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acids,N-3 PUFA)主要包括二十二碳六酸(docosahexaenoicacid,DHA)、二十二碳五烯酸(docosapentaenoic acid,DPA)、二十碳五酸(eicosapentaenoic acid,EPA)、α-亚麻酸、γ-亚麻酸等;可通过增加鱼肉的摄入补充n-3多不饱和脂肪酸。
【推荐依据】N-3 PUFA可促进CRD患者的抗炎,还可增强呼吸肌的功能[67, 68]。住院呼吸康复患者补充N-3 PUFA能够增加呼吸效率及呼吸交换率[68]。EPA、DHA和DPA摄入量与较好的FEV1容量呈正相关,而DPA与年龄相关的FEV1下降减少有关[69]。
【推荐意见20】推荐饮食中添加抗氧化剂【2C】。
【推荐意见说明】(1)动植物体内都有复杂的抗氧化剂系统,如谷胱甘肽、维生素C、维生素A、维生素E和各种抗氧化酶系等;(2)推荐患者每天至少摄入1 500 g水果和蔬菜,为他们提供必要的维生素和矿物质、纤维和植物营养素的良好来源。
【推荐依据】越来越多的证据表明,氧化应激在慢阻肺、支气管哮喘等CRD的病理过程中起着重要作用;有几种维生素能够发挥抗炎和抗氧化作用,如维生素A、C和E,它们可能在这些疾病的发展过程中起到保护作用。慢阻肺恶化期间氧化应激增加与血清维生素A和E浓度降低有关[70]。补充维生素E(400 U/d,持续12周)可降低慢阻肺患者的脂质过氧化反应[71],而补充维生素A可改善FEV1(+23%)和FVC(+25%)[72]。在患有轻中度哮喘的成年人中补充镁(340 mg/d柠檬酸镁)可以改善支气管高反应性、高峰流量和生活质量[73]。其他抗氧化剂(维生素C和E、锌和硒等)也被证明可以改善抗氧化缺陷和血清总蛋白,增加患者呼吸康复训练后的肌力、肌肉耐力,并使患者6MWT结果及健康状况显著改善[74]。
【推荐意见21】推荐补充含有维生素D的营养补充剂【2B】。
【推荐意见说明】(1)若患者在慢阻肺急性加重期存在维生素D缺乏(<25 nmol/L),可通过口服维生素D 800~1 000 mg/d,或增加阳光暴露补充维生素D;(2)PAH伴维生素D缺乏症患者应酌情补充胆钙醇(维生素D3)或维生素D。
【推荐依据】在呼吸康复期间,大剂量补充维生素D可增加呼吸肌力和最大运动耐力[75]。结合维生素D和呼吸康复的干预措施可有效改善股四头肌力量和6 min步行距离[76],降低慢阻肺及严重哮喘恶化的风险和医疗负担[77, 78]。给慢阻肺患者服用N-3PUFA,亮氨酸和维生素D复合营养补充剂后,体重和去脂体重显著高于未服用组,接受治疗的患者在营养状况、吸气肌力和体力活动方面都有改善[79]。PAH伴维生素D缺乏症患者每周补充50 U胆钙醇(维生素D3),每日补充镁200 mg、锌8 mg、维生素D 400 U,可显著提高血清维生素D水平和6MWT,改善右心室大小和右心功能[80]。
【推荐意见22】推荐进行营养支持与雄激素合成代谢类固醇(androgenic-anabolic steroids,AASs)治疗联合应用的多模式综合营养干预【2B】。
【推荐意见说明】(1)推荐将包含有营养支持与AASs治疗联合应用的多模式综合干预应用于晚期慢阻肺或CRF患者的肺部康复治疗中;(2)当考虑使用AASs治疗时,肌肉内注射葵酸诺龙是首选,剂量为每周50~200 mg,疗程12周。
【推荐依据】睾酮是AASs中较有代表性的一类补充剂,可以有效增加肌肉的大小和力量[81]。睾酮替代疗法目前已经被证明可减缓慢阻肺患者的疾病进展[82]。雄激素补充与呼吸康复计划的研究中证实了睾酮和运动训练联合对慢阻肺患者瘦体重、肌肉功能和运动耐量改善的有益作用,睾酮还可逆转皮质类固醇引起的呼吸肌无力[83]。在肌肉萎缩和长期接受皮质类固醇治疗的晚期慢阻肺患者中,AASs治疗常与康复计划和营养支持相结合。营养补充剂、合成类固醇和呼吸康复的多模式营养干预已经在改善去脂体重,运动耐量甚至依从性患者的存活率方面取得了成功[84];并被证明能有效提高患者的运动能力(如6MWT)和健康相关生活质量(health-related quality of life,HRQoL)评分[85]。
第七部分 心理干预
【推荐意见23】对所有CRD患者尤其是计划进行呼吸康复患者进行心理状态的评估和干预,推荐常规进行患者教育、设计个性化的自我管理计划和动机性访谈;对合并心理疾病的患者,推荐专科医(护)师进行心理干预及药物干预,心理干预包括认知行为治疗(cognitive behavioural therapy,CBT)、正念减压法、放松疗法、催眠疗法、积极身心运动疗法等【1A】。
【推荐意见说明】(1)对于CRD患者,需考虑的主要心理因素包括:缺乏对患者的指导;治疗动机下降;社会角色边缘化;不适应的认知方式;合并精神心理疾病(尤其是焦虑症和抑郁症)。CRD患者焦虑、抑郁的发生率为36%、40%,急性加重期为53%、43%,焦虑、抑郁降低患者治疗的依从性,增加患者的负性生活体验。因此,应对这一类患者尤其是计划进行呼吸康复的患者进行心理状态的评估和干预。(2)若患者在治疗或康复过程中反复出现依从性不佳,出现明显的焦虑、抑郁症状或行为异常如自伤行为,应推荐至精神科或临床心理科就诊。(3)有效的干预措施包括CBT、正念减压法、放松疗法、催眠疗法及积极身心运动疗法等,其中CBT在CRD中研究较多。针对患者不同心理变化的阶段,以上方法可单独或者联合使用。
【推荐依据】对计划进行呼吸康复的患者进行患者教育及设计个性化的自我管理计划[86]。治疗依从性不高是慢阻肺患者再次住院的主要原因之一,与单纯接受生活方式相关教育的患者相比,接受动机性访谈干预的患者1个月和2个月后治疗依从性更高[87],同时动机性访谈可改善中重度慢阻肺患者呼吸困难等症状和提高生活质量[88]。接受CBT治疗3个月以上可以显著降低慢阻肺患者的焦虑症状,改善患者的生活质量,坚持1年可以减少慢阻肺急性加重住院和看急诊率[89]。针对年龄≥60岁,患有持续性、未控制的成年哮喘患者,CBT可以改善哮喘的结局和自我管理行为,目前尚无证据表明CBT适用于青少年哮喘患者[90]。最优的CBT实施方法、形式和目标人群需要更多的循证医学证据。尽管上述方法在特定的案例中具有不可否认的效果,但因为研究设计的高度异质性等原因,其有效性及其在呼吸康复中的应用尚需要进一步验证和总结,以便建立统一的国际国内标准,并由多个研究领域的专家进行评估,这将有助于更好地理解心理干预在CRD中的作用。
第八部分 药物治疗
【推荐意见24】推荐慢阻肺患者呼吸康复训练前使用支气管扩张剂【1A】。
【推荐意见说明】(1)推荐慢阻肺患者呼吸康复训练前联合使用支气管扩张剂,可根据患者情况选择短效或长效药物;(2)支气管扩张剂是否适用于其他CRD患者的呼吸康复治疗尚待研究。
【推荐依据】吸入支气管扩张剂(简称“支扩剂”)可以缓解气流受限、减轻症状,是慢阻肺患者的主要治疗方法之一。在呼吸康复运动训练前使用短效和长效支气剂均有助于提高运动能力[9,91]。研究提示在中重度慢阻肺患者的呼吸康复计划中,长效抗胆碱能药物和长效β2受体激动剂的单独[92]或联合使用[93, 94, 95, 96]相较于安慰剂均可改善肺功能(FEV1、FVC以及深吸气量)、减轻呼吸困难、延长耐力运动时间,而双支扩剂的疗效优于单支扩剂[97]。目前尚缺乏临床证据支持训练前使用支扩剂可提高其他CRD患者呼吸康复的效果。
【推荐意见25】弱推荐阿片类药物改善慢阻肺急性加重患者劳力性呼吸困难症状,但对运动能力的影响缺乏证据[1A]。
【推荐意见说明】阿片类药物减少了慢阻肺急性加重患者的呼吸困难,对运动能力没有影响;全身性阿片类药物的证据质量中等,雾化类阿片类药物在呼吸困难方面的证据质量较低[98]。单剂口服速释吗啡可改善慢阻肺急性加重和慢性呼吸困难综合征患者的劳力性呼吸困难和运动耐力,但研究样本量较少[99]。
第九部分 辅助器械的使用
【推荐意见26】推荐日常使用助行辅助器械,提高慢阻肺患者的功能性运动能力【1A】。
【推荐意见说明】(1)使用步行自行车,可改善慢阻肺患者运动能力;(2)使用轮式行走器,对中、晚期慢阻肺以及功能性运动能力较差的患者可提高功能性运动能力;(3)使用支持性助行器,如前臂支撑助行器,在慢阻肺急性加重期间可改善其日常生活能力。
【推荐依据】对于中、晚期慢阻肺以及功能性运动能力较差的患者,轮式助行器可以提高他们的户外步行距离和时间[100]。选定的慢阻肺患者使用轮式助行器可增加其每日步数[101]。部分间质性肺疾病患者可能受益于步行自行车的使用,并显示出改善生活质量的趋势;但是对运动能力无影响[102]。目前尚不清楚轮式助行器等工具能否增强患者体力或提高其运动能力[9]。
第十部分 患者自我管理
【推荐意见27】推荐针对CRD患者进行健康教育【2B】。
【推荐意见说明】(1)健康教育应由卫生保健专业人员进行,通常是一个多学科团队;模式可采用以患者为主导的一对一等模式;(2)健康教育方式需因人而异且不断改进,常用的工具为印刷资料、多媒体、互联网等。(3)健康教育的主要内容应包括正常的肺部解剖结构,疾病的病理生理,医学检查结果判断,戒烟指导,常规的治疗方法,情绪管理,营养指导,运动锻炼的益处,疾病急性加重的识别及处理等;(4)推荐健康教育的时长为60 min/课时,共6个课时为宜。
【推荐依据】对CRD患者进行健康教育可降低就诊次数,提高患者的生活质量[103]。目前,健康教育的内容存在异质性和广泛的差异,强调健康教育内容与全球倡议指南中保持一致[104]。在不同研究中,时长范围为10~180 min/课时,平均为60 min/课时。总课时也不一致,大多集中在1~60个课时,平均6个课时[104]。
【推荐意见28】推荐向CRD患者提供正确的药物指导,尤其是吸入装置的使用【1A】。
【推荐意见说明】(1)规律使用药物治疗,掌握吸入装置的正确使用;(2)个体化的用药指导包括日常处方药的适应证、禁忌证、剂量、频次、副作用和潜在的药物间相互作用;(3)推荐在呼吸科门诊开展简单有效的健康教育。
【推荐依据】不正确使用吸入装置可加重CRD患者的症状,从而降低生活质量[105]。由医护人员指导CRD患者正确使用吸入装置是可行的,有助于改善吸入技术、疾病的控制与药物依从性[106]。在呼吸科门诊增加一名专业护士进行药物指导及健康教育,有助于疾病的控制[107]。
【推荐意见29】推荐常见CRD患者掌握相应的自我管理知识与技能【1A】。
【推荐意见说明】(1)应根据CRD患者自身情况,采用个体化的持续监测与评估方法;(2)CRD患者应建立健康档案,定期随访。
【推荐依据】哮喘患者可使用峰流速仪(PEF)作为疾病病情变化的监测手段,获取最佳值并记录[108]。此外,哮喘控制测试量表的得分与专家评估的患者哮喘控制水平具有较好的相关性,且简单易行,广泛用于临床[109]。对于慢阻肺患者来说,CAT及CCQ评分与SGRQ的相关性较好,且问卷更加简便易行[110]。
第十一部分 日常生活指导
【推荐意见30】推荐慢阻肺患者日常活动中可使用节能技术(energy conservation techniques,ECTs)【1B】。
【推荐意见说明】(1)ECTs以日常生活模拟为重点,在患者执行模拟日常生活任务的过程中给予动作姿势和呼吸模式调整、使用辅助器具、环境适宜改造、计划及优化任务等节能策略指导[111]。(2)对于慢阻肺患者,推荐在日常活动中使用ECTs。但是否适应于其他慢性气道疾病患者,目前尚不清楚。(3)目前ECTs训练时间推荐2周,但不同人群训练时间尚有待进一步研究。
【推荐依据】在中重度慢阻肺患者中,与未进行ECTs干预的患者相比,为期2周的ECTs训练可减少能量消耗的同时不会显著增加进行日常活动的时间[112]。在一项纳入16例中重度慢阻肺男性患者的小样本队列研究中,对比在四项日常生活活动中使用与不使用ECTs的能量消耗,结果显示通过运用姿势调整的ECTs后患者耗氧量减少,Borg评分较使用前显著下降[113]。使用ECTs可提高HRQoL并改善呼吸困难、腿部不适[114]。目前研究集中于ECTs在慢阻肺患者日常中的短期影响,ECTs长期影响尚有待进一步确认;此外ECTs除慢阻肺之外的在其他慢性呼吸系统疾病患者中的作用缺乏直接临床证据。
【推荐意见31】推荐使用辅具或调整环境来完成ECTs【4C】。
【推荐意见说明】(1)使用辅具以减少不必要的能量消耗。(2)简化工作流程以消除不必要的活动。(3)基于环境评估后的物理性环境适宜改造。
【推荐依据】对于中重度慢阻肺患者使用简化工作流程并进行相应的物理性环境改造,如合理调整并安排工作顺序、调整常用物品位置于触手可及处等可降低能量消耗和缓解呼吸困难症状[113];同时合理使用辅具如长柄鞋把子、长柄梳子、电动轮椅、带座椅和袋子的助行器等可减少不必要的能量消耗[112]。为期2周的ECTs教育计划如调整工作计划、适时使用辅具等能减少患者执行ADL所需能量,而活动消耗时间没有增加,同时改善健康相关生命质量[111]。对于老年家庭环境的评估后进行生活空间和设施的适宜改造如提升马桶座位高度、改造无障碍浴室等有助于患者生活质量的提升[115]。
第十二部分 物联网医疗在呼吸慢性疾病呼吸康复管理中的作用
【推荐意见32】推荐将远程医疗/移动医疗技术有条件/补充用于慢阻肺、哮喘、肺癌等CRD患者呼吸康复的自我管理中【1B】。
【推荐意见说明】(1)基于网络的交互式远程呼吸康复治疗在慢阻呼吸康复管理上是可行的;对于不能参加传统呼吸康复计划的患者可以作为呼吸康复计划的二线方案;对于慢阻肺急性加重住院患者可在出院后2周进行视频远程呼吸康复干预;(2)对于伴有情绪障碍的慢阻肺患者,远程电话提供的CBT可以减少慢阻肺患者的抑郁症状和焦虑症状。CBT包括行为策略(如行为激活、活动安排、放松训练、等级暴露和社交技能培训)和认知策略(如认知重组、结构化问题解决和行为实验)等,1次/周,每次持续约30 min;(3)对于肺癌患者,移动医疗管理可以补充基于传统医疗中心的康复计划,改善患者体育活动、呼吸困难和生活质量;对于进展期的实体肿瘤基于智能手机应用程序的康复管理也是有效和可行的。
【推荐依据】远程呼吸康复与传统呼吸康复相比,对GOLD分级中度的慢阻肺患者,短期监督下的6MWT没有差别,但是较传统组有更高的完成度。对于不能参加传统的呼吸康复计划的重度慢阻肺患者可以作为二线呼吸康复计划[116]。对于慢阻肺急性加重住院患者在出院后约2周进行视频远程呼吸康复干预可以减少30 d内患者全因再住院率[117]。
非交互式智能技术如可穿戴计步器、智能手机等提供的干预措施与面对面/数字化/书面的自我管理支持比较,可显著改善慢阻肺患者6个月的HRQoL评分和活动水平,但尚不足以得出确切结论[118]。
基于远程电话提供干预措施使慢阻肺患者可以在家中接受治疗,从而缓解抑郁和焦虑症状,是一种可行的替代方案[119]。
基于移动医疗的个体化呼吸康复程序可以改善非小细胞肺癌患者运动能力、呼吸困难评分及生活质量,可用于补充基于传统医疗中心为基础的呼吸康复计划[120]。
目前物联网医疗需要完善相应的法律和医疗保险政策,我国作为一个社会老龄化不断加深的国家,如何通过技术提高人群的应用率是物联网医疗未来亟需解决的问题。
专家委员会(按单位名称汉语拼音排序)
主席:国家呼吸医学中心,中国医学科学院 北京协和医学院(王辰)
副主席:国家呼吸医学中心,中国医学科学院呼吸疾病研究院,国家呼吸疾病临床研究中心,中日友好医院呼吸与危重症医学科(赵红梅);解放军总医院第二医学中心健康管理研究院(曾强);上海交通大学医学院附属瑞金医院呼吸与危重症医学科(瞿介明);深圳市呼吸疾病研究所(陈荣昌)
统稿专家组
组长:国家呼吸医学中心,中国医学科学院呼吸疾病研究院,国家呼吸疾病临床研究中心,中日友好医院呼吸与危重症医学科(赵红梅)
成员:复旦大学附属中山医院呼吸与危重症医学科(张静);内蒙古自治区人民医院呼吸与危重症医学科(孙德俊);浙江大学医学院附属邵逸夫医院呼吸与危重症医学科(应可净)
执笔专家组
组长:国家呼吸医学中心,中国医学科学院呼吸疾病研究院,国家呼吸疾病临床研究中心,中日友好医院呼吸与危重症医学科(赵红梅)
成员:北京医院呼吸与危重症医学科(李燕明);重庆医科大学附属第二医院呼吸与危重症医学科(王导新);复旦大学附属中山医院呼吸与危重症医学科(张静);南方医科大学南方医院呼吸与危重症医学科(蔡绍曦);南京医科大学第一附属医院呼吸与危重症医学科(周林福);上海交通大学医学院附属瑞金医院呼吸与危重症医学科(周敏);四川大学华西医院康复医学中心(喻鹏铭);苏州市立医院呼吸与危重症医学科(曾刚);浙江大学医学院附属邵逸夫医院呼吸与危重症医学科(应可净);浙江大学医学院附属邵逸夫医院呼吸治疗科(葛慧青);中国科学院大学重庆医院呼吸与危重症医学科(黄勇);中国医学科学院北京协和医院呼吸与危重症医学科(徐凯峰);中国医学科学院北京协和医院营养科(陈伟);中南大学湘雅二医院呼吸与危重症医学科(陈平);中日友好医院呼吸与危重症医学科(冯鹏、夏金根);中日友好医院康复医学科(谢欲晓)
外审专家组
组长:北京大学第一医院全科医学科(迟春花)
成员:安徽医科大学第一附属医院老年呼吸与危重症医学科(范晓云);成都市第一人民医院呼吸与危重症医学科(王永生);复旦大学附属中山医院呼吸与危重症医学科(宋元林);福建医科大学附属第一医院呼吸与危重症医学科(林其昌);福建中医药大学附属康复医院老年康复医学科(张荣照);复旦大学附属华山医院康复医学科(朱玉连)广州医科大学附属第一医院,广州呼吸健康研究院呼吸疾病国家重点实验室呼吸与危重症医学科(郑则广、宫玉翠);哈尔滨医科大学附属二院呼吸与危重症医学科(陈宏);河北医科大学第二医院呼吸与危重症医学科(袁雅冬);河南省人民医院呼吸与危重症医学科(张晓菊);华中科技大学同济医学院附属同济医院呼吸与危重症医学科(赵建平);吉林大学第二医院呼吸与危重症医学科(张捷);解放军总医院第三医学中心健康医学科(邓笑伟);南京医科大学第一附属医院健康管理中心(张群);南京医科大学第一附属医院康复医学中心(励建安);南京医科大学附属江宁医院康复医学科(潘化平);青岛市市立医院呼吸与危重症医学科(唐华平);山东省立医院呼吸与危重症医学科(姜淑娟);山东省潍坊市第二人民医院呼吸与危重症医学科(杨国儒);四川大学华西医院呼吸与危重症医学科(倪忠);四川大学华西医院健康管理中心(黄燕);同济大学附属东方医院呼吸与危重症医学科(李强);武汉市第一医院呼吸与危重症医学科(罗光伟);西安交通大学第一附属医院呼吸与危重症医学科(石志红);新疆维吾尔自治区人民医院呼吸与危重症医学中心(杨晓红);云南省第一人民医院呼吸与危重症医学科(张云辉);中国医科大学附属第一医院呼吸与危重症医学科(代冰);中南大学湘雅三医院呼吸与危重症医学科(孟婕);中南大学湘雅医院呼吸与危重症医学科(胡成平);中日友好医院呼吸与危重症医学科(杨汀);中山大学附属第三医院康复医学科(窦祖林)
证据评价组
组长:兰州大学健康数据科学研究院循证医学中心(陈耀龙)
成员:北京大学第三医院康复医学科(刘小燮);北京医院呼吸与危重症医学科(王和);中日友好医院康复医学科(段亚景)
秘书组
组长:中日友好医院健康体检中心(马骁)
成员:苏州市立医院呼吸与危重症医学科(杜强);中日友好医院呼吸与危重症医学科(张思雨);中日友好医院健康体检中心(金琦);中日友好医院康复医学科(王思远、崔婷捷)
利益冲突:专家委员会所有成员均声明不存在利益冲突
参考文献
[1]GBD Chronic Respiratory Disease Collaborators. Prevalence and attributable health burden of chronic respiratory diseases,1990—2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet Respir Med,2020,8(6):585-596. DOI:10.1016/S2213-2600(20)30105-3.
[2]WangC,XuJ,YangL,et al. Prevalence and risk factors of chronic obstructive pulmonary disease in China(the China Pulmonary Health[CPH]study):a national cross-sectional study[J]. Lancet,2018,391(10131):1706-1717. DOI:10.1016/S0140-6736(18)30841-9.
[3]World Health Organization. WHO handbook for guideline development,2nd ed[M]. Geneva:World Health Organization,2014.
[4]蒋朱明,詹思延,贾晓巍,等. 制订/修订《临床诊疗指南》的基本方法及程序[J]. 中华医学杂志,2016,96(4):250‐253. DOI:10.3760/cma.j.issn.0376‐2491.2016.04.004.
[5]ChenY,YangK,MarušicA,et al. A Reporting Tool for Practice Guidelines in Health Care:The RIGHT Statement[J]. Ann Intern Med,2017,166(2):128-132. DOI:10.7326/M16-1565.
[6]GuyattG,OxmanAD,AklEA,et al. GRADE guidelines:1. Introduction-GRADE evidence profiles and summary of findings tables[J]. J Clin Epidemiol,2011,64(4):383-394. DOI:10.1016/j.jclinepi.2010.04.026.
[7]VernooijRW,SanabriaAJ,SolàI,et al. Guidance for updating clinical practice guidelines:a systematic review of methodological handbooks[J]. Implement Sci,2014,9:3. DOI:10.1186/1748-5908-9-3.
[8]VernooijRW,Alonso-CoelloP,BrouwersM,et al. Reporting Items for Updated Clinical Guidelines:Checklist for the Reporting of Updated Guidelines(CheckUp)[J]. PLoS Med,2017,14(1):e1002207. DOI:10.1371/journal.pmed.1002207.
[9]SpruitMA,SinghSJ,GarveyC,et al. An official American Thoracic Society/European Respiratory Society statement:key concepts and advances in pulmonary rehabilitation[J]. Am J Respir Crit Care Med,2013,188(8):e13-64. DOI:10.1164/rccm.201309-1634ST.
[10]RochesterCL. Patient assessment and selection for pulmonary rehabilitation[J]. Respirology,2019,24(9):844-853. DOI:10.1111/resp.13616.
[11]SinghS. Approaches to outcome assessment in pulmonary rehabilitation[J]. Clin Chest Med,2014,35(2):353-361. DOI:10.1016/j.ccm.2014.02.010.
[12]NiciL,DonnerC,WoutersE,et al. American Thoracic Society/European Respiratory Society statement on pulmonary rehabilitation[J]. Am J Respir Crit Care Med,2006,173(12):1390-1413. DOI:10.1164/rccm.200508-1211ST.
[13]GailD,PaulH,PatGC. Exercise prescription practices in pulmonary rehabilitation programs[J]. Canadian Journal of Respiratory,Critical Care,and Sleep Medicine,2017,1(2):77-83. DOI:10.1080/24745332.2017.1328935.
[14]ZengY,JiangF,ChenY,et al. Exercise assessments and trainings of pulmonary rehabilitation in COPD:a literature review[J]. Int J Chron Obstruct Pulmon Dis,2018,13:2013-2023. DOI:10.2147/COPD.S167098.
[15]World Health Organization. The top 10 causes of death[R/OL].(2020-12-09)[2021-09-01]. https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death.
[16]SpruitMA,VercoulenJH,SprangersM,et al. Fatigue in COPD:an important yet ignored symptom[J]. Lancet Respir Med,2017,5(7):542-544. DOI:10.1016/S2213-2600(17)30158-3.
[17]TroostersT,LangerD,VrijsenB,et al. Skeletal muscle weakness,exercise tolerance and physical activity in adults with cystic fibrosis[J]. Eur Respir J,2009,33(1):99-106. DOI:10.1183/09031936.00091607.
[18]VogiatzisI,ZakynthinosS. Factors limiting exercise tolerance in chronic lung diseases[J]. Compr Physiol,2012,2(3):1779-1817. DOI:10.1002/cphy.c110015.
[19]HsiehLY,ChouFJ,GuoSE. Information needs of patients with lung cancer from diagnosis until first treatment follow-up[J]. PLoS One,2018,13(6):e0199515. DOI:10.1371/journal.pone.0199515.
[20]AgustiA,BelE,ThomasM,et al. Treatable traits:toward precision medicine of chronic airway diseases[J]. Eur Respir J,2016,47(2):410-419. DOI:10.1183/13993003.01359-2015.
[21]OliverSM. Living with failing lungs:the doctor-patient relationship[J]. Fam Pract,2001,18(4):430-439. DOI:10.1093/fampra/18.4.430.
[22]McIlwaineM,BradleyJ,ElbornJS,et al. Personalising airway clearance in chronic lung disease[J]. Eur Respir Rev,2017,26(143):160086. DOI:10.1183/16000617.0086-2016.
[23]LeeAL,BurgeAT,HollandAE. Airway clearance techniques for bronchiectasis[J]. Cochrane Database Syst Rev,2015,2015(11):CD008351. DOI:10.1002/14651858.CD008351.pub3.
[24]OsadnikCR,McDonaldCF,JonesAP,et al. Airway clearance techniques for chronic obstructive pulmonary disease[J]. Cochrane Database Syst Rev,2012,(3):CD008328. DOI:10.1002/14651858.CD008328.pub2.
[25]CabillicM,GouillyP,ReychlerG. Manual airway clearance techniques in adults and adolescents:What level of evidence?[J]. Rev Mal Respir,2018,35(5):495-520. DOI:10.1016/j.rmr.2015.12.004.
[26]LewisLK,WilliamsMT,OldsTS. The active cycle of breathing technique:a systematic review and meta-analysis[J]. Respir Med,2012,106(2):155-172. DOI:10.1016/j.rmed.2011.10.014.
[27]WilsonLM,MorrisonL,RobinsonKA. Airway clearance techniques for cystic fibrosis:an overview of Cochrane systematic reviews[J]. Cochrane Database Syst Rev,2019,1(1):CD011231. DOI:10.1002/14651858.CD011231.pub2.
[28]EatonT,YoungP,ZengI,et al. A randomized evaluation of the acute efficacy,acceptability and tolerability of flutter and active cycle of breathing with and without postural drainage in non-cystic fibrosis bronchiectasis[J]. Chron Respir Dis,2007,4(1):23-30. DOI:10.1177/1479972306074481.
[29]McCormackP,BurnhamP,SouthernKW. Autogenic drainage for airway clearance in cystic fibrosis[J]. Cochrane Database Syst Rev,2017,10(10):CD009595. DOI:10.1002/14651858.CD009595.pub2.
[30]CardosoDM,GassR,SbruzziG,et al. Effect of the expiratory positive airway pressure on dynamic hyperinflation and exercise capacity in patients with COPD:a meta-analysis[J]. Sci Rep,2020,10(1):13292. DOI:10.1038/s41598-020-70250-4.
[31]AlghamdiSM,BarkerRE,AlsulayyimA,et al. Use of oscillatory positive expiratory pressure(OPEP)devices to augment sputum clearance in COPD:a systematic review and meta-analysis[J]. Thorax,2020,75(10):855-863. DOI:10.1136/thoraxjnl-2019-214360.
[32]McIlwaineM,ButtonB,DwanK. Positive expiratory pressure physiotherapy for airway clearance in people with cystic fibrosis[J]. Cochrane Database Syst Rev,2015(6):CD003147. DOI:10.1002/14651858.CD003147.pub4.
[33]LeemansG,BelmansD,Van HolsbekeC,et al. The effectiveness of a mobile high-frequency chest wall oscillation(HFCWO)device for airway clearance[J]. Pediatr Pulmonol,2020,55(8):1984-1992. DOI:10.1002/ppul.24784.
[34]NicoliniA,GrecchiB,Ferrari-BravoM,et al. Safety and effectiveness of the high-frequency chest wall oscillation vs intrapulmonary percussive ventilation in patients with severe COPD[J]. Int J Chron Obstruct Pulmon Dis,2018,13:617-625. DOI:10.2147/COPD.S145440.
[35]MorrisonL,InnesS. Oscillating devices for airway clearance in people with cystic fibrosis[J]. Cochrane Database Syst Rev,2017,5(5):CD006842. DOI:10.1002/14651858.CD006842.pub4.
[36]VolskoTA. Airway clearance therapy:finding the evidence[J]. Respir Care,2013;58(10):1669-1678. DOI:10.4187/respcare.02590.
[37]BelliS,PrinceI,SavioG,et al. Airway Clearance Techniques:The Right Choice for the Right Patient[J]. Front Med(Lausanne),2021;8∶544826. DOI:10.3389/fmed.2021.544826.
[38]BeaumontM,Le TallecF,Villiot-DangerE. Inspiratory muscle training during pulmonary rehabilitation[J]. Rev Mal Respir,2021,38(7):754-767. DOI:10.1016/j.rmr.2021.04.003.
[39]Ramirez-SarmientoA,Orozco-LeviM,GuellR,et al. Inspiratory muscle training in patients with chronic obstructive pulmonary disease:structural adaptation and physiologic outcomes[J]. Am J Respir Crit Care Med,2002,166(11):1491-1497. DOI:10.1164/rccm.200202-075OC.
[40]SchultzK,JelusicD,WittmannM,et al. Inspiratory muscle training does not improve clinical outcomes in 3-week COPD rehabilitation:results from a randomised controlled trial[J]. Eur Respir J,2018,51(1):1702000. DOI:10.1183/13993003.02000-2017.
[41]BeaumontM,ForgetP,CouturaudF,et al. Effects of inspiratory muscle training in COPD patients:A systematic review and meta-analysis[J]. Clin Respir J,2018,12(7):2178-2188. DOI:10.1111/crj.12905.
[42]Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis,Management and Prevention of Chronic Obstructive Pulmonary Disease(2021 Report)[S/OL].(2020-11-17)[2021-09-01]. https://goldcopd.org.
[43]AlisonJA,McKeoughZJ,LeungRWM,et al. Oxygen compared to air during exercise training in COPD with exercise-induced desaturation[J]. Eur Respir J2019,53(5):1802429. DOI:10.1183/13993003.02429-2018.
[44]LabeixP,BergerM,Court FortuneI,et al. Quadriceps Endurance Increases Following Cycling Exercise With Non-Invasive Ventilation In Moderate-To-Severe COPD Patients. A Non-Randomized Controlled Study[J]. Int J Chron Obstruct Pulmon Dis,2019,14:2461-2468. DOI:10.2147/COPD.S216347.
[45]KneidingerN,GloecklR,Schönheit-KennU,et al. Impact of Nocturnal Noninvasive Ventilation on Pulmonary Rehabilitation in Patients with End-Stage Lung Disease Awaiting Lung Transplantation[J]. Respiration,2018,95(3):161-168. DOI:10.1159/000484056.
[46]ArslanM,SoyluM,KanerG,et al. Evaluation of malnutrition detected with the Nutritional Risk Screening 2002(NRS-2002)and the quality of life in hospitalized patients with chronic obstructive pulmonary disease[J]. Hippokratia,2016,20(2):147-152.
[47]DetskyAS,McLaughlinJR,BakerJP,et al. What is subjective global assessment of nutritional status?[J]. JPEN J Parenter Enteral Nutr,1987,11(1):8-13. DOI:10.1177/014860718701100108.
[48]Garcia-AymerichJ,GómezFP,BenetM,et al. Identification and prospective validation of clinically relevant chronic obstructive pulmonary disease(COPD)subtypes[J]. Thorax,2011,66(5):430-437. DOI:10.1136/thx.2010.154484.
[49]MarcoE,Sánchez-RodríguezD,Dávalos-YeroviVN,et al. Malnutrition according to ESPEN consensus predicts hospitalizations and long-term mortality in rehabilitation patients with stable chronic obstructive pulmonary disease[J]. Clin Nutr,2019,38(5):2180-2186. DOI:10.1016/j.clnu.2018.09.014.
[50]VelascoC,GarcíaE,RodríguezV,et al. Comparison of four nutritional screening tools to detect nutritional risk in hospitalized patients:a multicentre study[J]. Eur J Clin Nutr,2011,65(2):269-274. DOI:10.1038/ejcn.2010.243.
[51]OganN,YıldırımF,SüzenB,et al. Does Nutritional Risk Screening 2002 Correlate with the Dyspnea Status of Patients with GOLD Stage C-D Chronic Obstructive Pulmonary Disease?[J]. Turk Thorac J,2020,21(1):49-53. DOI:10.5152/TurkThoracJ.2019.180194.
[52]KeithJN. Bedside nutrition assessment past,present,and future:a review of the Subjective Global Assessment[J]. Nutr Clin Pract,2008,23(4):410-416. DOI:10.1177/0884533608321215.
[53]da Silva FinkJ,Daniel de MelloP,Daniel de MelloE. Subjective global assessment of nutritional status-A systematic review of the literature[J]. Clin Nutr,2015,34(5):785-792. DOI:10.1016/j.clnu.2014.12.014.
[54]SlindeF,GrönbergAM,SvantessonU,et al. Energy expenditure in chronic obstructive pulmonary disease-evaluation of simple measures[J]. Eur J Clin Nutr,2011,65(12):1309-1313. DOI:10.1038/ejcn.2011.117.
[55]GanzoniA,HeiligP,SchönenbergerK,et al. High-caloric nutrition in chronic obstructive lung disease[J]. Schweiz Rundsch Med Prax,1994,83(1):13-16.
[56]CollinsPF,StrattonRJ,EliaM. Nutritional support in chronic obstructive pulmonary disease:a systematic review and meta-analysis[J]. Am J Clin Nutr,2012,95(6):1385-1395. DOI:10.3945/ajcn.111.023499.
[57]CollinsPF,EliaM,StrattonRJ. Nutritional support and functional capacity in chronic obstructive pulmonary disease:a systematic review and meta-analysis[J]. Respirology,2013,18(4):616-629. DOI:10.1111/resp.12070.
[58]FriðriksdóttirAJ,MöllerPH. Clinical guidelines on patients nutrition(2011)[S/OL].(2011-03)[2021-09-01]. http://www.landspitali.is/lisalib/getfile.aspx?itemid=28242. Icelandic.
[59]DeutzNE,BauerJM,BarazzoniR,et al. Protein intake and exercise for optimal muscle function with aging:recommendations from the ESPEN Expert Group[J]. Clin Nutr,2014,33(6):929-936. DOI:10.1016/j.clnu.2014.04.007.
[60]IngadottirAR,BeckAM,BaldwinC,et al. Association of energy and protein intakes with length of stay,readmission and mortality in hospitalised patients with chronic obstructive pulmonary disease[J]. Br J Nutr,2018,119(5):543-551. DOI:10.1017/S0007114517003919.
[61]LuoY,ZhouL,LiY,et al. Fat-Free Mass Index for Evaluating the Nutritional Status and Disease Severity in COPD[J]. Respir Care,2016,61(5):680-688. DOI:10.4187/respcare.04358.
[62]YazdanpanahL,ShidfarF,MoosaviAJ,et al. Energy and protein intake and its relationship with pulmonary function in chronic obstructive pulmonary disease(COPD)patients[J]. Acta Med Iran,2010,48(6):374-379.
[63]AthertonPJ,SmithK,EtheridgeT,et al. Distinct anabolic signalling responses to amino acids in C2C12 skeletal muscle cells[J]. Amino Acids,2010,38(5):1533-1539. DOI:10.1007/s00726-009-0377-x.
[64]BauerJM,VerlaanS,BautmansI,et al. Effects of a vitamin D and leucine-enriched whey protein nutritional supplement on measures of sarcopenia in older adults,the PROVIDE study:a randomized,double-blind,placebo-controlled trial[J]. J Am Med Dir Assoc,2015,16(9):740-747. DOI:10.1016/j.jamda.2015.05.021.
[65]DeutzNE,PereiraSL,HaysNP,et al. Effect of β-hydroxy-β-methylbutyrate(HMB)on lean body mass during 10 days of bed rest in older adults[J]. Clin Nutr,2013,32(5):704-712. DOI:10.1016/j.clnu.2013.02.011.
[66]JonesAW,TaylorA,GowlerH,et al. Systematic review of interventions to improve patient uptake and completion of pulmonary rehabilitation in COPD[J]. ERJ Open Res,2017,3(1):DOI:10.1183/23120541.00089-2016.
[67]de BatlleJ,SauledaJ,BalcellsE,et al. Association between Ω3 and Ω6 fatty acid intakes and serum inflammatory markers in COPD[J]. J Nutr Biochem,2012,23(7):817-821. DOI:10.1016/j.jnutbio.2011.04.005.
[68]BroekhuizenR,WoutersEF,CreutzbergEC,et al. Polyunsaturated fatty acids improve exercise capacity in chronic obstructive pulmonary disease[J]. Thorax,2005,60(5):376-382. DOI:10.1136/thx.2004.030858.
[69]LengS,PicchiMA,TesfaigziY,et al. Dietary nutrients associated with preservation of lung function in Hispanic and non-Hispanic white smokers from New Mexico[J]. Int J Chron Obstruct Pulmon Dis,2017,12:3171-3181. DOI:10.2147/COPD.S142237.
[70]TugT,KaratasF,TerziSM. Antioxidant vitamins(A,C and E)and malondialdehyde levels in acute exacerbation and stable periods of patients with chronic obstructive pulmonary disease[J]. Clin Invest Med,2004,27(3):123-128.
[71]DagaMK,ChhabraR,SharmaB,et al. Effects of exogenous vitamin E supplementation on the levels of oxidants and antioxidants in chronic obstructive pulmonary disease[J]. J Biosci,2003,28(1):7-11. DOI:10.1007/BF02970125.
[72]PaivaSA,GodoyI,VannucchiH,et al. Assessment of vitamin A status in chronic obstructive pulmonary disease patients and healthy smokers[J]. Am J Clin Nutr,1996,64(6):928-934. DOI:10.1093/ajcn/64.6.928.
[73]KazaksAG,Uriu-AdamsJY,AlbertsonTE,et al. Effect of oral magnesium supplementation on measures of airway resistance and subjective assessment of asthma control and quality of life in men and women with mild to moderate asthma:a randomized placebo controlled trial[J]. J Asthma,2010,47(1):83-92. DOI:10.3109/02770900903331127.
[74]GouziF,MauryJ,HéraudN,et al. Additional Effects of Nutritional Antioxidant Supplementation on Peripheral Muscle during Pulmonary Rehabilitation in COPD Patients:A Randomized Controlled Trial[J]. Oxid Med Cell Longev,2019,2019:5496346. DOI:10.1155/2019/5496346.
[75]KokturkN,BahaA,OhYM,et al. Vitamin D deficiency:What does it mean for chronic obstructive pulmonary disease(COPD)?a compherensive review for pulmonologists[J]. Clin Respir J,2018,12(2):382-397. DOI:10.1111/crj.12588.
[76]ShacharSS,WilliamsGR,MussHB,et al. Prognostic value of sarcopenia in adults with solid tumours:A meta-analysis and systematic review[J]. Eur J Cancer,2016,57:58-67. DOI:10.1016/j.ejca.2015.12.030.
[77]JolliffeDA,GreenbergL,HooperRL,et al. Vitamin D to prevent exacerbations of COPD:systematic review and meta-analysis of individual participant data from randomised controlled trials[J]. Thorax,2019,74(4):337-345. DOI:10.1136/thoraxjnl-2018-212092.
[78]MartineauAR,CatesCJ,UrashimaM,et al. Vitamin D for the management of asthma[J]. Cochrane Database Syst Rev,2016,9(9):CD011511. DOI:10.1002/14651858.CD011511.pub2.
[79]van de BoolC,RuttenE,van HelvoortA,et al. A randomized clinical trial investigating the efficacy of targeted nutrition as adjunct to exercise training in COPD[J]. J Cachexia Sarcopenia Muscle,2017,8(5):748-758. DOI:10.1002/jcsm.12219.
[80]MirdamadiA,MoshkdarP. Benefits from the correction of vitamin D deficiency in patients with pulmonary hypertension[J]. Caspian J Intern Med,2016,7(4):253-259.
[81]KicmanAT. Pharmacology of anabolic steroids[J]. Br J Pharmacol,2008,154(3):502-521. DOI:10.1038/bjp.2008.165.
[82]BaillargeonJ,UrbanRJ,ZhangW,et al. Testosterone replacement therapy and hospitalization rates in men with COPD[J]. Chron Respir Dis,2019,16:1479972318793004. DOI:10.1177/1479972318793004.
[83]CasaburiR,BhasinS,CosentinoL,et al. Effects of testosterone and resistance training in men with chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med,2004,170(8):870-878. DOI:10.1164/rccm.200305-617OC.
[84]PanL,WangM,XieX,et al. Effects of anabolic steroids on chronic obstructive pulmonary disease:a meta-analysis of randomised controlled trials[J]. PLoS One,2014,9(1):e84855. DOI:10.1371/journal.pone.0084855.
[85]DagaMK,KhanNA,MalhotraV,et al. Study of body composition,lung function,and quality of life following use of anabolic steroids in patients with chronic obstructive pulmonary disease[J]. Nutr Clin Pract,2014,29(2):238-245. DOI:10.1177/0884533614522832.
[86]Popa-VeleaO,PurcareaVL. Psychological intervention-a critical element of rehabilitation in chronic pulmonary diseases[J]. J Med Life,2014,7(2):274-281.
[87]NaderlooH,VafadarZ,EslaminejadA,et al. Effects of Motivational Interviewing on Treatment Adherence among Patients with Chronic Obstructive Pulmonary Disease:a Randomized Controlled Clinical Trial[J]. Tanaffos,2018,17(4):241-249.
[88]RehmanH,KarpmanC,Vickers DouglasK,et al. Effect of a Motivational Interviewing-Based Health Coaching on Quality of Life in Subjects With COPD[J]. Respir Care,2017,62(8):1043-1048. DOI:10.4187/respcare.04984.
[89]LukEK,GorelikA,IrvingL,et al. Effectiveness of cognitive behavioural therapy in a community-based pulmonary rehabilitation programme:A controlled clinical trial[J]. J Rehabil Med,2017,49(3):264-269. DOI:10.2340/16501977-2189.
[90]KewKM,NashedM,DulayV,et al. Cognitive behavioural therapy(CBT)for adults and adolescents with asthma[J]. Cochrane Database Syst Rev,2016,9(9):CD011818. DOI:10.1002/14651858.CD011818.pub2.
[91]BoltonCE,Bevan-SmithEF,BlakeyJD,et al. British Thoracic Society guideline on pulmonary rehabilitation in adults[J]. Thorax,2013,68Suppl 2:ii1-30. DOI:10.1136/thoraxjnl-2013-203808.
[92]MaltaisF,KirstenAM,HamiltonA,et al. Evaluation of the effects of olodaterol on exercise endurance in patients with chronic obstructive pulmonary disease:results from two 6-week crossover studies[J]. Respir Res,2016,17(1):77. DOI:10.1186/s12931-016-0389-5.
[93]Di MarcoF,SotgiuG,SantusP,et al. Long-acting bronchodilators improve exercise capacity in COPD patients:a systematic review and meta-analysis[J]. Respir Res,2018,19(1):18. DOI:10.1186/s12931-018-0721-3.
[94]CalzettaL,OraJ,CavalliF,et al. Impact of LABA/LAMA combination on exercise endurance and lung hyperinflation in COPD:A pair-wise and network meta-analysis[J]. Respir Med,2017,129:189-198. DOI:10.1016/j.rmed.2017.06.020.
[95]TroostersT,MaltaisF,LeidyN,et al. Effect of Bronchodilation,Exercise Training,and Behavior Modification on Symptoms and Physical Activity in Chronic Obstructive Pulmonary Disease[J]. Am J Respir Crit Care Med,2018,198(8):1021-1032. DOI:10.1164/rccm.201706-1288OC.
[96]MaltaisF,O′DonnellD,GáldizIJB,et al. Effect of 12 weeks of once-daily tiotropium/olodaterol on exercise endurance during constant work-rate cycling and endurance shuttle walking in chronic obstructive pulmonary disease[J]. Ther Adv Respir Dis,2018,12:1753465818755091. DOI:10.1177/1753465818755091.
[97]O′DonnellDE,CasaburiR,FrithP,et al. Effects of combined tiotropium/olodaterol on inspiratory capacity and exercise endurance in COPD[J]. Eur Respir J,2017,49(4):1601348. DOI:10.1183/13993003.01348-2016.
[98]EkströmM,NilssonF,AbernethyAA,et al. Effects of opioids on breathlessness and exercise capacity in chronic obstructive pulmonary disease. A systematic review[J]. Ann Am Thorac Soc,2015,12(7):1079-1092. DOI:10.1513/AnnalsATS.201501-034OC.
[99]AbdallahSJ,Wilkinson-MaitlandC,SaadN,et al. Effect of morphine on breathlessness and exercise endurance in advanced COPD:a randomised crossover trial[J]. Eur Respir J,2017,50(4):1701235. DOI:10.1183/13993003.01235-2017.
[100]VaesAW,MeijerK,DelbressineJM,et al. Efficacy of walking aids on self-paced outdoor walking in individuals with COPD:A randomized cross-over trial[J]. Respirology,2015,20(6):932-939. DOI:10.1111/resp.12570.
[101]HillK,NgL,CecinsN,et al. Effect of Using a Wheeled Walker on Physical Activity and Sedentary Time in People with Chronic Obstructive Pulmonary Disease:A Randomised Cross-Over Trial[J]. Lung,2020,198(1):213-219. DOI:10.1007/s00408-019-00297-2.
[102]WapenaarM,BendstrupE,Molina-MolinaM,et al. The effect of the walk-bike on quality of life and exercise capacity in patients with idiopathic pulmonary fibrosis:a feasibility study[J]. Sarcoidosis Vasc Diffuse Lung Dis,2020,37(2):192-202. DOI:10.36141/svdld.v37i2.9433.
[103]GallefossF,BakkePS. Impact of patient education and self-management on morbidity in asthmatics and patients with chronic obstructive pulmonary disease[J]. Respir Med,2000,94(3):279-287. DOI:10.1053/rmed.1999.0749.
[104]StoilkovaA,JanssenDJ,WoutersEF. Educational programmes in COPD management interventions:a systematic review[J]. Respir Med,2013,107(11):1637-1650. DOI:10.1016/j.rmed.2013.08.006.
[105]GregorianoC,DieterleT,BreitensteinAL,et al. Use and inhalation technique of inhaled medication in patients with asthma and COPD:data from a randomized controlled trial[J]. Respir Res,2018,19(1):237. DOI:10.1186/s12931-018-0936-3.
[106]GiraudV,AllaertFA,RocheN. Inhaler technique and asthma:feasability and acceptability of training by pharmacists[J]. Respir Med,2011,105(12):1815-1822. DOI:10.1016/j.rmed.2011.07.004.
[107]ZengYQ,AuDH,CaiS,et al. Effect of a Patient Education Intervention on Asthma Control and Patient-Doctor Relationship[J]. Chin Med J(Engl),2018,131(9):1110-1112. DOI:10.4103/0366-6999.230736.
[108]ReddyAP,GuptaMR. Management of asthma:the current US and European guidelines[J]. Adv Exp Med Biol,2014,795:81-103. DOI:10.1007/978-1-4614-8603-9_6.
[109]NathanRA,SorknessCA,KosinskiM,et al. Development of the asthma control test:a survey for assessing asthma control[J]. J Allergy Clin Immunol,2004,113(1):59-65. DOI:10.1016/j.jaci.2003.09.008.
[110]RingbaekT,MartinezG,LangeP. A comparison of the assessment of quality of life with CAT,CCQ,and SGRQ in COPD patients participating in pulmonary rehabilitation[J]. COPD,2012,9(1):12-15. DOI:10.3109/15412555.2011.630248.
[111]MahoneyK,PierceJ,PapoS,et al. Efficacy of adding activity of daily living simulation training to traditional pulmonary rehabilitation on dyspnea and health-related quality-of-life[J]. PLoS One,2020,15(8):e0237973. DOI:10.1371/journal.pone.0237973.
[112]WingårdhA,GöranssonC,LarssonS,et al. Effectiveness of Energy Conservation Techniques in Patients with COPD[J]. Respiration,2020,99(5):409-416. DOI:10.1159/000506816.
[113]VellosoM,JardimJR. Study of energy expenditure during activities of daily living using and not using body position recommended by energy conservation techniques in patients with COPD[J]. Chest,2006,130(1):126-132. DOI:10.1378/chest.130.1.126.
[114]PrieurG,CombretY,MedrinalC,et al. Energy conservation technique improves dyspnoea when patients with severe COPD climb stairs:a randomised crossover study[J]. Thorax,2020,75(6):510-512. DOI:10.1136/thoraxjnl-2019-214295.
[115]WhiteheadPJ,Golding-DayMR,BelshawS,et al. Bathing adaptations in the homes of older adults(BATH-OUT):results of a feasibility randomised controlled trial(RCT)[J]. BMC Public Health,2018,18(1):1293. DOI:10.1186/s12889-018-6200-4.
[116]ReimbergMM,CastroRA,SelmanJP,et al. Effects of a pulmonary rehabilitation program on physical capacity,peripheral muscle function and inflammatory markers in asthmatic children and adolescents:study protocol for a randomized controlled trial[J]. Trials,2015,16:346. DOI:10.1186/s13063-015-0876-x.
[117]FettesL,BoneAE,EtkindSN,et al. Disability in Basic Activities of Daily Living Is Associated With Symptom Burden in Older People With Advanced Cancer or Chronic Obstructive Pulmonary Disease:A Secondary Data Analysis[J]. J Pain Symptom Manage,2021,61(6):1205-1214. DOI:10.1016/j.jpainsymman.2020.10.012.
[118]HansenH,BielerT,BeyerN,et al. Supervised pulmonary tele-rehabilitation versus pulmonary rehabilitation in severe COPD:a randomised multicentre trial[J]. Thorax,2020,75(5):413-421. DOI:10.1136/thoraxjnl-2019-214246.
[119]McCabeC,MCannM,BradyAM. Computer and mobile technology interventions for self-management in chronic obstructive pulmonary disease[J]. Cochrane Database Syst Rev,2017,5(5):CD011425. DOI:10.1002/14651858.CD011425.pub2.
[120]MohrDC,HoJ,DuffecyJ,et al. Effect of telephone-administered vs face-to-face cognitive behavioral therapy on adherence to therapy and depression outcomes among primary care patients:a randomized trial[J]. JAMA,2012,307(21):2278-2285. DOI:10.1001/jama.2012.5588.



