引言
近日,北京协和医院王孟昭教授和台湾大学医学院附设医院癌医中心分院杨志新教授作为共同第一作者、美国哈佛大学医学院附属丹娜法伯癌症研究院Pasi A. Jänne教授作为通讯作者,在Cancer Discovery(IF:39.397)发表题为「Sunvozertinib, a selective EGFR inhibitor for previously treated non-small cell lung cancer with EGFR exon 20 insertion mutations」的研究论文。以下是全文解析,与君共赏。

摘要
表皮生长因子受体(EGFR) 20号外显子插入(exon20ins)突变发生率约占非小细胞肺癌(NSCLC)的2%。临床缺乏有效的治疗手段,患者预后较差。舒沃替尼(Sunvozertinib,DZD9008)作为一款口服、高效、不可逆、针对多种EGFR突变的高选择性EGFR酪氨酸激酶抑制剂(TKI),在细胞系和异种移植瘤模型中均显示强效的抗肿瘤活性。合并两项Ⅰ期临床研究结果分析,舒沃替尼人体最大耐受剂量是400 mg/日;最常见的药物相关不良反应是腹泻和皮疹;舒沃替尼在治疗剂量 ≥100 mg/日时,显示出对各种EGFR exon20ins突变亚型的患者有效,并在基线有脑转移患者及Amivantamab疗效不佳或治疗后进展的患者中均显示疗效;中位缓解持续时间(DoR)还未达到。
关键词:临床研究结果;Ⅰ期临床研究;肺癌;小分子药物;激酶抑制剂
前言
非小细胞肺癌(NSCLC)是全球癌症死亡的主要原因之一。目前,已有多款EGFR TKI获批用于治疗携带EGFR敏感突变、T790M突变或罕见突变的晚期非小细胞肺癌。但针对EGFR exon20ins突变(发生率约为NSCLC 的2%)的靶向治疗发展仍面临诸多挑战。目前,含铂化疗是携带EGFR exon20ins突变的晚期非小细胞肺癌患者的可选方案,但整体预后较差:中位无进展生存期(PFS)约6个月,中位生存期(OS)约24个月。Amivantamab作为靶向EGFR和MET的双特异性抗体,于近日获得美国 FDA 加速批准用于治疗EGFR exon20ins突变型晚期非小细胞肺癌患者,其客观缓解率 (ORR) 为 40%。EGFR激酶抑制剂Mobocertinib也于近日获得FDA加速批准用于治疗EGFR exon20ins突变型晚期非小细胞肺癌患者,但其关键Ⅱ期研究结果提示Mobocertinib的ORR仅为28%;≥3级治疗相关不良事件 (TEAE)发生率为40%,尤其是≥3级腹泻,发生率达21%。发生≥3级腹泻的患者需要减少用药剂量,严重者甚至需要停药。因此,针对EGFR exon20ins突变的治疗方法仍然有提升的空间。迄今为主,已知NSCLC中的EGFR exon20ins突变亚型超过39种,不同亚型对EGFR TKI的敏感性不完全相同。因此,亟须一款对多种EGFR exon20ins突变亚型都有效且安全可耐受的药物。
舒沃替尼作为一款口服、强效、不可逆抑制、针对多种EGFR突变亚型的高选择性EGFR TKI,不仅对EGFR exon20ins突变有效,对EGFR敏感突变、T790M突变和罕见突变都有效,但对EGFR野生型亲和力低。舒沃替尼作为口服药,在非临床和临床研究中,均表现出良好的药物代谢动力学特性。除此之外,毒理研究结果提示舒沃替尼具备良好的安全性潜能。
本文详细阐述了舒沃替尼在体外和体内对于EGFR exon20ins突变的抗肿瘤活性以及抑制EGFR exon20ins突变的作用机制,并详细报道了正在进行的两项Ⅰ期研究中有关舒沃替尼安全性、药代动力学(PK)和疗效的分析结果。
研究结果
> 舒沃替尼的分子结构设计
在研究EGFR 20号外显子插入突变抑制剂项目开始阶段中,首先通过细胞实验监测大量不同化合物结构对EGFR 20号外显子插入突变与野生型EGFR的选择性,最后选择以2-氨基嘧啶为母环,致力设计一款能与C797氨基成不可逆的共价抑制剂。基于稀有已知的EGFR 20号外显子插入结构信息,研究者决定在2-氨基嘧啶的C-4位置上使用转动性较为灵活的苯胺基结构来取代奥希替尼的甲基吲哚,并对苯胺基上的苯环进行不同取代基的广泛结构与活性关系研究。下文简要阐述了舒沃替尼的构效关系(SAR)(图1)。
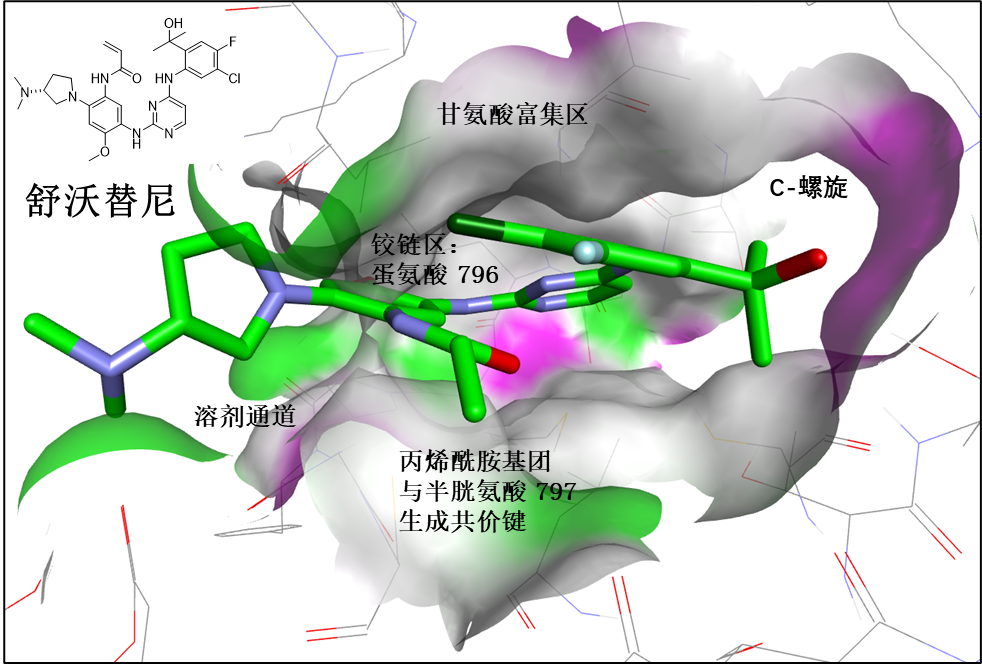
图1:舒沃替尼与EGFR受体的结合:(i) 氨基嘧啶与Met796残基的双铰链相互作用; (ii) 丙烯酰胺基团与Cys797残基通过不可逆共价键结合; (iii) 2-羟基丙烷-2-基占据C螺旋部位的空间; (iv) 二甲氨基四氢吡咯与溶剂通道端的极性相互作用。绿色: 碳原子; 紫色: 氮原子; 红色: 氧原子; 深绿色: 氯原子; 浅蓝色: 氟原子。蛋白表面的颜色代表ATP结合袋,并仅供参考示意
通过细胞EGFR磷酸化分析实验(L858R/T790M、ASV、NPH和野生型)筛选出比奥希替尼具有更强效的、靶向EGFR 20号外显子插入突变的、不可逆共价的化合物。经过深入的结构与活性关系研究发现,在2-氨基嘧啶的C-4位置上连接苯胺基能提供一个具有强效EGFR 20号外显子插入抑制作用的优选结构。在所有苯胺基邻位取代基中的研究,根据其对EGFR靶点磷酸化,细胞的抑制作用,对野生型EGFR的选择性和体外DMPK参数的优势,进行逐步优化。最终,基于对化合物的整体特性,项目团队决定选择了嘧啶类化合物DZD9008(舒沃替尼)作为候选药物,继续进行了大量的非临床动物体内药代动力学,抗肿瘤有效性和安全性研发实验。结果表明舒沃替尼在大鼠和犬中均具有高渗透性和生物利用度。舒沃替尼对主要EGFR 20号外显子插入亚型的选择性至少是EGFR野生型的2倍。
> 舒沃替尼作为一款EGFR exon20ins抑制剂,在异种移植瘤模型中显示出良好的药代动力学(PK)/药效学(PD)特性,且对EGFR野生型作用较弱
为测试舒沃替尼对EGFR exon20ins突变的酶活性,研究者使用EGFR exon20ins NPG酶的重组激酶结构域进行酶促试验。在对化合物进行预孵育的条件下,舒沃替尼对EGFR exon20ins NPG具有强效的抑制作用,IC50为2.1 nM,对野生型EGFR的抑制作用略弱,IC50为2.4 nM。
在对化合物未进行预孵育的条件下,对舒沃替尼开展了覆盖117个重组人激酶的体外激酶谱筛选试验,探索其更广泛的激酶选择性谱。在1μM浓度下,舒沃替尼对15个激酶的抑制作用大于50%,包括EGFR、HER2、HER4和EGFR耐药突变。随后对这些活性抑制大于50%的激酶进行了剂量-反应试验,测定IC50。结果表明在这15个激酶中,舒沃替尼仅对1个激酶(EGFR T790M突变)抑制的IC50< 150nM,对另外2个激酶(BTK、EGFR野生型)抑制的IC50S< 250nM。EGFR T790M的IC50约为EGFR野生型的10倍。总体而言,舒沃替尼仅对EGFR突变型表现出强效的激酶抑制作用,对其他激酶的脱靶活性较低。
为测试舒沃替尼的细胞活性,将14种不同的EGFR exon20ins突变亚型转染到Ba/F3细胞系中构建了携带相应突变的工程细胞株。在这些工程细胞株中,舒沃替尼表现出强效的抑制EGFR磷酸化的活性,IC50范围为6 nM至40 nM(图2A)。在其他表达EGFR敏感突变、T790M耐药突变和罕见突变的细胞系中,舒沃替尼抑制EGFR磷酸化的效力更高,IC50范围为1.1 nM至12 nM(图2A)。在EGFR野生型过表达的A431细胞系中评估了舒沃替尼对EGFR野生型的活性。在该细胞系中,舒沃替尼抑制EGFR磷酸化的效力较低,IC50为58nM(图2A)。因此,舒沃替尼对EGFR exon20ins突变、罕见突变、敏感/耐药突变的选择性分别是EGFR野生型的1.4-9.6倍、4.8倍、52倍,特别是对EGFR exon20ins突变最常见亚型(insASV、insSVD、insNPH)的选择性是EGFR野生型的2.5-3.1倍。对于这些细胞,舒沃替尼可强效抑制细胞增殖,GI50范围为6 nM-88 nM。舒沃替尼对EGFR野生型的活力也在Ba/F3母细胞中进行了测试,野生型EGFR磷酸化IC50和抑制细胞增殖GI50分别为52 nM和113 nM,与A431细胞系的结果具有可比性。
在EGFR exon20ins突变型患者来源的异种移植瘤 (PDX) 模型LU0387 (EGFR exon20ins 773_NPH) 或LU3075 (EGFR exon20ins 772_DNP) 中,舒沃替尼口服给药,表现出显著的剂量依赖性抗肿瘤活性。在≥25 mg/kg剂量下,观察到舒沃替尼的抗肿瘤活性(图2B和2C)。相反的是,在携带EGFR野生型的异种移植瘤模型中,在25 mg/kg剂量下未观察到舒沃替尼的抗肿瘤活性(图2D),表明其在EGFR exon20ins突变型和EGFR野生型之间具有选择性。
舒沃替尼在异种移植瘤模型中抗肿瘤活性的瀑布图见补充图S3A和S3B,这些图直观反映了这种差异。并且,携带insASV突变(最常见的EGFR exon20ins突变亚型之一)的转基因小鼠模型也证明了舒沃替尼的抗肿瘤活性,这进一步证实了其对EGFR exon20ins突变的抗肿瘤活性。除此之外,在携带T790M突变的脑转移模型中评估了舒沃替尼的抗肿瘤活性。如补充图S5所示,在luci-H1975 脑转移模型中,在25 mg/kg 一天两次或50 mg/kg 一天两次的剂量下观察到舒沃替尼明显的抗肿瘤活性。

图2:舒沃替尼在体外实验和体内实验中的活性。A.舒沃替尼在携带EGFR exon20ins突变、EGFR敏感突变、EGFR耐药突变和EGFR野生型的细胞中抑制EGFR磷酸化的IC50s;B.舒沃替尼在携带EGFR exon20ins insNPH的PDX LU0387模型中的抗肿瘤活性;C.舒沃替尼在携带EGFR exon20ins insDNP的PDX LU0375模型中的抗肿瘤活性;D.舒沃替尼在表达EGFR野生型的A431异种移植模型中的抗肿瘤活性;E.舒沃替尼在PDX LU3075模型中的PK/PD分析。
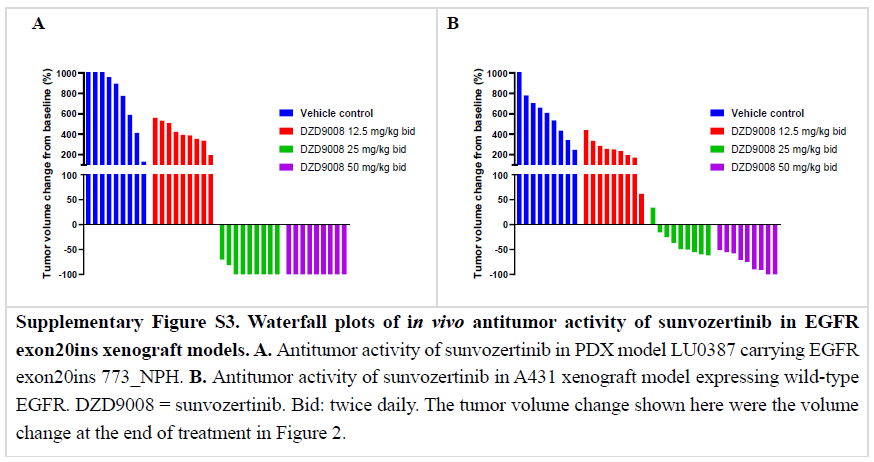
补充图S3:舒沃替尼在异种移植瘤模型中抗肿瘤活性的瀑布图
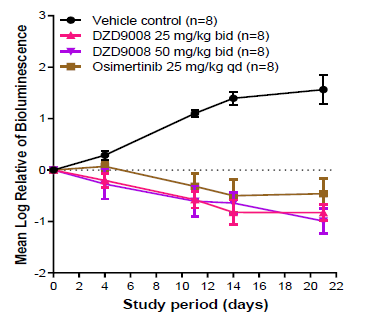
补充图S5:舒沃替尼在脑转移异种移植瘤模型中抗肿瘤活性
在上面的体内药效学实验结束时,采集了末次给药后血浆样本和肿瘤组织,以分析药物浓度与肿瘤组织中pEGFR或pERK抑制作用的相关性。如图2E所示,随着剂量递增,舒沃替尼血浆药物浓度相应增加,pEGFR抑制作用更强。舒沃替尼剂量≥25mg/kg时,其血浆浓度超过体外DNP Ba/F3工程细胞上pEGFR IC50的时间达16小时以上。当剂量≥25 mg/kg,舒沃替尼给药2小时后对pEGFR抑制作用超过50%,并且该效应持续时间长达约24小时。这些数据表明,舒沃替尼在体内具有良好的药代动力学和药效学特征。
> 舒沃替尼治疗EGFR或HER2突变型晚期NSCLC的Ⅰ期临床研究结果
I期临床研究包括全球多中心临床研究WU-KONG1 (NCT03974022) 和中国多中心临床研究WU-KONG2 (CTR20192097)。
研究设计
WU-KONG1是一项在美国、澳大利亚、韩国及中国台湾等17家医疗机构进行的Ⅰ/Ⅱ期、开放标签、多中心临床研究。研究包括两部分:A部分(包括剂量递增、食物效应和剂量扩展三部分)和B部分(剂量延展)。
WU-KONG2是一项在中国8家医疗机构进行的Ⅰ期、开放标签、多中心临床研究,包括剂量递增和剂量扩展两部分,这两部分的研究设计与WU-KONG1的类似。
所有患者在参与本研究之前均签署了知情同意书,研究方案得到各医疗机构伦理委员会的审批。研究在《赫尔辛基宣言》和《良好临床实践指南》的指导下进行,国际会议定义协调。
研究目的
主要研究终点是评估舒沃替尼的安全性和耐受性、确定其最大耐受剂量(MTD)。次要研究终点包括舒沃替尼药代动力学分析、依据RECIST1.1标准评估的抗肿瘤疗效等。
统计分析
使用贝叶斯自适应设计获得剂量递增和预估最大耐受剂量 (MTD)。MTD是指剂量限制性毒性发生率<30%的最高剂量。将所有至少服用过一次舒沃替尼的患者纳入安全性分析,将至少进行过一次疗效评估的EGFR exon20ins突变型晚期NSCLC患者纳入疗效分析。
研究结果
本文报道的I期研究数据来自于全球多中心开展的WU-KONG 1研究(NCT03974022)和在中国多中心开展的WU-KONG 2研究(CTR20192097)。上述两个研究的设计基本相同,合并分析了评估舒沃替尼的安全性、药代动力学特征及抗肿瘤活性。
2019年7月9日至2021年4月3日,共纳入102例携带EGFR或HER2突变的晚期NSCLC患者(WU-KONG1研究:54例;WU-KONG2研究:48例,基线特征(如图3)。在剂量递增部分,舒沃替尼共分50 mg、100 mg、200 mg、300 mg和400 mg五个剂量组。基于剂量递增的安全性、耐受性、药代动力学及疗效分析,最终确定三个剂量进行剂量扩展研究(200 mg、300 mg和400 mg)。到数据截至日,剂量递增组、剂量扩展组和食物效应组分别有6例、28例和3例患者仍在继续舒沃替尼治疗。
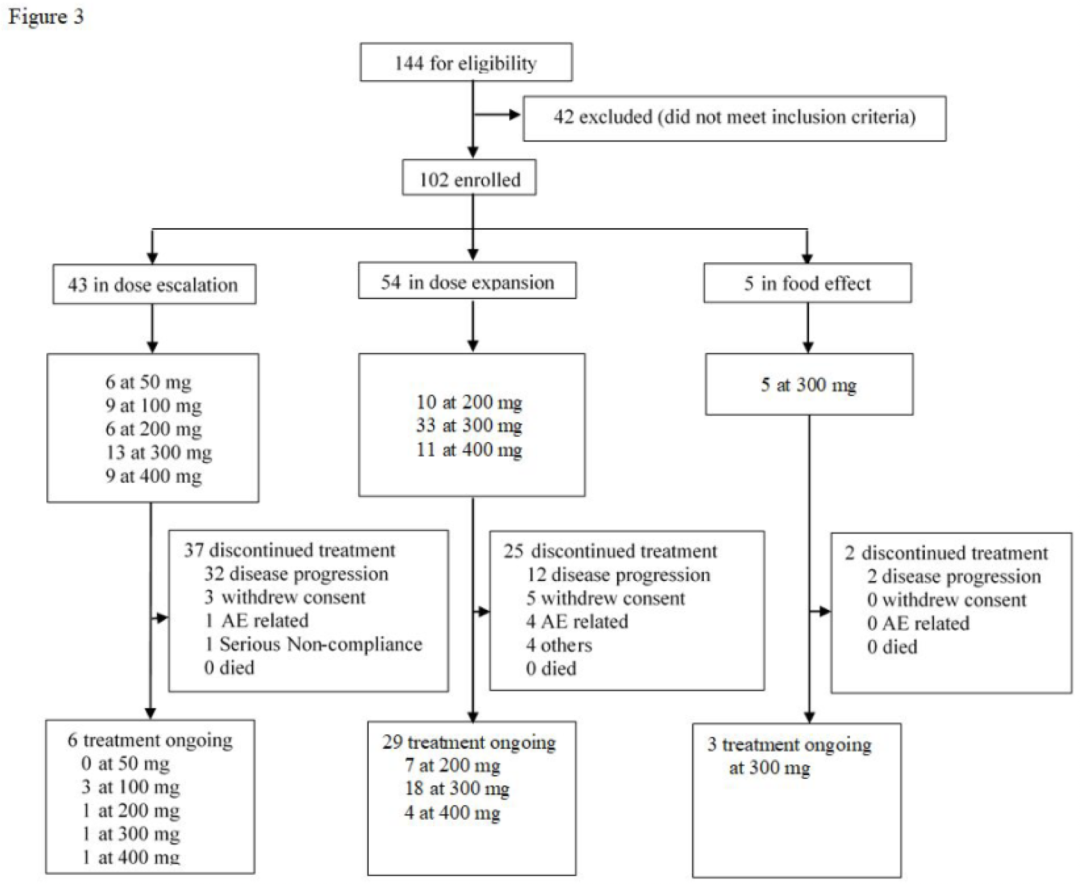
图3:WU-KONG1和WU-KONG2研究患者筛选图
患者的基线特征如表1:中位年龄59岁;女性占比55.9%;99%患者ECOG评分≤1分;中位既往治疗线数为3线,其中91.2%患者接受过化疗;EGFR exon20ins突变61%,EGFR敏感突变4%,EGFR T790M突变1%,EGFR敏感/T790M双突变6%,其他EGFR罕见突变1%,HER2 exon20ins突变28%。

表1:WU-KONG1和WU-KONG2研究汇总分析的患者基线特征
在剂量递增组,舒沃替尼耐受剂量达400 mg。两例患者出现剂量限制性毒性(DLT):1例来自300 mg剂量组,发生3级腹泻,之后出现呼吸窘迫综合征;另1例来自400 mg剂量组,发生3级心律失常。包括所有剂量组,研究者评估的≥3级药物相关不良反应发生率为33.3%。因药物相关TEAE(治疗期间出现的不良反应)导致治疗暂停、减剂量和终止治疗的比例分别为23.5%、15.7%和5.9%(如表2)。发生率>10%的最常见TEAE详见补充数据部分表格S5。包括所有级别的腹泻和皮疹的发生率分别为53.9%和40.2%,其中≥3级腹泻发生率仅为4.9%,未报告≥3级皮疹。剂量递增组的安全性和耐受性分析结果提示400 mg每日一次口服是最大耐受剂量(MTD),因此,选定了200 mg、300 mg和400 mg 被推荐作为剂量扩增组研究剂量。
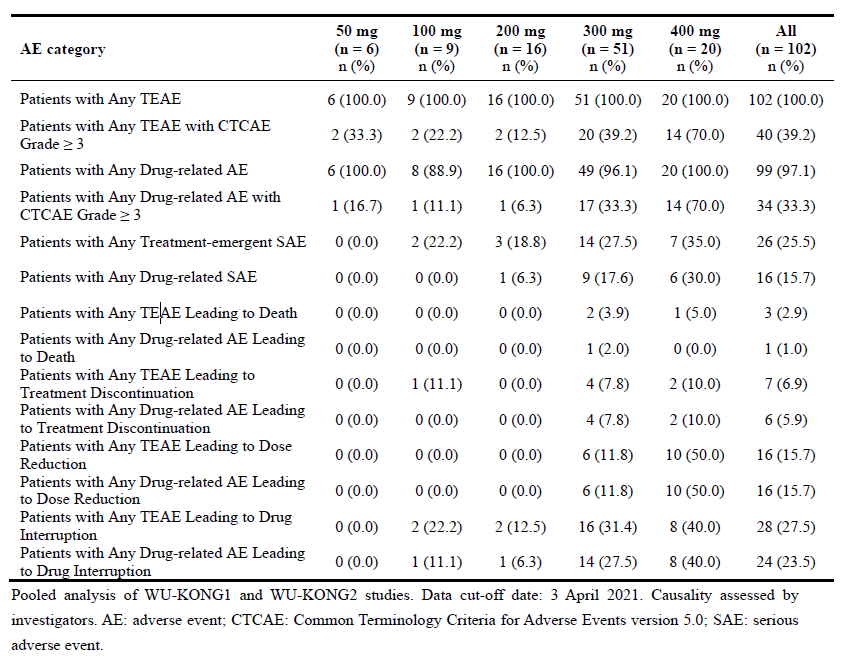
表2:WU-KONG1和WU-KONG2研究汇总分析的安全性结果
用于药代动力学分析的血浆标本分别来自于剂量递增组(n=40)和剂量扩展组(n=24)。在所有剂量组中,舒沃替尼单次给药后中位达峰时间(tmax)为4-7小时,重复给药后稳态下中位达峰时间(tss,max)为5-6小时。每日一次给药方案下,舒沃替尼药代动力学在给药后15天内达到稳态。在研究剂量范围内,稳态下舒沃替尼暴露(包括AUC和Cmax)与剂量大致呈现剂量比例关系。此外,重复给药达到稳态后药物的蓄积约为3倍,与舒沃替尼人体消除半衰期(50小时)的数据预期一致。当舒沃替尼剂量≥200 mg,稳态下舒沃替尼血浆谷浓度(Css,min)的几何均值高于大部分EGFR exon20ins突变亚型EGFR磷酸化的IC50值(如图2A),提示对于目标靶点持续抑制作用。
疗效分析集纳入了56例携带EGFR exon20ins突变的患者,在≥100 mg剂量水平均观察到部分缓解(PR)。包括所有剂量组,最佳客观缓解率(ORR)为41.1%。在200 mg和300 mg剂量组,ORR分别为45.5%和48.4%(如表3)。在不同EGFR exon20ins突变亚型中均观察到舒沃替尼的抗肿瘤活性(如补充数据表S7)。且在基线有脑转移患者及Amivantamab疗效不佳或治疗后进展的患者中也观察到部分缓解(PR)病例(如图4A)。到数据截至日,中位随访时间4.2个月,中位缓解持续时间>3.5个月,且尚未达到,最长缓解持续时间>8个月。23例肿瘤缓解的患者,有15位患者仍在舒沃替尼治疗中并持续缓解(如图4B)。中位无疾病进展生存期>4个月,且尚未达到。

表3:对于系统治疗失败的、携带EGFR exon20ins突变的晚期NSCLC患者,舒沃替尼的抗肿瘤活性
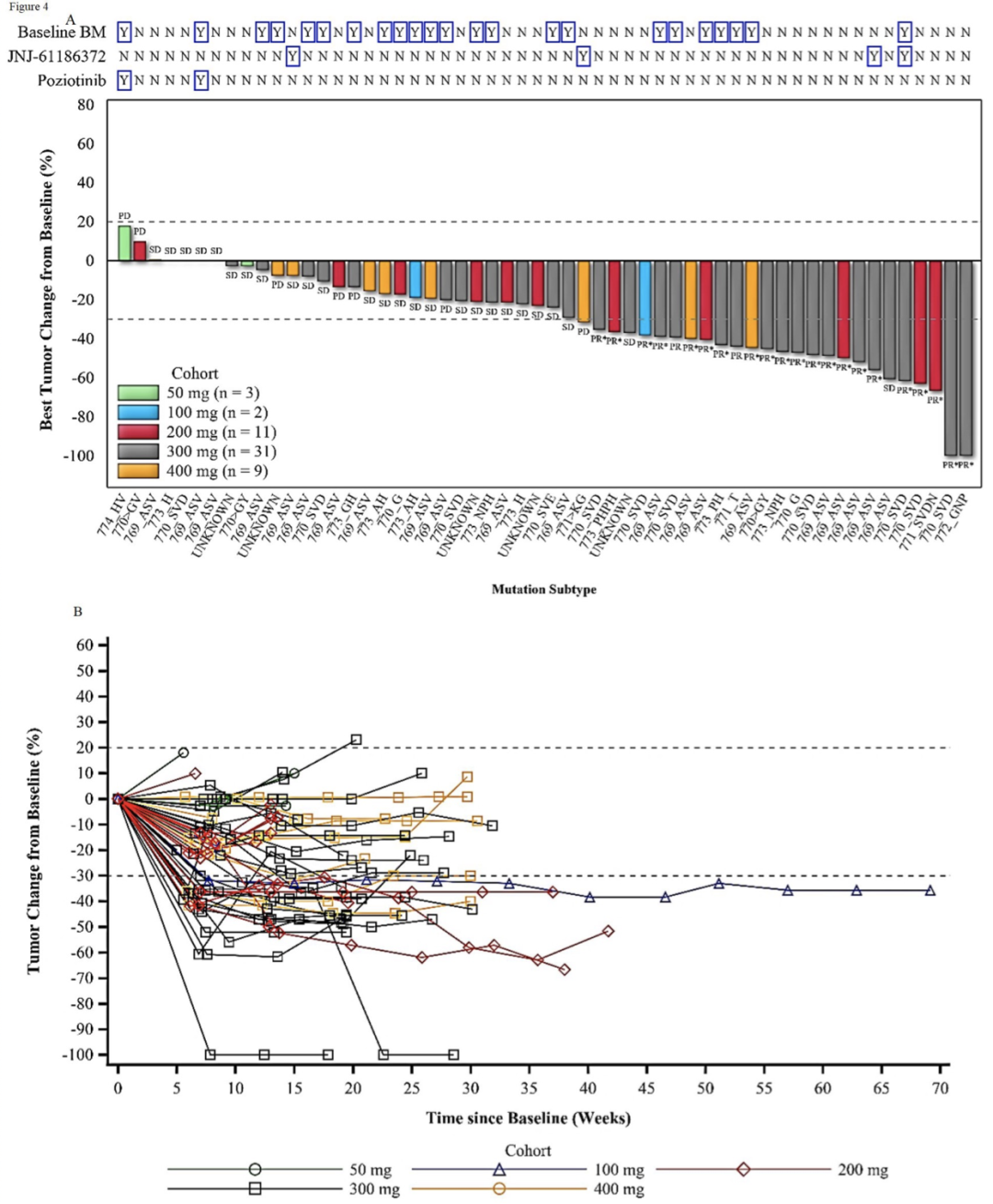
图4:对于系统治疗失败的、携带EGFR exon20ins突变的晚期NSCLC患者,舒沃替尼的临床抗肿瘤活性。A、在不同剂量、突变亚型、既往接受过amivantamab或者poziotinib治疗、基线有脑转移的患者中,舒沃替尼的最佳肿瘤缓解情况;B、不同剂量组患者接受舒沃替尼治疗的肿瘤缓解情况及持续时间
此外,在WU-KONG1和WU-KONG2研究的汇总分析中也,初步数据显示舒沃替尼对于EGFR敏感突变、EGFR敏感/T790M双突变和HER2 exon20ins突变的NSCLC也有抗肿瘤活性。
讨论
EGFR TKI类靶向药物(如吉非替尼、奥希替尼等)的研发成功明显改善了EGFR敏感突变型非小细胞肺癌患者的临床结局。然而,EGFR 20号外显子插入突变有其独特的蛋白结构,目前已获批上市的EGFR TKI类靶向药物对其缺乏有效的抑制作用。因此现在EGFR 20号外显子插入突变非小细胞肺癌患者迫切需要一款有着强效的、高选择性的EGFR抑制剂。EGFR 20号外显子插入突变大部分发生在aC-螺旋后的C末端环上。少数特例如763_764insFQEA突变亚型,发生在aC-螺旋内。大多数研究推断结果认为EGFR 20号外显子插入突变在催化活性构象中稳定了aC-螺旋。除了aC-螺旋,不同EGFR 20号外显子插入突变亚型也可能间接影响ATP结合口袋周围结构,如P环、铰链或其他β折叠结构,导致EGFR 20号外显子插入突变体的ATP结合口袋变小。但是,因为大部分EGFR 20号外显子插入突变发生在ATP结合口袋区域之外,ATP结合口袋的氨基酸序列都是完全相同的,包括EGFR野生型蛋白。尽管如此,突变体ATP结合口袋和野生型相比,细微差别也可能影响其与ATP和抑制剂的相互作用。大多数EGFR 20号外显子插入突变体缺乏明确的结构和生物物理学数据,因此难以设计出高选择性的泛EGFR 20号外显子插入突变抑制剂。最近,Gonzalvez等人报告了靶向EGFR 20号外显子插入突变的mobocertinib (TAK-788) 结构设计。该研究以「看门人基团」Thr790和奥希替尼周围未占据的空间为研究重点。mobocertinib研究数据提示,对嘧啶母环铰链结合位点进行修饰,可以抑制EGFR 20号外显子插入突变,且具有一定的EGFR野生型选择性。
在设计舒沃替尼时,与mobocertinib不同的是,研究者决定不修改嘧啶母环C-5(靠近Thr790)的位置,而在嘧啶母环C-4位置上使用一个苯胺基结构,从而使候选药物的分子结构变得更灵活,希望借此调节对不同EGFR 20号外显子插入突变亚型的不完全相同的ATP口袋进行灵活结合。通过几轮设计-制备-测试-分析的优化,最终筛选出对EGFR突变有选择性并具备成药特性的候选药物—舒沃替尼。
两项I期研究旨在评估舒沃替尼的安全性、耐受性、药代动力学特征和抗肿瘤活性。根据非临床毒性研究和药代动力学/药效学模型,确定临床研究起始剂量(50 mg每日一次)和剂量递增的方案。400 mg每日一次口服是舒沃替尼最大耐受剂量。研究中不良事件的发生率和严重程度随着随剂量递增而呈现增加的趋势。最常见的药物相关不良反应为腹泻和皮疹,这与舒沃替尼抑制野生型EGFR信号通路的作用机制一致。相比已获批的EGFR TKI(如阿法替尼和达克替尼)以及在研的EGFR exon20ins抑制剂(如mobocertinib),舒沃替尼显示出更好的安全性,尤其在200 mg和300 mg组,因药物相关不良反应导致减剂量或停药的比例及≥3级药物相关TEAE比例较低,这与舒沃替尼针对野生型EGFR较好的选择性一致。
在50 mg–400 mg剂量范围内,舒沃替尼的暴露量与剂量大致呈现比例关系,提示药物可预测的药代动力学特征。重复给药达到稳态后药物的蓄积约3倍,与人体消除半衰期的预期一致。此外,稳态下药物峰浓度和谷浓度的波动小。上述药代动力学数据提示舒沃替尼具有良好的临床药代动力学特征。且在100 mg 剂量下,舒沃替尼的稳态下谷浓度已经可以达到部分体外EGFR 突变亚型的磷酸化IC50。当剂量达到200 mg或以上剂量范围后,谷浓度可以达到大多数亚型的磷酸化IC50。与上述数据一致,临床有效性结果显示100 mg及以上剂量下观察到舒沃替尼的抗肿瘤活性。
值得注意的是,I期研究患者基线情况较差,中位既往治疗线数是3线,在这种情况下,仍然观察到舒沃替尼确切的抗肿瘤活性。在4例既往接受过amivantamab治疗的患者中,2例出现了部分缓解(PR)。基于这些数据,舒沃替尼被美国FDA授予「突破性治疗药物认定」、用于治疗含铂化疗失败的、携带EGFR exon20ins突变的局部晚期或转移性NSCLC患者。后续可以通过更大样本量的研究进一步确认舒沃替尼在amivantmab或其他EGFR exon20ins抑制剂治疗后患者中的抗肿瘤活性。除此之外,I期研究在基线脑转移患者中亦观察到舒沃替尼的抗肿瘤活性,但由于颅内病灶未被选为研究评估的靶病灶,因此舒沃替尼在颅内的抗肿瘤活性有待后续研究进一步证实。
综上所述,非临床研究和I期临床研究数据均表明舒沃替尼具有良好的安全性/耐受性、药代动力学特征和抗肿瘤活性,这为其在治疗携带EGFR exon20ins突变型NSCLC中的进一步临床研发提供了依据。
参考文献(略)
全文检索信息:Cancer Discov candisc.1615.2021;https://doi.org/10.1158/2159-8290.CD-21-1615



