推荐语
近日,国家卫生健康委员会、科技部、工业和信息化部、国家药品监督管理局、国家中医药管理局等五部门联合发布了《第一批罕见病目录》,共收录121种疾病,其中多种为呼吸疾病,为此《呼吸界》特约专家对此逐一进行分析解读,敬请关注。
肺淋巴管平滑肌瘤病(Lymphangioleiomyomatosis,LAM)是一种罕见的以双肺多发囊泡影为主要表现的疾病,其可分为散发性LAM以及家族性结节性硬化(Tuberous sclerosis complex,TSC)-LAM。
流行病学与危险因素
散发性LAM的准确发病率目前仍不知晓,据LAM基金会估计,女性中LAM的患病率为3~5/100万 [1]。而罹患TSC的患者中LAM的患病率更高,约有30%的TSC女性会出现LAM样的肺部表现 [2]。LAM几乎只累及女性,由以育龄期女性为多见,妊娠期间、月经周期时以及应用外源性雌激素时有疾病进展加速的报道,考虑雌激素在LAM的发病中占据重要地位,而女性患者绝经后肺功能下降速度则变缓。
LAM的发病机制
LAM发病机制 [3] 的核心是非典型平滑肌样细胞(LAM细胞)在肺组织中过度增殖并出现多发囊腔结构,这种特殊的肺脏表现可能与增生的LAM细胞堵塞远端小气道及破坏肺泡结构有关。LAM细胞增殖的原因在有遗传背景和没有遗传背景的患者中并不相同,在有遗传背景的患者中,TSC基因(尤其是TSC2基因)突变导致mTOR通路激活是导致LAM细胞过度增殖的原因;而在散发性LAM患者中,雌激素的作用及其他生长因子的异常刺激可能是导致LAM细胞过度增殖的原因。同时过度增殖的LAM细胞会累及淋巴管导致淋巴管畸形,该表现与VEGF等生长因子参与疾病发生有关。
病理改变
组织学诊断是LAM诊断的金标准。与发病机制对应,LAM的两个标志性组织病理学特征是肺囊性病变和LAM细胞。大体病理标本可见双肺多发囊性病变,壁较肺气肿稍厚,质地较蜂窝柔软。镜下可见到囊性病变周围及淋巴管、静脉中形成LAM细胞结节, LAM细胞常为梭形,与平滑肌细胞相比通常具有更淡或有空泡的细胞质。含铁血黄素沉着也是常见表现。免疫组化方面,可有黑素细胞的标记(human melanoma black [HMB]-45, Melan-A, tyrosinase, microphthalmia transcription factor, NKI/C3)和/或肌细胞标记(smooth muscle actin, pan-muscle actin, muscle myosin, calponin)表达。另有许多LAM细胞表达雌激素及孕激素受体(estrogen receptor [ER], progesterone receptor [PR]),印证了性激素在LAM发病机制中的作用。
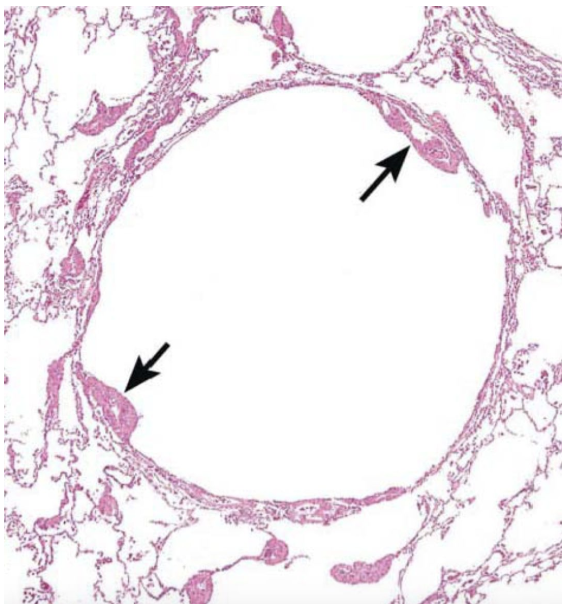
【图1】 典型肺LAM组织学表现(HE染色),于囊壁可见结节增生样LAM细胞(箭头)
临床表现
最经典的散发型LAM表现为育龄期女性出现反复自发性气胸(36%)和/或乳糜胸水(21%)、乳糜痰(7%),其他非特异的呼吸系统表现包括乏力(70%)、进行性呼吸困难(70%)、胸痛(<10~15%)、咳嗽(<10~15%)、肺动脉高压(<7%)、咯血(<5%)等 [4]。30%的散发型LAM患者可合并肾血管平滑肌脂肪瘤(angiomyolipomas, AML),存在AML的患者可有腹痛、腹块和血尿。
需要注意的是,临床表现提示LAM的患者,一定要系统筛查全身表现,以区别为散发型LAM还是TSC-LAM。TSC-LAM的系统表现还包括 [5]:
◆ 皮肤:色素减退斑,亦称叶状白斑(ash-leaf spot),血管纤维瘤,鲨鱼皮样斑;
◆ 中枢神经系统:癫痫、胶质神经元错构瘤(皮质结节)、室管膜下结节、室管膜下巨细胞瘤(subependymal giant cell tumor, SGCT)、白质易位;
◆ 心脏:心脏横纹肌瘤;
◆ 肺:除LAM外,还有多灶性微结节性肺细胞增生(multifocal micronodular pneumocyte hyperplasia, MMPH)和肺透明细胞瘤(clear cell tumor of the lung, CCTL);
◆ 肾脏:肾囊肿,肾血管平滑肌脂肪瘤(TSC-LAM患者中的发病率高于散发型LAM);
◆ 其他:口腔纤维瘤、视网膜错构瘤、恶性肿瘤等。
辅助检查
HRCT:特征性表现为双肺实质内弥漫分布的多发囊泡影,一般直径<2cm,呈圆形或类圆形,壁薄。可合并气胸或胸腔积液(乳糜胸)。

【图2】肺LAM的典型HRCT表现
肺功能:以阻塞性通气障碍及弥撒功能障碍为主要特征,通气障碍早期可表现为小气道病变或可逆的阻塞性通气障碍,进展期表现为不可逆的阻塞性通气障碍、限制性通气障碍及弥散功能减低。
血管内皮生长因子-D(vascular endothelial growth factor-D,VEGF-D):VEGF-D是一种淋巴管生成相关的生长因子,近年来发现LAM患者血清VEGF-D水平异常升高,这可以解释LAM患者存在淋巴管异常。诊断界值为800而且VEGF-D水平与疾病严重程度相对应,更高水平的VEGF-D常提示更加严重的肺部囊性病变及肺功能受损 [6]。
诊断与鉴别诊断
诊断流程
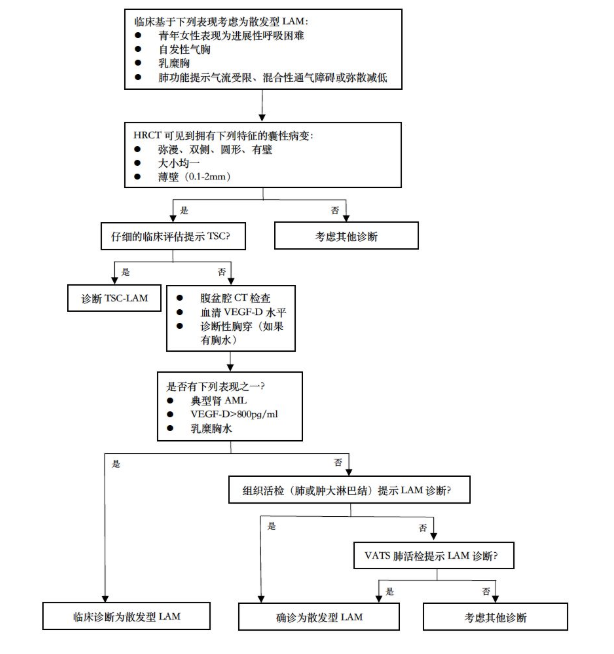
[7] LAM:淋巴管平滑肌瘤病;TSC:结节性硬化;TSC-LAM:结节性硬化-淋巴管平滑肌瘤病;AML:血管平滑肌脂肪瘤;VEGF-D:血管内皮生长因子-D;VATS:电视辅助胸腔镜手术。
鉴别诊断
1、肺气肿:多有吸烟史,无吸烟史的青年起病严重肺气肿患者需警惕α-1抗胰蛋白酶缺乏。多发弥漫的肺气肿需与LAM相鉴别。典型肺气肿以上肺分布为著(α-1抗胰蛋白酶缺乏可能出现下肺分布为著),囊性病变无壁,且气肿中可见血管及结缔组织组成的「点状」或「树枝状」凸起结构。
2、肺朗格汉斯细胞组织细胞增多症(pulmonary langerhans cell histiocytosis, pLCH):可为吸烟相关单纯累及肺部的pLCH,亦可为系统性LCH累及肺。pLCH的囊性病变的壁较LAM的囊性病变更厚,上肺为著分布,肋膈角不受累。囊性病变早期可为小结节,后期可相互融合形成不规则囊腔。组织学可见朗格汉斯细胞(CD-1α染色阳性)。
3、Birt-Hogg-Dubé综合征(BHD):同样表现为双肺囊性病变,但分布不均匀,多沿支气管血管束走形,分布较LAM稀疏,大小不等且差异较明显,薄壁且伴有血管束附于一侧。与LAM类似的是,BHD患者同样可出现自发性气胸或肾脏肿瘤,但肾脏肿瘤非AML而多见肾癌。该病本质为FLCN基因突变所致。
治疗及预后
肺功能正常或轻度受损患者(FEV1≥70%预测值):
◆ 支持治疗为主:戒烟,接种流感及肺炎疫苗,适度运动。散发型LAM患者避免外源性雌激素或妊娠。
◆ 可逆性气道阻塞患者可吸入支气管扩张剂(β2受体激动剂或抗胆碱能药可能均有用),可部分缓解症状,但不影响预后 [8]。
肺功能中重度受损患者(FEV1<70%预测值):
◆ mTOR抑制剂:可抑制TSC基因功能丧失或其他原因导致的mTOR复合物异常激活,从而抑制LAM细胞的异常增殖。一线治疗为西罗莫司,常以小剂量开始给药,检测血药浓度调整剂量,目标谷浓度为小于等于10ng/mL [9]。西罗莫司是一种抑制性治疗而非治愈性治疗,其可减缓LAM患者肺功能下降速度,因此如患者可耐受则应持续用药,停药后病情进展将恢复原有速度。但是,并非所有LAM患者对西罗莫司的反应均良好,研究发现VEGF-D水平较高的患者对药物反应更佳 [10]。不耐受西罗莫司副作用的患者可换用更短效的mTOR抑制剂依维莫司(二线治疗),其疗效可能与西罗莫司相似。
◆ 多西环素:可抑制基质金属蛋白酶(matrix metalloproteinases, MMPs),后者是参与LAM发病的因子之一。有关多西环素的疗效目前均为小样本研究,一些肺功能轻度受损的患者可能从治疗中获益,但整体而言多西环素对于LAM的疗效并不满意,ATS/JRS 2016版指南不推荐使用 [11]。
难治或终末期患者:
肺移植:对于足量长程应用mTOR抑制剂仍存在肺功能进行性加重的患者,肺移植是唯一有效治疗手段。在最大型的病例系列研究中(45例双侧移植,34例单侧移植),30日死亡率为5%,1年时存活率为86%,3年时为76%,5年时为65% [12]。
LAM的自然预后
未经治疗者FEV1每年大约下降40~150mL,随着时间的延长病情进展可能加速 [13]。LAM患者的中位生存时间各大研究差异较大,西方发达国家的中位生存时间为10~20年 [14],我国尚无大型研究给出明确预后数据。
参考文献
[1] The LAM Foundation. https://www.thelamfoundation.org/Newly-Diagnosed/Learning-About-Lam/About-LAM.
[2] Moss J, Avila N, Barnes P, et al. Prevalence and Clinical Characteristics of, Lymphangioleiomyomatosis (LAM) in Patients with Tuberous Sclerosis Complex[J]. Am J Respir Crit Care Med, 2001, 164(4):669-71.
[3] Meraj R, Wikenheiserbrokamp K A, Young L R, et al. Lymphangioleiomyomatosis: New Concepts in Pathogenesis, Diagnosis, and Treatment[C]// Seminars in respiratory and critical care medicine. Semin Respir Crit Care Med, 2012:486-97.
[4] Ryu JH, Moss J, Beck GJ, et al. The NHLBI lymphangioleiomyomatosis registry: characteristics of 230 patients at enrollment[J]. American Journal of Respiratory and Critical Care Medicine, 2006, 173(1):105-11.
[5] Henske E P, Jóźwiak S, Kingswood J C, et al. Tuberous sclerosis complex[J]. Nature Reviews Disease Primers, 2016, 2:16035.
[6] Glasgow C, Avila N J, Stylianou M, et al. Serum vascular endothelial growth factor-D levels in patients with lymphangioleiomyomatosis reflect lymphatic involvement[J]. Chest, 2009, 135(5):1293-300.
[7] UpToDate: Algorithm for the diagnosis of lymphangioleiomyomatosis.
[8] Angelo M. Taveiradasilva, Carolyn Hedin, Mario P. Stylianou, et al. Reversible airflow obstruction, proliferation of abnormal smooth muscle cells, and impairment of gas exchange as predictors of outcome in lymphangioleiomyomatosis.[J]. Am J Respir Crit Care Med, 2001, 164(6):1072-6.
[9] Karbowniczek M. Efficacy and Safety of Sirolimus in Lymphangioleiomyomatosis[J]. New England Journal of Medicine, 2011, 364(17):1595-606.
[10] Young L, Lee H S, Inoue Y, et al. Serum VEGF-D a concentration as a biomarker of lymphangioleiomyomatosis severity and treatment response: a prospective analysis of the Multicenter International Lymphangioleiomyomatosis Efficacy of Sirolimus (MILES) trial[J]. Lancet Respiratory Medicine, 2013, 1(6):445-52.
[11] Mccormack F X, Gupta N, Finlay G R, et al. Official American Thoracic Society/Japanese Respiratory Society Clinical Practice Guidelines: Lymphangioleiomyomatosis Diagnosis and Management[J]. American Journal of Respiratory & Critical Care Medicine, 2016, 194(6):748-61.
[12] Boehler A, Speich R, Russi E W, et al. Lung transplantation for lymphangioleiomyomatosis[J]. N Engl J Med, 2004, 23(3):301-8.
[13] Hayashida M, Yasuo M, Hanaoka M, et al. Reductions in pulmonary function detected in patients with lymphangioleiomyomatosis: An analysis of the Japanese National Research Project on Intractable Diseases database[J]. Respir Investig, 2016, 54(3):193-200.
[14] Oprescu N, Mccormack F X, Byrnes S, et al. Clinical predictors of mortality and cause of death in lymphangioleiomyomatosis: a population-based registry[J]. Lung, 2013, 191(1):35-42.
作者介绍



