病历摘要
患者男,42岁,个体经营户,主因「胸闷1个月,咳嗽、咳痰10 d」于2020年7月10日入院。患者1个月前无明显诱因出现胸闷,位于左胸前,伴气促,深呼吸后好转,无胸痛、咯血,无发热,无夜间盗汗。10 d前出现咳嗽,咳少许白痰,就诊当地医院。查胸部CT示双肺弥漫性病变,轻度脂肪肝。予「头孢他啶、莫西沙星」抗感染、「氨溴索」化痰等治疗,症状好转。为进一步明确肺部病变性质转诊我院。自发病以来体重无明显变化。既往确诊「2型糖尿病」10 d。吸烟20年,每日2包,未戒烟。无酗酒史。家族中无类似及肿瘤疾病者。
入院查体:体温36.2 ℃,脉搏61次/min,呼吸频率20次/min,血压123/66 mm Hg(1 mm Hg=0.133 kPa),神志清楚,锁骨上等浅表淋巴结未触及,口唇无发绀,胸廓未见异常,双肺呼吸音清晰,双侧肺未闻及啰音。心律齐,P2<a2,各瓣膜听诊区未闻及杂音。腹软,无压痛、反跳痛,腹部无包块。无杵状指(趾),双下肢无浮肿。
实验室检查和辅助检查:血白细胞计数6.2×10^9/L,中性粒细胞百分比56%,血红蛋白159 g/L。尿常规:尿糖(+++),便常规正常。血生化正常。降钙素原<0.25 μg/L,C反应蛋白7.66 mg/L,红细胞沉降率13 mm/1 h。肿瘤标志物:癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、细胞角蛋白19片段(CYFRA21-1)、鳞状细胞癌抗原(SCC)均正常。结核感染T细胞干扰素释放试验阴性。G试验、GM试验均正常。抗核抗体、抗双链DNA抗体、抗可提取核抗原抗体均阴性。HIV抗体阴性。糖化血红蛋白(HbA1c)6.7%。肺功能:通气功能正常,最大通气量(MVV)正常;支气管舒张试验阴性。胸部CT平扫+增强:双肺多发结节影,考虑转移瘤可能。部分胸椎骨质密度增浓,成骨转移可能(图1)。全身正电子发射断层显像/X线计算机体层成像仪(PET/CT):双肺多发结节影,部分代谢增高(最大SUV约5.7),左肺上叶尖后段肺癌伴肺内多发转移可能(图2),特殊感染不能排除;双侧颈部、纵隔内多发小结节影,代谢未见增高,考虑淋巴结慢性炎性增生;脂肪肝;右侧第7后肋近肋头骨质改变,代谢未见增高,考虑骨软骨瘤可能。进一步行气管镜检查,镜下示各叶段支气管黏膜未见异常。肺泡灌洗液细胞学分类:中性分叶核百分比10%,淋巴细胞百分比7%,嗜酸性粒细胞百分比5%,巨噬细胞百分比78%,吞噬含铁血黄素,未查见恶性细胞。肺泡灌洗液宏基因组二代测序:鲍曼不动杆菌(序列数15),铜绿假单胞菌(序列数3)。
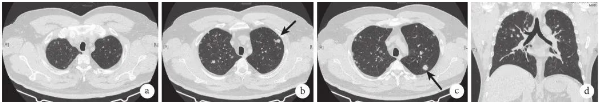
图1 2020年7月13日胸部CT检查像
a.双上肺多发结节,部分结节空化成气囊腔;b.双上肺多发结节,随机分布(黑箭);c.双上肺多发结节,其中左上肺尖后段结节最大径1.5 cm,见毛刺征(黑箭);d.双上、中肺多发结节,肋膈角未受累。
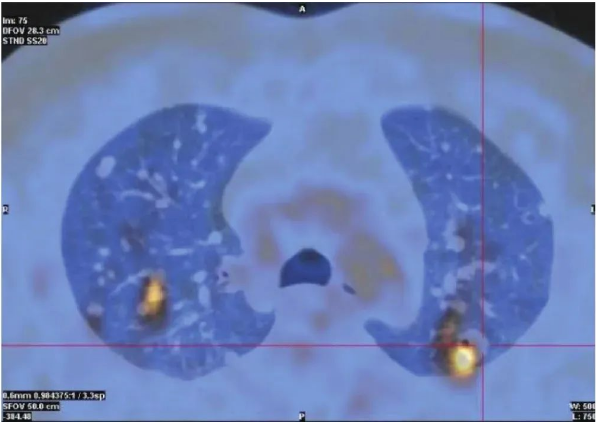
图2 2020年7月16日全身PET/CT检查像
双上肺多发结节,左上肺尖后段结节高代谢,SUV值5.7。
多科讨论
李兰凤(呼吸与危重症医学科):概括病例特点。(1)中年男性,亚急性起病,主要症状为胸闷、咳嗽、咳痰,无发热。(2)本次发病住院期间发现糖尿病,有吸烟史,吸烟指数40包年。(3)体检无阳性体征。(4)实验室检查血象及炎症指标正常,肿瘤标志物无异常。(5)胸部CT及全身PET/CT提示双肺多发结节伴部分气囊腔类似空洞样结节,考虑转移瘤可能,纵隔及肺门淋巴结无肿大。
本例患者关键问题在于双肺多发结节的鉴别诊断,临床上对于肺内直径≥3 cm的圆形病灶称为肿块,直径<1 cm的圆形致密影称为小结节,而直径介于1~3 cm之间称为大结节,本例患者肺内最大的结节直径为1.5 cm,其余大部分结节均小于1 cm,因此主要为小结节病变。根据结节性质的良恶性及疾病种类分析,主要考虑感染性疾病、非感染性疾病(肿瘤及非肿瘤),感染性疾病需注意血源性肺脓肿、肺结核、肺真菌病、寄生虫感染等。本例患者有糖尿病基础,因此需首先排除感染性疾病。血源性肺脓肿常有发热等全身毒性症状,且病灶位于两肺胸膜下,病灶内可见低密度坏死区,并有厚壁脓腔,脓腔内可有液平出现,该患者临床表现及影像特点不支持。而慢性肺脓肿的病原体如放线菌、诺卡菌等常导致肺内病灶也有低密度坏死区。肺结核多有午后低热、盗汗、食欲减退等全身症状,肺内病灶主要沿支气管播散,常有「树芽征」及薄壁空洞,本例患者无结核中毒症状,肺内病灶虽主要位于上叶,未见「树芽征」及卫星灶改变,结核菌感染T细胞斑点试验阴性,不支持本病。肺真菌病常见有隐球菌、曲霉、组织胞浆菌、球孢子菌等,患者无免疫抑制基础,且未前往相关地方病流行区,血隐球菌荚膜抗原试验阴性,不支持真菌感染。患者否认有生食史,外周血嗜酸性粒细胞正常,不支持寄生虫感染。另外该患者肺泡灌洗液二代测序未检出有意义致病菌,因此不支持感染性疾病。结合本例患者肺CT增强扫描及PET/CT,非感染性疾病中需高度排除肺癌伴肺内转移可能,左上叶尖后段结节见毛刺征,SUV值5.7,进一步行经皮肺穿刺活检明确诊断。另外非感染性疾病中还需要排除淋巴瘤、韦格纳肉芽肿、类风湿结节、淀粉样变性、矽肺等,患者PET/CT未见淋巴结肿大及骨骼高代谢,自身免疫全套阴性,无职业粉尘接触史,目前证据不足。
姚秀娟(呼吸与危重症医学科):临床上对于肺内多发结节的鉴别可根据结节的边界、衰减、特征性解剖分布进行。结节的解剖学分布或位置在鉴别诊断中更具有价值,如弥漫与局灶或成簇分布、中心与外周分布、上叶与下叶分布,最重要的是根据结节与次级小叶的解剖关系分为淋巴管周围分布、随机分布、小叶中心性分布。依据胸膜或裂周有无结节来区分:(1)胸膜或裂周有结节为淋巴管周围结节或随机结节:淋巴管周围分布结节表现为结节成簇地沿胸膜下或支气管血管束分布,最常见于结节病、矽肺、癌或淋巴瘤淋巴管播散、淋巴细胞间质性肺炎、淀粉样变性等;随机结节表现为结节弥漫性非簇状分布,常见于血行转移性疾病,由于优势血流流向肺底,故结节常以肺底分布为主。另粟粒性肺结核或真菌感染也可呈随机弥漫分布结节。(2)胸膜或裂周无结节则为小叶中心性结节,常见于细支气管疾病、过敏性肺炎、朗格汉斯细胞组织细胞增生症(LCH)(早期)等。本例患者胸膜有结节,非簇状分布,故为随机分布结节,需考虑肺癌伴肺内转移、肺结核、肺真菌感染,但结节以上叶分布为主,不支持肺癌血行转移特点。患者无明显结核中毒症状,且结核相关实验室检查不支持。
洪如钧(呼吸与危重症医学科):患者气管镜检查提示镜下未见异常,肺泡灌洗液细胞学分类提示嗜酸细胞及中性粒细胞升高,未检出有意义的病原,经支气管肺活检病理无特异性改变,阅片提示患者左上肺尖后段结节靠近胸膜,予以CT引导下经皮肺穿刺活检,病理提示(左上肺):送检肺穿刺活检标本,结合形态学及免疫组织化学检查,符合朗格汉斯组织细胞增生症。免疫组织化学检查示:Ki67(7%+),S-100(+++),Langerin(+++),CD1α(+++),CD68(++)(图3)。进一步完善垂体核磁共振增强扫描未见异常,故最终诊断肺朗格汉斯细胞组织细胞增生症(PLCH)。
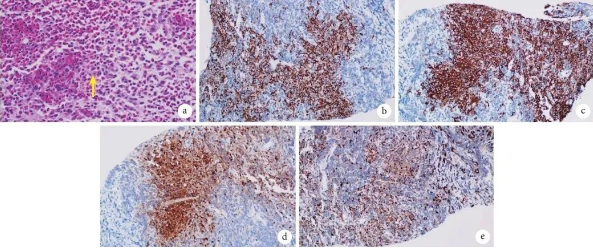
图3 经皮肺穿刺活检组织病理检查像
a.多量的朗格汉斯细胞增生,可见核沟(黄箭),伴有数量不等的嗜酸性粒细胞、淋巴细胞(HE×400);b.Langerin强阳性(免疫组织化学×200);c.CD1α强阳性(免疫组织化学×200);d.S-100强阳性(免疫组织化学×200);e.CD68阳性(免疫组织化学×200)。
何毅辉(病理科):本例患者活检标本光镜下可见多量的朗格汉斯细胞增生,高倍镜下可见核沟,伴有数量不等的嗜酸性粒细胞、淋巴细胞、泡沫样组织细胞和多核巨细胞,进一步行免疫组织化学染色显示S-100蛋白、CD1α、CD68均为阳性表达,其中CD1α特异性最高,因此符合PLCH。根据病情发展,病理改变可分为3期。(1)富细胞期:主要表现为大量朗格汉斯细胞构成的肉芽肿,并可见嗜酸粒细胞、淋巴细胞、浆细胞及少量中性粒细胞浸润;(2)增生期:肺泡内可见大量的巨噬细胞及慢性炎症细胞,同时伴有肺上皮细胞的增生,朗格汉斯细胞数量减少,开始出现肺间质纤维化;(3)纤维化期:朗格汉斯细胞消失,纤维细胞增多,出现肺大疱、蜂窝肺甚至肺纤维化[1]。另有研究对67例PLCH患者进行了基因检测,发现BRAF V600E的总体突变率为22.4%[2]。本例患者处于富细胞期,进一步行基因检测,结果显示BRAF V600E未发生突变。
谢宝松(呼吸与危重症医学科):LCH是由病变中骨髓前体的克隆性扩张,分化为CD1α+/CD207+ 细胞,导致一系列器官侵犯和功能障碍[3]。它以前被认为是一种儿童疾病,但现在认为经常出现在成年。LCH可影响一个或多个器官。如果只涉及一个器官或系统,则称为单系统(single-system)LCH(SS-LCH),预后最好。如果涉及2个或2个以上的器官或系统,则称为多系统(multisystem)LCH(MS-LCH)。然后根据诊断时是否有「危险器官」受到影响(造血系统、肝脏和/或脾脏)以及对标准治疗方案的初始反应,将MS-LCH分为低风险、高风险和非常高风险[4]。常见受累器官有内分泌腺(占50%~70%)、骨骼(60%)、呼吸系统(50%~60%)、皮肤(15%~30%)、淋巴结(5%~10%)、神经系统(5%)[5],脾脏、肝脏或骨髓的弥漫性浸润或局灶性病变是最严重的表现,被定义为「高危」,最常见于2岁以下的婴儿[4]。本例患者结合全身PET/CT及垂体核磁共振结果,考虑为单系统LCH即PLCH。孤立性PLCH主要是年轻吸烟者的一种疾病,超过90%的患者承认有吸烟史[6]。呼吸道症状主要表现为咳嗽及活动后呼吸困难、胸闷、胸痛等。典型的高分辨率CT表现为肺上部和中部的小结节、空泡结节、厚壁和薄壁囊肿为主,基底部相对较少。病灶为局灶性,有明显正常的实质分隔,可累及肺野的周围和中心部分。结节一般多发,多为两肺对称分布的小叶中心性结节,直径一般≤1 cm,随着病变的发展,结节体积会逐渐增大。而后结节逐步空化,囊性病变成为主要的发现。囊肿大小不一,可合并成不规则形状(奇异的囊肿)。明显增大的纵隔淋巴结是罕见的,应考虑其他诊断。肺动脉增大提示肺动脉高压[7-8]。氟脱氧葡萄糖正电子发射断层扫描可作为一种放射性标志物。氟脱氧葡萄糖被朗格汉斯细胞吸收和代谢,从而增强对不同器官组织细胞病变的识别。虽然这项技术对肺部病变既不敏感也不特异,因肺结节可为高代谢,无法与恶性疾病区分。但它在检测多系统LCH和评估骨骼病变方面特别有用[9]。本例患者主要以双上肺结节为主,非小叶中心性分布,少部分结节空化成规则的薄壁囊肿,全身PET/CT提示部分结节呈高代谢,初步考虑肺恶性肿瘤可能,以致于早期误诊为肺癌伴双肺转移。
李瑞慧(呼吸与危重症医学科):目前由于对LCH发病机制的认识不足,因此有效治疗LCH存在困难。根据疾病的程度和器官功能障碍的程度将患者分成不同的危险类别。局限于单一部位的单系统疾病患者通常只需要局部治疗或观察,而病变较广的患者则需要全身治疗。对于PLCH,戒烟可能是唯一需要的治疗;如果戒烟失败,皮质类固醇是主要的治疗。化疗可用于对类固醇无反应的进展性疾病,如长春碱、甲氨蝶呤、环磷酰胺、依托泊苷、克拉屈滨,但治疗效果不确定。对于复发性气胸应考虑胸膜固定术。晚期疾病可考虑肺移植[4]。另有研究显示BRAF抑制剂对于活检证实为BRAF V600E-LCH成人患者有效[10]。本例患者单系统肺受累,有吸烟史,肺功能检查提示肺通气功能及弥散功能均正常,因此劝导严格戒烟,未使用其他药物,3个月后复查胸部CT提示双肺结节及囊腔明显吸收(图4)。
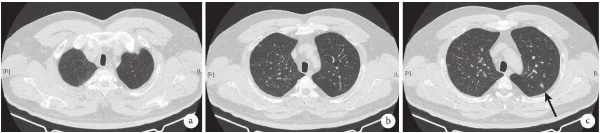
图4 2020年10月14日胸部CT检查像
a.双上肺多发结节较3个月前明显吸收;b.双上肺多发结节较前明显吸收、缩小;c.左上肺尖后段结节明显缩小(黑箭)。
专家点评
谢宝松(呼吸与危重症医学科):回顾本病例的特点,中年男性,因胸闷伴咳嗽求诊,胸部影像学表现为双肺多发结节伴部分囊腔,血液相关检查未发现异常,主要以肺内多发结节为切入点进行鉴别。而进一步增强扫描及全身PET/CT检查初诊均考虑肺癌伴肺内转移,临床评估左下肺结节有短毛刺征,SUV也增高,故坠入了肺肿瘤的误区。经过肺穿刺活检病理发现为PLCH。该病为呼吸系统罕见病,从本病例的诊治中吸取了不少经验和教训。首先患者肺内结节以上肺分布为主,不符合肺内转移癌的分布特点。其次本例虽为PLCH,但影像不典型,肺内结节并非小叶中心性分布,气囊形成少,且规则,无其他系统受累表现,可能系处于病程早期改变。因此,对于肺内多发结节的鉴别,尤其需要仔细观察其形态学及分布特点,不轻易妄下诊断,尽快获取组织活检病理以明确。
利益冲突:本研究不涉及任何利益冲突。
参考文献略。
引用本文:姚秀娟, 李兰凤, 洪如钧, 何毅辉, 谢宝松. 双肺多发结节伴囊腔影. 中国呼吸与危重监护杂志, 2021, 20(11): 817-820. doi: 10.7507/1671-6205.202101036
本文转载自公众号「中国呼吸与危重监护杂志」
原链接戳:双肺多发结节伴囊腔影


