背景
慢性阻塞性肺疾病(慢阻肺)是一种可以预防和治疗的常见病,其特征是持续存在的呼吸道症状和气流受限。最新的大型流行病学调查显示,慢阻肺已成为与高血压、糖尿病等量齐观的疾病,由于其高致死率及致残率,构成了重大的疾病负担。慢阻肺患者存在多种危险因素,易合并真菌定植或感染,影响预后。
1、慢阻肺与真菌
2017年Respirology杂志发表的综述指出,真菌定植及感染在慢阻肺患者中并不少见,临床意义尚不明确,可能被低估。
> 气道局部的微生态对于慢阻肺有重要作用,包括细菌真菌及病毒。
> 慢阻肺患者急性加重期曲霉菌分离率可高达16.6%,随访期仍可达14.4%。在一项观察性研究中,曲霉菌分离的增加可能引起近一年的慢阻肺急性加重频率增高。痰液曲霉菌培养阳性与中性粒细胞计数增高相关。
> 香烟烟雾可增加白色念珠菌的生长、粘附及免疫刺激活性,导致口腔念珠菌患病率升高。

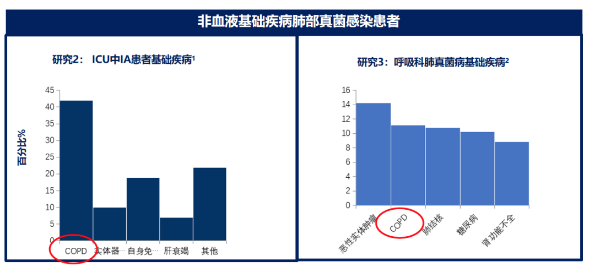
侵袭性真菌病患者中慢阻肺人群比例较高
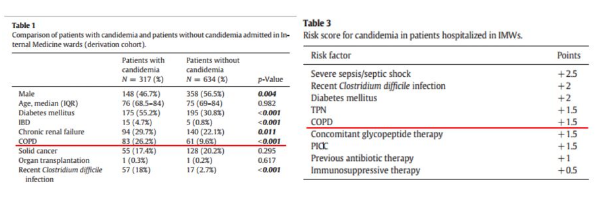
研究1:一项早期的流行病学调查涵盖全美1000多家医疗机构,11,881例IFI患者。其中,最易发生IFI的患者群体前三位是患有COPD、糖尿病、恶性血液病的患者。

研究2:ICU中侵袭性真菌病患者的基础疾病分布提示,在非血液恶性肿瘤合并侵袭性曲霉菌病患者中,COPD是最常见的基础疾病,其余包括实体器官移植、自身免疫系统疾病(化疗)、肝脏衰竭以及其他多种基础疾病。
研究3:中国一项历时10年(1997-2008),在16个研究中心进行的肺部真菌流行病学回顾性调查显示,除血液恶性肿瘤患者外,其他最常见的基础疾病为实体肿瘤(14%)、COPD(11%)、肺结核(10%)以及糖尿病(10%)。
2、慢阻肺合并真菌感染的危险因素
> 国内研究指出,慢阻肺合并侵袭性肺部真菌感染时存在免疫受损;
> 营养障碍增加了慢阻肺患者的感染风险;
> 单因素分析显示年龄、住院时间、血浆白蛋白、激素疗程、抗生素种类和疗程,侵袭性诊疗操作均为AECOPD继发真菌感染的相关危险因素。

一旦患者分泌物培养出真菌,要努力区分定植还是感染
定植是指微生物在人体特定部位定居,并依靠人体提供营养物质不断生长、繁殖后代,最大的特点是「多数不引起机体应答反应」。
感染时,机体会出现相应的表现,包括临床症状和实验室指标的变化,如发热、呼吸道症状恶化、影像学进展、感染指标异常……
> 定植是病原体携带的一种形式,也可以是病原体传播的潜在来源
> 微生物与宿主的相互作用决定其临床表型
> 鉴别定植与感染需要全面分析
慢阻肺合并真菌定植或感染
常见菌种:念珠菌、曲霉菌
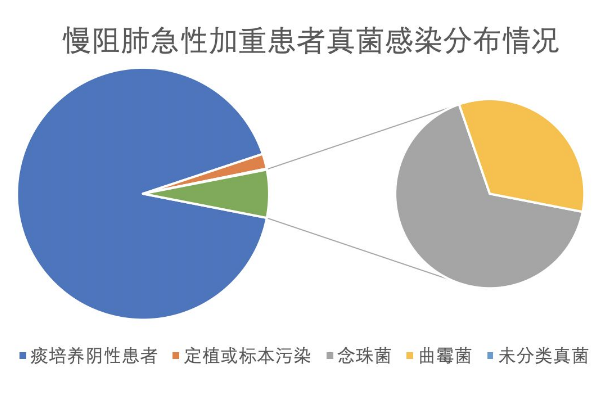
1、一项回顾性研究纳入了2014年1-12月四川省人民医院呼吸与危重症医学科的112例慢性阻塞性肺疾病、肺源性心脏病患者,培养出念珠菌106株,烟曲霉菌7株,其中45株引起感染(39.82%,念珠菌43株,曲霉菌2株),68株为定植(60. 18%,念珠菌63株,曲霉菌5株)。

2、本课题组回顾性分析了2016年1月~2017年12月于中南大学湘雅二医院呼吸与危重症医学科因慢性阻塞性肺疾病急性加重而住院的患者830例,痰培养真菌阳性66例,其中临床诊断真菌感染50例,定植或标本污染16例,共培养出52株病原体(34株念珠菌、17株曲霉菌、1株未分类真菌)。
一、慢阻肺与念珠菌
慢阻肺患者肺部结构及功能的病理改变,防御能力下降,且大多存在香烟烟雾或其他环境刺激物的暴露史,合并以下危险因素时,易继发念珠菌定植或感染。

念珠菌可在健康人群中少量定植,而住院患者念珠菌定植率可高达80%;呼吸道定植最为常见,以白念珠菌感染为主。

一项为期4年的研究,纳入6个中心的803例患者,其中214例(26.6%)存在呼吸道念珠菌定植。定植菌检出率最多为白念珠菌(68.7%),其次是光滑念珠菌(20.1%)和热带念珠菌(13.1%)。
1、慢阻肺与念珠菌定植
2016年,IDSA在指南中认为:自呼吸道分泌物分离的念珠菌通常为定植菌,很少需要抗真菌治疗(强推荐;证据级别中)。

然而,念珠菌定植和临床感染是否有关?——可进展为侵袭性念珠菌病
一项早期的随机、双盲、安慰剂对照研究,共纳入182例患者,均在ICU住院≥3天,随机接受氟康唑或安慰剂治疗,收集不同部位标本进行真菌培养,观察其发展为侵袭性念珠菌病的情况。

结论:ICU念珠菌定植患者进展成侵袭性念珠菌病的百分比显著高于非念珠菌定植患者。
是否需要对发生念珠菌定植的患者进行处理?——对定植患者抗真菌治疗可降低真菌感染发生率
一项前瞻性、随机、双盲、安慰剂对照研究,纳入接受机械通气治疗至少2h患者204例,其中98例存在念珠菌定植,随机将患者分为两组,分别给予氟康唑100mg/日或安慰剂治疗,观察两组患者念珠菌感染情况。
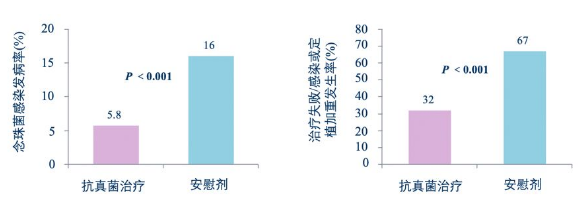
结论:对存在念珠菌定植患者进行抗真菌治疗组患者念珠菌感染发病率显著低于安慰剂组。
去定植治疗是否会改善患者预后?——可改善机械通气患者VAP的发生率
一项研究回顾性分析2012年7月至2016年6月期间,入住浙江大学医学院附属邵逸夫医院重症监护病房(ICU)的下呼吸道分泌物培养到念珠菌的危重机械通气患者,分为抗真菌治疗组和未进行抗真菌治疗的对照组。
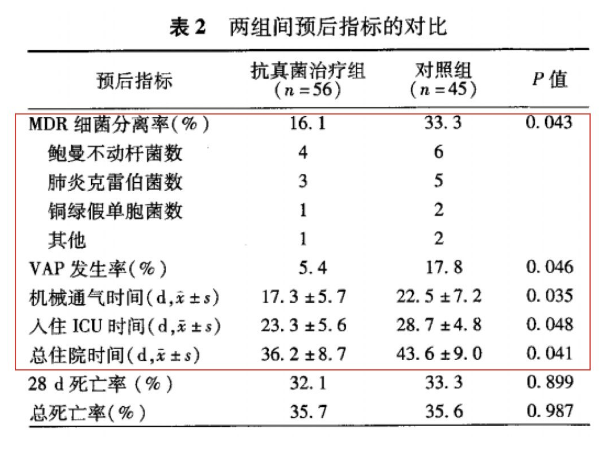
结论:下呼吸道分泌物培养到念珠菌的危重机械通气患者进行抗真菌治疗,可以减少MDR细菌的分离率和VAP的发生率,并缩短机械通气时间、入住ICU时间和总住院时间。
因此,虽然呼吸道分泌物分离出的念珠菌通常为定植菌,但适当的干预可使重症患者明显获益。
2、慢阻肺合并念珠菌感染
念珠菌属是人体正常菌群之一,定植于人体与外界相通的各个器官。内源性感染是念珠菌主要的感染途径,在慢阻肺患者中,已报道的病例主要包括口咽部、呼吸道、消化道及血液感染。
其中,口腔念珠菌病依据典型临床表现及涂片检查即可诊断;肺念珠菌病应从宿主因素、临床表现、微生物学三方面综合考虑;食管念珠菌病确诊需依据内镜活检病理证实;念珠菌血症的诊断有赖于血培养念珠菌属阳性,同时患者需有相应的临床症状和体征。
① 慢阻肺是念珠菌感染的危险因素
慢阻肺是念珠菌食管炎的危险因素:一项关于65岁以上人群念珠菌食管炎的病例-对照研究,对56例通过内镜取活检标本确诊的食管念珠菌病患者和56名对照进行分析。念珠菌食管炎患者慢阻肺患病率显著高于对照组(39.3% vs. 12.5%)。
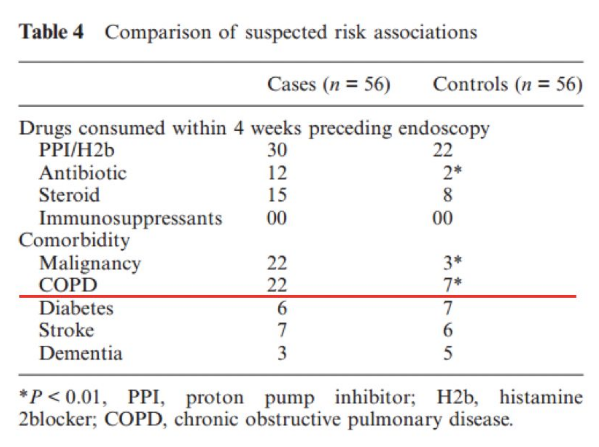
慢阻肺是念珠菌血症的危险因素:意大利的一项多中心病例-对照研究,根据年龄、入院时间和住院时间,将出现念珠菌(病例)的患者与无念珠菌(对照组)的患者进行比较。通过logistic回归分析确定了念珠菌的风险因素,并建立了新的风险评分,得分>3分为念珠菌血症高风险。
慢阻肺患者容易出现口腔念珠菌感染?——慢阻肺及其药物影响口腔健康状况
一项横断面病例-对照研究,评估和比较慢阻肺患者与对照组之间龋齿、缺牙和补牙(DMFT),口腔卫生指数简(OHI-S),牙周病指数(PDI)评分,以及念珠菌的存在(菌落数) [CFU]),反映两组口腔健康状况的差异。结果显示6个月以上慢阻肺药物治疗(主要为LABA+ICS)的患者口腔健康状况较正常对照组差,念珠菌菌落数显著升高。

② 慢阻肺合并口腔念珠菌感染
鹅口疮是口腔念珠菌感染的重要体征
一项观察性队列研究对13647例使用ICS治疗的慢阻肺患者及9161例非ICS治疗的慢阻肺患者进行分析,结果表明ICS治疗可增加慢阻肺患者鹅口疮的发生率。
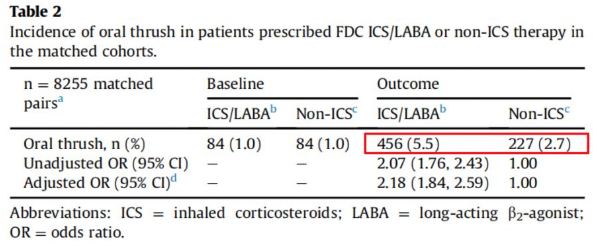
慢阻肺合并口腔念珠菌感染与ICS相关,鹅口疮的发生率随ICS使用剂量而增加

对于拟诊为慢阻肺合并念珠菌感染的患者,口腔粘膜白斑是指导临床治疗的重要体征
本课题组回顾性分析2016年1月~2017年12月我科因慢性阻塞性肺疾病急性加重住院患者830例,将临床诊断的50例慢阻肺合并真菌感染的患者依据感染菌种进行分组,再依据是否接受抗真菌治疗进行亚组分析。

慢阻肺患者使用糖皮质激素治疗可以增加口腔念珠菌感染的风险,主要表现为口腔黏膜白斑。本研究中接受抗真菌治疗的合并念珠菌感染患者与未接受治疗者相比口腔黏膜多伴有白斑,这与以往的研究相符。
③ 慢阻肺合并食道念珠菌感染
慢阻肺合并食管念珠菌感染与ICS相关
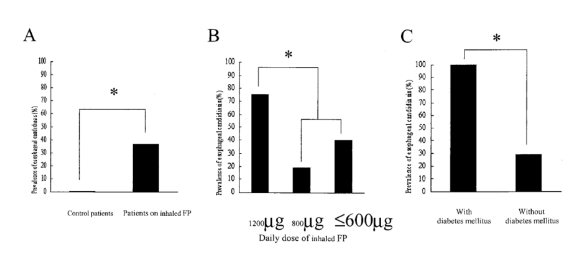
一项研究纳入了49例使用ICS治疗的患者及700例健康对照,研究食管念珠菌病的发病情况,ICS组发病率(37%)显著高于对照组(0.3%),且合并糖尿病的患者感染率显著高于非糖尿病患者。
食管镜下可见类似口腔念珠菌病的白色斑块:

PAS染色可见假菌丝和囊胚侵入食管粘膜:
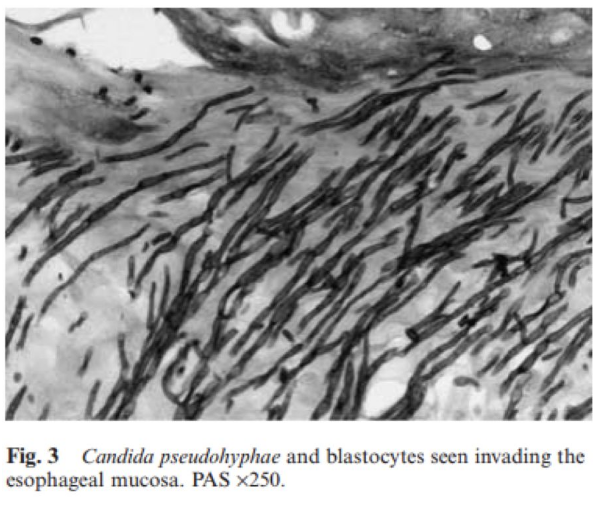
④ 慢阻肺合并肺念珠菌感染
慢阻肺合并肺念珠菌感染确诊率低,国外仅有少量病例报道,国内研究以临床诊断为主。这是国外的一例典型病例:


66岁男性患者,诊断慢阻肺5年,长期吸入福莫特罗、异丙托溴铵。
因咳嗽、咳痰、痰中带血,呼吸困难加重入院。
体查:SpO2 89%。
诊断为光滑念珠菌肺炎,伏立康唑治疗后患者症状改善,复查CT有明显好转。
治疗关键在于控制感染源及早期有效的抗真菌治疗;综合考虑感染部位、菌种、宿主因素以及药物特点, 选用优化给药方案。

•对于确诊肺念珠菌病的患者,应尽快进行抗真菌治疗;
•非中性粒细胞减少患者:首选氟康唑或棘白菌素类药物;
•中性粒细胞减少患者:首选棘白菌素类或伏立康唑 ;
•联合用药:对高度怀疑肺念珠菌病且病情严重的患者是否可以采用不同作用机制的抗真菌药物联合治疗;
•疗程:应持续至症状消失,或支气管分泌物真菌培养连续2次阴性,或者肺部病灶大部分吸收、空洞闭合。
慢阻肺患者口腔护理可有效降低ICS相关口腔念珠菌病
一项基于中国人群吸入激素(ICS)相关口腔念珠菌病的Meta分析指出,积极护理可显著降低ICS相关口腔念珠菌病,使用药物或碳酸氢钠进行漱口或口腔护理有效率高于生理盐水或清水。
二、慢阻肺与曲霉菌
1、慢阻肺合并曲霉菌定植

在COPD合并IPA诊断标准中,对于定植是有明确概念的:慢阻肺患者采自下呼吸道样本曲霉菌培养阳性,但无呼吸困难急性加重、气道痉挛或新发肺部浸润。
曲霉菌定植在慢阻肺患者中较常见
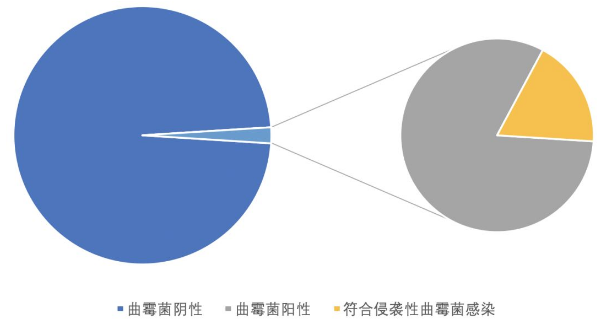
马德里教学医院的一项回顾性研究纳入了14618例慢阻肺患者,239 例患者下呼吸道标本中分离出曲霉菌,检出率为16.3/1000例,其中53例(22.2%)符合IPA的拟诊标准(3.6/1000例)。可见致病的比例是相当低的。
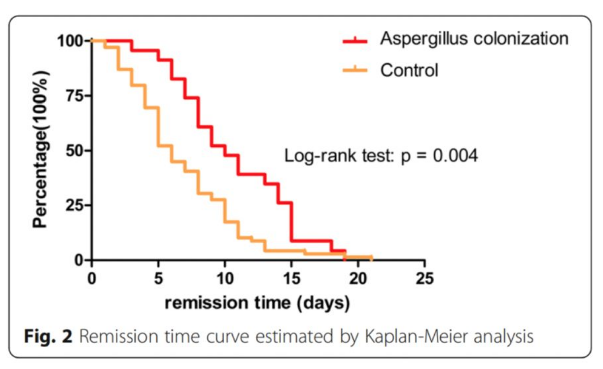
曲霉菌定植患者使用糖皮质激素剂量更大,治疗时间更长
一项回顾性研究纳入了慢阻肺急性加重患者中23例曲霉菌定植患者及69例患者并进行配对分析。使用糖皮质激素是慢阻肺患者曲霉菌定植的危险因素。

2、慢阻肺合并侵袭性曲霉菌病
慢阻肺是IPA的中危因素

慢阻肺合并侵袭性曲霉菌病发生率高
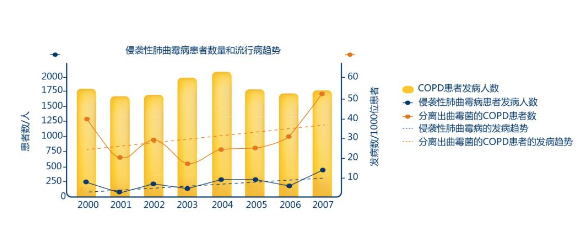
一项针对2000年1月—2007年12月239位诊断为COPD并获得下呼吸道曲霉培养阳性患者的回顾性研究发现,COPD患者的侵袭性肺曲霉病(IPA)发病率由2000年的7例/1000住院患者上升到2007年的13例/1000住院患者。
Thorax的一项研究显示,慢阻肺患者常合并侵袭性肺曲霉病
IPA的最大人群来自慢阻肺,住院的慢阻肺病人中,1.3-3.9%出现培养阳性的IPA;曲霉培养敏感性低,慢阻肺合并曲霉的实际发病率更高。慢阻肺合并IPA的病死率较高,未治疗的IPA死亡率高。延迟诊断IPA预后差。

COPD合并IPA诊断标准是比较明确的
确诊IPA:
从3个月内新发的肺内病变由细针吸取或活检获得标本,经组织学或细胞学检查发现菌丝其形态与曲霉菌一致且有相关组织损害证据,并伴有下述任何一项:
1)采自下呼吸道样本曲霉菌培养阳性;
2)血清烟曲霉抗体/抗原检查阳性(包括沉淀素);
3)用分子学、免疫学和/或培养方法证实病理检查观察到的菌丝为曲霉菌菌丝。
拟诊IPA:
同确诊检查但除外1,2,3项或经常使用激素治疗的重度(Ⅲ级或Ⅳ级)COPD患者,近期出现呼吸困难急性加重,具有提示性肺部影像学改变(胸片或CT扫描,3个月内)以及下述一项检查:
1)采自下呼吸道样本曲霉菌培养和/或镜检阳性;
2)血清烟曲霉抗体检查阳性(包括沉淀素);
3)连续2份血清GM检查阳性。
疑诊IPA:
经常使用激素治疗的重度(Ⅲ级或Ⅳ级)COPD患者,近期出现呼吸困难急性加重,具有提示性肺部影像学改变(胸片或CT扫描,3个月内),但无下呼吸道样本曲霉菌培养或镜检或血清学检查阳性结果。
另外,COPD 合并 IPA 患者最显著的临床特征是抗生素抵抗的非特异性肺炎和呼吸困难的加重,且曲霉菌感染导致的喘息加重常在初始治疗获得临床好转后出现。

当激素依赖的重度或极重度COPD患者接受大剂量激素和广谱抗生素治疗时仍存在严重呼吸困难,尤其是胸部X线片出现新发病灶和(或)痰液检查发现曲霉菌者,应高度警惕IPA,需及时治疗。
慢阻肺合并IPA影像表现为空洞、胸腔积液、结节、实变、浸润影。
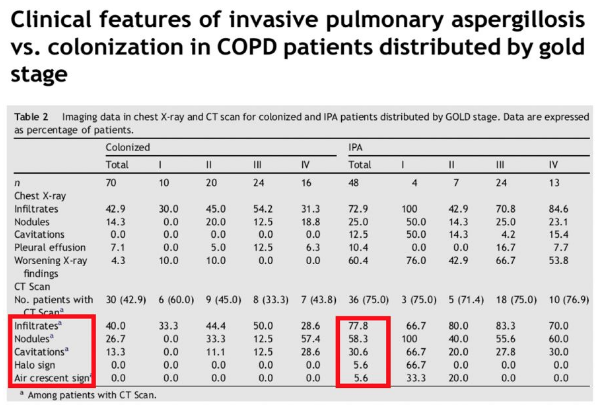
影像学特点缺乏特异性,以「气道侵袭性」为主。
3、慢阻肺合并IPA的病例分享
58岁男性患者,诊断慢阻肺3年。因反复咳嗽咳痰气促3年,再发加重伴咯血1+月入院。
体查:体温:36.0℃,脉搏:87次/分,呼吸:20次/分,血压:166/104mmHg;慢性病容,桶状胸,双侧呼吸动度对称,语颤无增强,双肺叩诊过清音,双肺呼吸音粗,右上肺少许干罗音,双肺未及胸膜摩擦音。
肺部CT:右上肺渗出

支气管镜:双肺支气管炎症改变,右上叶前支靠后亚分支见黄色脓栓,余1-4级支气管内可见少许脓性分泌物。

• 血象正常,ESR 70mm/h ↑, CRP 19mg/L↑ ,PCT 0.14ng/ml ↑,多次病原学检查、支气管灌洗液检查阴性。
• 病理:炎性支气管粘膜组织及肺组织,灶性肺泡上皮增生活跃,间质纤维增生及玻变,较多淋巴细胞、浆细胞混有粒细胞浸润,免疫荧检查真菌(+),PSA染色见个别可疑真菌菌丝,考虑真菌感染可能性大。
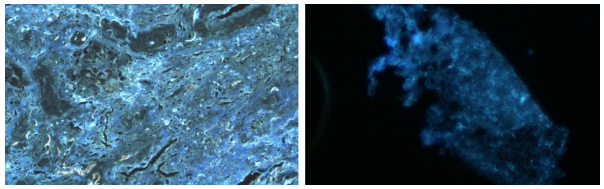
• 最终诊断:慢阻肺合并侵袭性肺曲霉病
• 予伏立康唑6mg/kg(首剂)4mg/kg静滴Q12H(维持)抗真菌以及止血对症治疗,患者好转出院序贯口服治疗。
4、慢阻肺合并IPA的治疗
慢阻肺合并IPA预后差,早诊断早治疗可改善预后。

由于慢阻肺合并IPA存在着早期诊断率低,死亡率高等特点,因此研究探索慢阻肺合并IPA 的诊治策略显得非常重要。
治疗参考IDSA2016曲霉菌病诊断治疗指南

1、推荐使用伏立康唑作为主要治疗用药(强烈推荐、证据级别高);
2、对于强烈怀疑IPA的患者,有必要在进行诊断性评估的同时,尽早开始抗真菌治疗(强烈推荐、证据级别高);
3、替代治疗用药包括两性霉素B脂质体(强烈推荐、证据级别中等)、艾沙康唑(强烈推荐、证据级别中等)或两性霉素B其他脂质制剂(较弱推荐、证据级别低);
4、对于确诊为IPA的患者,可考虑使用伏立康唑和棘白菌素联合抗真菌治疗(较弱推荐、证据级别中等);
5、不推荐棘白菌素作为初始治疗药物(强烈推荐、证据级别中等),但棘白菌素可用于对唑类及多烯类抗真菌药物存在禁忌证的患者(较弱推荐、证据级别中等);
6、IPA患者抗真菌治疗至少持续6~12周,疗程取决于疾病部位、免疫抑制的持续时间及疾病改善情况(强烈推荐、证据 级别低);
7、对于成功治疗的IPA且后续仍需维持免疫抑制状态者,应予二级预防治疗防止复发(强烈推荐、证据级别中等)。
慢阻肺合并曲霉菌感染的预防
预防原则:尽量减少甚至清除环境中的曲霉菌,减少 COPD 患者曲霉菌暴露的机会。
常用方法:包清除积灰、设立屏障、佩戴高效能面罩、避免接触植物、鲜花、装修、施工场地及避免园艺、施肥劳作等。
小结
> 慢阻肺患者存在多种危险因素,易合并真菌定植或感染,主要为念珠菌及曲霉菌。
> 慢阻肺患者合并念珠菌定植,在机体免疫力低下时,可引起宿主患病,感染部位多见于口咽部、食管及呼吸道。
> 慢阻肺是并发侵袭性曲霉菌病的高危因素,同时曲霉菌定植可加重局部的炎症反应,并增加内源性感染的风险。
> 慢阻肺患者真菌定植或感染,一方面会加重肺部炎症反应,另一方面,通过真菌与细菌的相互作用,可增加细菌感染的风险,进而延长治疗时间、导致不良预后,早期诊断及治疗可使患者获益。
参考文献
[1] GOLD2019
[2] The Lancet,2018.
[3] Respirology (2017) 22, 634–650
[4] Menzin J, Am J Health-Syst Pharm 2009; 66:1711-1717
[5] Am J Respir Crit Care Med Vol 170. pp 621–625, 2004
[6] 中国结核和呼吸病杂志.2011年2月34卷(2),p86-90
[7] 中国医药指南, 2013.
[8] 临床肺科杂志,2018.
[9] 中国老年学杂志,2010.
[10] 实用医院临床杂志, 2015.
[11] Mikrobiyol Bul, 2013.
[12] Chest, 2006.
[13] S.S.Maglll,et al.Dlagnostic Mlcroblology and infectious disease 55(2006):293-301.Intensive Care Med.2002.
[14] 中华医学杂志, 2017.
[15] Diseases of the Esophagus Official Journal of the International Society for Diseases of the Esophagus, 2006, 19(3):189-192.
[16] European Journal of Internal Medicine, 2017:33-38.
[17] Special Care in Dentistry, 2018.
[18] Incidence of oral thrush in patients with COPD prescribed inhaled
[19] corticosteroids: Effect of drug, dose, and device Respiratory Medicine 120 (2016) 54e63.
[20] Respiratory Medicine 120 (2016) 54e63.
[21] Diseases of the Esophagus Official Journal of the International Society for Diseases of the Esophagus, 2010.
[22] Case Reports in Infectious Diseases,2016.
[23]施毅, 刘又宁, 张波,等. 肺念珠菌病[J]. 中国感染与化疗杂志, 2011, 11(2):114-118.
[24]上海交通大学学报 医学版, 2015.
[25] Eur Respir J, 2007; 30: 782-800.
[26] Guinea J, et al. Clin Microbiol Infect, 2010, 16(7): 870-877.
[27] BMC Pulm Med,2018.
[28] curr opin infect dis 2014,27:174-183
[29] Meersseman. Clinical Infectious Diseases. 2007
[30] Pagano L, Haematologica/Hematol J, 2006;.
[31] Denning D W.Thorax, 2015, 70(7):613–614.
[32] Eur Respir J,2007.
[33]临床内科杂志, 2018.
[34] Barberan J, et al.Journal of infection, 2012, 65(5):447–452
专家介绍

陈燕
中南大学湘雅二医院呼吸与危重症医学科教授,主任医师,博士生导师;中华医学呼吸分会全国青年委员;中华医学会呼吸分会慢阻肺学组委员;中华医学会临床流行病学和循证医学分会循证医学学组副组长。


