引言
发热、痰中带血都是呼吸系统疾病的常见症状,但是患者却可以千差万别。这是一位起病隐匿、病情迁延的患者,病程中逐渐出现多系统受累,以肺部及垂体受累表现最为突出,累及部位极为罕见。面对易被忽略的症状和极易造成漏诊错诊的各种问题,团队如何结合看似不起眼的既往史,抽丝剥茧逐层分析的?我们也参考了部分文献作为提示,最终证实所考虑的疾病。该患者入院后诊断及时治疗效果佳,不足之处是早期未取得肾脏组织病理加以证实。但值得与同道分享的是整个探讨分析的过程,如何以一点窥一面,以一面揭全景?
两个月来患者多为日间发作连续性刺激样咳嗽,发热、痰血伴听力减退……两次复查情况反倒更加严重,诊治似乎陷入被动
这名56岁的女性患者是退休职员,于2018年5月入住我院呼吸科。主诉为「干咳2月,发热、痰血伴听力减退2周」。该患者于2018年2月无明显诱因下出现干咳,多于日间发作,呈连续性刺激样咳嗽。无胸痛、胸闷、发热等不适。至当地医院就诊,查胸部CT提示双肺散在絮状影(图1),予「莫西沙星」 抗感染治疗1周,症状有所改善,影像学未见明显变化(图2)。
2018年4月13日,患者遵医嘱返院复查胸部CT,但提示病灶依然较前相仿(图3)。4月14日出现畏寒、发热,Tmax38.9℃,咳嗽再次加重,并间断痰中带血丝,伴双侧听力急剧减退,先后予「头孢美唑+左氧氟沙星」、「哌拉西林他唑巴坦+莫西沙星」、「泰能+万古霉素+伏立康唑」 抗感染治疗。治疗后上述症状均无改善,体温反而逐渐升高。4月28日继续复查胸部CT,提示双肺多发病变较前明显进展(图4)。
持续高热疑窦从生……间质纤维组织增生、慢性炎细胞浸润提示炎症性改变,可PAS染色却是阴性,也未找到真菌感染证据,思路错误?
追问患者既往史,自认为平素情况尚可,否认高血压、糖尿病、高血脂等慢性病史,也否认肝炎、结核等传染病史。2017年,患者因「右侧乳腺小叶增生」行手术治疗,2017年诊断为「双侧慢性鼻窦炎、双侧分泌性中耳炎、右侧鼻息肉」,先后行鼻窦开放术、右侧鼻息肉摘除术及鼓膜置管术,但术后鼻塞、听力减退无好转。尿崩症病史有半年,口服去氨加压素,控制较为良好。否认输血史,否认食物及药物过敏史。患者无吸烟、饮酒史,及特殊粉尘接触史。婚育史、家族史无特殊。
以下是患者入院后的检查情况:
(一)体格检查
T 36.8℃ P 80次/分 R 20次/分 BP 120/70mmHg
步入病房,神清,全身皮肤无皮疹,鼻腔无异常分泌物,副鼻窦区无压痛,外耳道无异常分泌物,双侧听力显著减退,唇无紫绀,牙列整齐。双肺呼吸音粗,未闻及干湿啰音,心、腹、脊柱四肢、神经系统查体未见异常。
(二)实验室检查
血检验(2018-02-20):糖化血红蛋白、空腹血糖无异常。腺垂体相关激素无异常。ANA、抗着丝点抗体均为阴性。白蛋白35g/L,钠149mmol/L,氯113.1mmol/L,余肝肾功能指标无异常。PCT、G试验无异常。
2次痰培养(2018-02-23):白色念珠菌。
抗酸染色(2018-02-26) :阴性。
胸部CT平扫(2018-02-20):双肺散在感染性病变、部分支气管稍扩张。
胸部CT平扫(2018-02-28):双肺散在感染性病变、部分支气管稍扩张,较2018-02-20片,两肺部分病灶略有吸收。
胸部CT平扫(2018-04-13):两肺感染伴支气管炎改变。
中耳乳突CT (2018-04-24):双侧慢性中耳乳突炎、右侧鼓膜穿孔考虑。副鼻窦炎、术后改变?
胸部CT平扫(2018-04-30):对比前片(2018-04-13),两肺支气管炎伴多发感染,较前明显进展。
血检验(2018-04-24):白细胞9.3*10^9/L,N% 73.0%,L% 15.7%,Hb 124g/L,血小板361*10^9/L,CRP 107.64mg/L。自身免疫性抗体(ANA、ENA全套、抗dsDNA、抗GBM、PR3-、MPO-ANCA)、肿瘤标记物、流感病毒核酸、EBV-IgM、CMV-IgM、总IgE、G试验均无异常。
痰涂片(2018-02-23):找到真菌孢子。2次抗酸染色阴性。
尿常规(2018-02-26) :尿比重1.010,红细胞11.0个/ul,隐血+-。
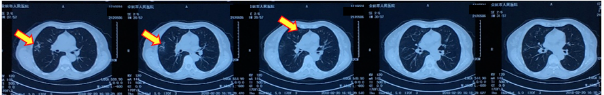
图1:2018-02-20胸部CT平扫 双肺多发斑片影

图2:2018-02-28胸部CT 抗感染治疗1周,双肺多发病灶无明显变化
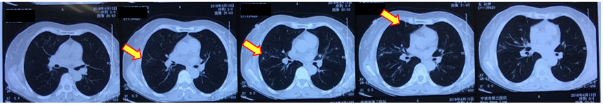
图3:2018-04-13胸部CT平扫 常规随访时双肺多发病变较前有所吸收

图4:2018-04-30胸部CT 双肺多发病变较前明显进展
(三)入院后进一步检查及治疗
血气分析(未吸氧):pH 7.47,pCO2 36.9mmHg,pO2 81mmHg,HCO3- 26.6mmol/L,SO2 96.7%。
感染相关指标:内毒素、G试验、隐球菌乳胶凝集试验、T-SPOT:阴性。
痰抗酸染色(-),痰培养:白色念珠菌。
肝肾功能:低蛋白血症,余未见明显异常。
凝血功能:D二聚体 1220 ug/L,PT、APTT轻度延长。
肿瘤标记物、淋巴细胞亚群:未见明显异常。
尿常规:尿比重<1.005,潜血3+,红细胞107.1个/ul,呈非均一性。
电子支气管镜检查(图5):双侧支气管粘膜轻度充血,病原学检查无阳性发现。
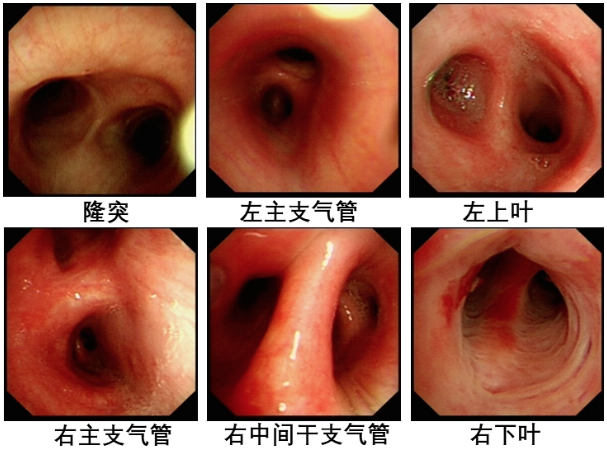
图5:支气管镜检查:未见明显异常。BALF:抗酸、细菌培养、真菌、GM试验均为阴性。BALF-mNGS:未发现特殊致病菌。
入院后,予哌拉西林他唑巴坦联合莫西沙星、伏立康唑抗感染治疗,但患者仍然反复高热,体温最高达40.3度,但无明显畏寒、寒战。伴有咳嗽,痰中带血。5月4日,出现多饮、多尿明显加重,24小时尿量达到5600ml,复查尿常规:尿潜血1+,余无异常;血Na+ 146umol/L,血Cl- 112umol/L。查头颅MRI增强(图6)提示T1WI序列神经垂体未见显示,符合中枢性尿崩症表现。
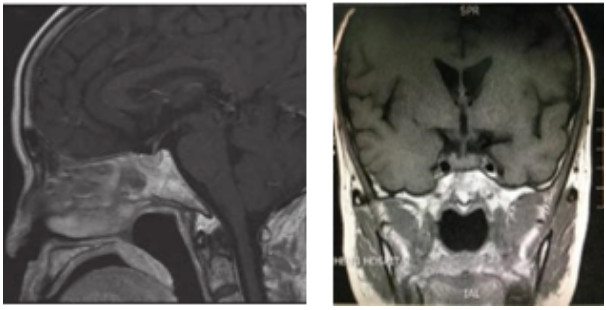
图6:头颅MRI增强:垂体双侧基本对称,内部信号均匀,增强扫描未见异常强化影;T1WI序列神经垂体未见显示。蝶窦炎症。
此时复查胸部CT(图7)提示双肺多发病变较前明显进展,右下叶背段及右下叶基底段部分实变。患者病情进展迅速,多系统受累,入院后再次复查p-ANCA和MPO-ANCA呈阳性,考虑ANCA相关性血管炎,立即行CT引导下经皮肺穿刺,随后加用甲强龙80mg 1/日治疗。1周后病理回报(图8):「右中叶」穿刺标本示肺泡腔内淤血,肺泡间隔增宽,间质纤维组织增生,慢性炎细胞浸润,提示炎症性改变(PAS染色阴性,未找到真菌感染证据)
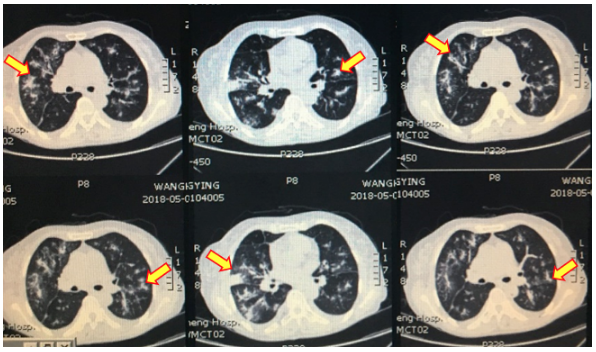
图7:2018-05-08胸部CT:双肺多发病灶较前明显进展
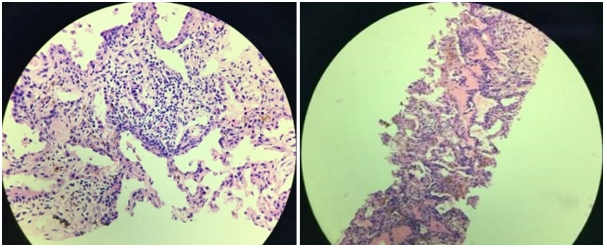
图8:经皮肺穿刺病理
此时患者已多系统受累,一波未平一波又起……结合错综复杂的既往史,与当前疾病毫无关系吗?病史需要重新梳理吗?
此时,团队进行综合分析后开始另想途径,因为患者当前已多系统受累,面对错综复杂的既往史和不断出现的临床症状,难道之前的考虑方向错误?患者的病因与眼下考虑的疾病毫无关系吗?商议后决定重新梳理病情。
回顾患者的临床特点:老年女性,慢性病程,缓慢起病;半年多前以鼻塞、听力减退起病,外院考虑「中耳炎、鼻窦炎」,手术治疗后无好转。后出现烦渴多饮、多尿,外院考虑「尿崩症」,予去氨加压素治疗症状控制可。发现双肺多发病变2月,发热、痰中带血2周,予广谱抗感染及抗真菌治疗仍反复高热,复查见双肺病变进展;查体:神清,精神可,生命体征平稳,浅表淋巴结未及肿大,无皮疹,双侧听力显著减退,双肺呼吸音粗,未闻及干湿性啰音,余心、腹及神经系统未及异常,无关节红肿,双下肢无水肿;辅助检查:血象轻度升高,CRP、血沉显著升高,尿常规示低比重尿、血尿,细菌、真菌相关检查无明确阳性结果,复查胸部CT示双肺病灶较前进展,复查p-ANCA、MPO-ANCA 阳性;入院后予莫西沙星、哌拉西林他唑巴坦、伏立康唑经验性抗感染治疗效果不佳,甲强龙抗炎后次日体温正常,头痛、鼻塞好转,听力改善。
面对上述特点进行综合诊断分析,团队认为,这名患者起病隐匿,病程长,病情呈急性进展。主要以鼻塞、听力减退为首发症状,随后出现尿崩症、发热、痰血及镜下血尿,前期的手术治疗及抗感染治疗均无效,但激素治疗有效。血沉、CRP↑,尿潜血3+, p-ANCA、MPO-ANCA阳性;影像学提示双肺多发浸润影及垂体后叶高信号消失;肺穿刺病理提示炎症性改变。结合该患者耳、上呼吸道、肺脏、垂体受累表现突出,MPO-ANCA和p-ANCA阳性,ANCA相关血管炎诊断较为明确,开始具体分析该如何分型。
AAV最常受累器官是肺和肾……PR3-ANCA和MPO-ANCA分别在GPA患者和MPA 患者中最常见,但疾病诊断需要更多证据和分析
既然ANCA相关血管炎的诊断较为明确,就着重针对这个「靶点」追踪。ANCA相关性血管炎(AAV)是以坏死性炎症为特点的血管炎,最常受累的器官就是肺和肾。ANCA是其血清标志物,免疫荧光下可分为胞浆型(cANCA)和核周型(pANCA)。髓过氧化物酶(MPO)和蛋白酶3(PR3)是ANCA主要的靶抗原。用ELISA法检测,可将ANCA分为MPO-ANCA和PR3-ANCA。而PR3-ANCA和MPO-ANCA分别在GPA患者和MPA患者中最常见,但是循环中ANCA水平并不总会反映疾病的活动度。具体分型又包括显微镜下多血管炎(MPA)、肉芽肿性血管炎(GPA)和嗜酸性肉芽肿性血管炎(EGPA)[1]。
团队进一步开始分析患者是否为这三种类型的血管炎之一:
1、显微镜下多血管炎(MPA):这种血管炎主要累及小血管的坏死性血管炎,也可累及中等血管,最显著的特点是无肉芽肿病变,90%的患者出现微量免疫复合物沉积的肾小球肾炎,急进性肾小球肾炎是最突出的临床表现;肺也是主要受累器官,表现为呼吸困难、咳嗽和不同程度的咯血,影像学以弥漫性肺泡出血为特征,主要表现为靠近中内肺野磨玻璃及小结节影,可融合成片,或表现为斑片实变影,少数患者可表现为类似典型UIP的影像表现。其他系统受累的表现包括肌痛、关节痛、游走性关节炎、紫癜、腹痛、周围神经病变、结膜炎及视网膜炎、耳鼻咽喉病变等。MPA患者的ANCA阳性率为75-90%,多为p-ANCA阳性,最常见为抗MPO抗体阳性。
支持点: 该患者有肺部、垂体、耳、鼻多系统受累,胸部CT表现为双肺多发病变。p-ANCA、MPO-ANCA又呈阳性,首先就需要考虑MPA;
不支持点: 但该患者无肾脏受累,又不符合MPA的临床特征。目前MPA尚无确切诊断标准,参考1996年日本厚生省提出的诊断标准,该患者只能算符合「可能诊断」。

表1:日本厚生省显微镜下多血管炎诊断标准
2、嗜酸性肉芽肿性血管炎(EGPA):这种血管炎原为称变应性血管炎和肉芽肿病(CSS),是一类病因不明主要累及中小动脉的系统性坏死性血管炎。组织病理表现为累及小动脉和小静脉的坏死性血管炎,伴嗜酸性粒细胞浸润和肉芽肿成分。典型的EGPA具有三联综合征:重度哮喘、肺和肺外脏器中小动脉及静脉炎及坏死性肉芽肿、外周血嗜酸性粒细胞升高。哮喘多为患者首发症状,几乎全部发生于系统性病变之前,肾损较轻;70%的患者ANCA阳性,多为p-ANCA阳性;胸部影像学表现多为双肺多发病变,磨玻璃影和实变影,主要呈外周分布。
支持点:该患者有多系统受累,肾损较轻,p-ANCA阳性;
不支持点: 但患者无哮喘表现,外周血嗜酸性粒细胞不高,因此CSS排除。
3、肉芽肿性多血管炎(GPA):这是一种坏死性肉芽肿病变伴有血管炎,多系统疾病,典型患者主要累及上呼吸道、肺、肾脏,也可累及其他脏器。组织病理主要特征是坏死性血管炎、肉芽肿炎症和地图样分布的坏死。临床表现多样,90%的患者有上呼吸道病变,以鼻部受累最常见,肺部受累多表现为单发或多发结节影伴空洞形成,可呈游走性,局限或弥漫性浸润影,少数表现为弥漫性肺泡出血;肾脏发病率远远小于MPA,表现为不同程度的肾小球肾炎;其他还可以见到皮肤、关节以及中枢神经系统受累。中枢神经系统受累约占GPA患者的10%,而垂体功能障碍则更为罕见,约占GPA患者的1%左右[2],GPA的垂体病变好发于女性(69%),平均发病年龄39.5岁,多数表现为中枢性尿崩症(81%~84%)[3]。C-ANCA对GPA诊断有较高价值,若PR3抗体同步阳性则特异性达97%。C-ANCA与疾病活动相关,可作为监测疾病活动和复发的指标。但也有报道显示,我国GPA患者中,p-ANCA和抗MPO阳性率较高[6]。
支持点:该患者多系统受累,抗感染治疗无效,以上呼吸道症状为首发表现,肺部及垂体受累表现突出,尿崩症突出,肾损较轻。查阅相关文献进行汇总后发现导致中枢性尿崩症的血管炎病例中,GPA占比76.9%,而MPA和EGPA总占比不足5%[4-5],结合有报道我国GPA患者中,p-ANCA和抗MPO阳性率较高,因此重点考虑GPA可能。根据2017EULAR/ACR的GPA评分标准(表2),该患者评分7分,符合诊断。
无不支持点。

表2:2017EULAR/ACR的GPA评分标准
诊断明确,激素治疗后患者很快体温正常,痰血消失,鼻塞、听力及多饮多尿症状亦明显改善……3个月后复查未发现新病灶,ANCA转阴
诊断已然明确,治疗方面,团队予甲强龙80mg抗炎治疗治疗2周,患者体温正常、痰血消失、鼻塞及听力明显改善、多饮多尿症状明显改善后出院。出院后予强的松50mg口服1/日治疗,1月后患者复查胸部CT提示双肺多发病变基本吸收(图9),尿潜血转阴性,停用去氨加压素,垂体功能恢复;此后激素逐渐减量。3个月后复查双肺未出现新发病灶,ANCA转阴。2019年3月激素减量至5mg时出现肺内病灶反复,当地医院予以激素加量并加用他克莫司,稳定后逐渐减量,电话随访目前病情稳定。
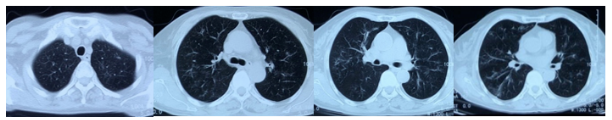
图9:出院1个月(2018年6月12日)复查胸部CT
最后诊断及诊断依据
患者最终被诊断为系统性肉芽肿性多血管炎。诊断依据:1、中年女性,起病隐匿,病程长,急性进展;2、以鼻塞、听力减退为首发症状,随后出现尿崩症、发热、痰血及镜下血尿,前期手术治疗及抗感染治疗均无效,激素治疗有效;3、血沉、CRP ↑,尿潜血3+, p-ANCA、MPO-ANCA 阳性;影像学提示双肺多发浸润影及垂体后叶高信号消失。肺穿刺病理提示炎症性改变。据2017EULAR/ACR的GPA评分标准,GPA诊断成立。
经验与体会
1、肉芽肿性多血管炎是一类累及多系统的疾病,临床表现多样,上呼吸道、肺部、肾脏受累多见,但累及垂体的情况极为罕见,部分患者以尿崩症为首发表现就诊,垂体功能障碍可伴随疾病全过程[2],因此起初容易造成误诊而错过治疗时机。对合并上呼吸道表现、肺部受累或肾脏受累的中枢性尿崩症患者,需警惕该疾病可能;
2、GPA患者多以c-ANCA和PR3抗体阳性为主,但该患者起病初期ANCA呈阴性,病程中复测呈p-ANCA和MPO抗体阳性,不符合典型GPA血清学表现,因此疾病诊断不能过度依赖实验室结果,需结合实际情况进行综合判断;
3、该病例入我院后诊断及时治疗效果佳,不足之处为早期未取得肾脏组织病理加以证实。
参考文献
[1] Garlapati, P. and A. Qurie, Granulomatosis with Polyangiitis, in StatPearls. 2021, StatPearls Publishing Copyright 2021, StatPearls Publishing LLC.: Treasure Island (FL).
[2] De Parisot, A., et al. Pituitary involvement in granulomatosis with polyangiitis: report of 9 patients and review of the literature. Medicine (Baltimore), 2015. 94(16): p. e748.
[3] Peters JE, Gupta V, Saeed IT, et al. Severe localised granulomatosis with polyangiitis (Wegener's granulomatosis) manifesting with extensive cranial nerve palsies and cranial diabetes insipidus: a case report and literature review. BMC Neurol, 2018, 18(1): 59.
[4] Tsuji H, Yoshifuji H, Fujii T, et al. Visceral disseminated varicella zoster virus infection after rituximab treatment for granulomatosis with polyangiitis. Mod Rheumatol, 2017, 27(1): 155-161.
[5] Baird SM, Pratap U, McLean C, et al. Rare presentation of Wegener's granulomatosis in the pituitary gland: Case report and literature review. Int J Surg Case Rep, 2017, 33: 24-26
[6] Chen M,Yu F,Zhang Y,et al. Characteristics of Chinese patients with Wegener's granulomatosis with anti-myeloperoxidase autoantibodies, Kidney International,2005,68:2225-2229
专家介绍

唐昊
上海长征医院(海军军医大学第二附属医院)呼吸与危重症医学科主任;中华医学会呼吸病学分会 9/10届青委会委员;中国医师协会呼吸医师分会青年委员;上海市医学会呼吸病学分会委员;上海市医学会呼吸病学分会哮喘学组副组长;上海市医师协会呼吸医师分会委员;上海市优秀学术带头人;上海市曙光学者;上海市浦江人才;上海市科技启明星。

陈杨
海军军医大学附属长征医院呼吸与危重症医学科副主任医师,科研助理、临床药物试验专业组秘书;上海市医学会、上海市医师协会肺血管学组成员;主持吴阶平医学基金会基础科研专项1项;参与多项国家自然科学基金及上海市、军队课题;发表多篇国内核心、SCI论文;参编多部专科著作。


