摘要
系统性红斑狼疮患者发生静脉血栓(venous thromboembolism,VTE)事件,包括肺栓塞(pulmonary embolism,PE)和深静脉血栓(deep vein thrombosis,DVT)的风险显著增加。其病因及发病机制相当复杂,除原发病疾病活动因素外,还涉及抗磷脂抗体、低白蛋白血症、高球蛋白血症、长期应用糖皮质激素所导致的糖、脂代谢异常、肥胖等。至今,国内外文献尚未针对SLE 患者发生VTE 的危险因素进行全面系统性分析,本文将对SLE 发生静脉血栓栓塞事件的相关研究进展做一综述。
关键词
系统性红斑狼疮;静脉血栓栓塞;抗磷脂抗体;肺栓塞;深静脉血栓
系统性红斑狼疮(systemic lupus erythematosus,SLE) 是一种自身抗体介导的,累及多系统、多器官的弥漫性结缔组织病,其临床表现各异,病情复杂,青年女性多见。大样本临床调查研究发现,SLE 患者发生静脉血栓(venous thromboembolism,VTE) 事件,包括肺栓塞 (pulmonary embolism,PE) 和深静脉血栓(deep vein thrombosis,DVT)的风险显著增加,其PE、DVT 的发生率分别为正常人的14 倍和11 倍 [1]。SLE 出现VTE 的病因及发病机制相当复杂,除原发病本身外 [2],还涉及抗磷脂抗体 (antiphospholipid antibodies,aPLs)、低白蛋白血症、高球蛋白血症等多项因素。同时,SLE 患者容易并发其他获得性血栓形成危险因素,如长期应用糖皮质激素所导致的糖、脂代谢异常、肥胖等,使得SLE 患者发生血栓事件的风险进一步增加。至今,国内外文献尚未针对SLE 患者发生VTE 的危险因素进行全面系统性分析,本文将对SLE 发生静脉血栓栓塞事件的相关研究进展做一综述,旨在提高临床医生对于SLE 患者血栓风险的认识,做到早期识别、及时干预、最终改善SLE 患者预后。
通常SLE 患者的静脉血栓栓塞事件的高危因素包括如下几个方面。
一、原发病病情活动
SLE 病情活动本身所致的血管内皮损伤、炎症细胞分泌的促凝因子、低蛋白血症、高球蛋白血症以及脏器损伤均是静脉血栓事件的高危因素。这些高危因素与Virchow 提出的血栓形成三要素密 切相关,包括血流淤滞、血管内皮受损以及血液高凝状态 [3] ,促成了SLE 患者的静脉血栓形成倾向。
1、疾病活动程度
SLE 疾病活动本身造成的炎症状态是静脉血栓形成的独立危险因素。有研究显示SLE 发生VTE患者的系统性红斑狼疮活动指数(SLE disease activity index,SLEDAI) 明显升高,且伴有中性粒细胞、超敏C 反应蛋白 (high sensitivity C reactive protein,hsCRP)、白细胞介素-6 (interleukin-6,IL-6) 升高以及补体降低等表现 [4]。炎症状态与静脉血栓形成之间的关系密切,其具体机制复杂,涉及到血管内皮细胞损伤和凝血系统异常等 [5]。血小板在血栓形成中亦发挥重要作用,其可释放血小板源性微粒(platelet microparticle,PMP) 以促进凝血酶生成 [6],同时还可触发中性粒细胞活化,促进中性粒细胞捕获网 (neutrophil extracellular traps,NETs) 产生,参与多种炎症反应 [7]。
内皮细胞活化是炎症和血栓形成的关键点,主要涉及到细胞间黏附分子以及组织因子(tissue factor,TF)、血管性血友病因子(von Willebrand factor,vWF) 等凝血激活因子的表达。SLE 疾病活动时的异常炎症指标,包括中性粒细胞、hsCRP、IL-6 升高或者补体降低 [8],均与内皮细胞活化有关。SLE 患者的中性粒细胞在炎症条件下会破坏血管内皮的完整性 [9],而免疫复合物介导的补体活化形成膜攻击复合物也可直接导致内皮损伤 [10]。α 干扰素(interferon-α,IFN-α) 通路的激活是SLE 的特征,其可能促进了内皮细胞活化并导致血管运动功能障碍 [11]。SLE 患者的巨噬细胞有一种炎症表型,也可能导致内皮功能障碍的进展 [2]。
凝血系统和免疫系统有共同的进化起源 [12],二者形成过程相互关联,多个信号分子可共同影响这两大系统。同时,凝血系统异常亦是SLE 患者的一个显著特征 [13]。TF 通路依赖的凝血酶形成是血栓形成过程中不可或缺的一部分,有研究显示SLE 患者中可检测到TF 通路的活化 [14],这与内皮细胞、中性粒细胞、嗜酸性粒细胞等细胞炎症诱导的TF 表达增加有关 [15]。解聚染色体复合物也聚集了大量与SLE 发病机制相关的自身抗原和TF、vWF 等凝血激活因子 [15]。内皮源性微粒是SLE 患者常见的微粒亚群,可促进树突状细胞活化和NETs 形成 [16]。NETs 能促进凝血酶的生成,并通过中和TFPI 和Ⅻ因子进一步促进血栓形成 [17]。凝血酶的生成除了受炎症的影响外,其本身也会影响内皮细胞、血小板甚至肥大细胞的活化状态 [18],并且可通过补体旁路途径促进C5a和C5b 的生成 [19],进一步影响上述细胞的活化状态。
2、狼疮性肾炎
作为SLE 最常见的临床表现之一,狼疮性肾炎也是患者发生VTE 的主要危险因素之一。有研究表明,狼疮性肾炎患者发生血栓性疾病的风险明显增加 [20],特别是伴有大量蛋白尿的患者更容易发生肾静脉血栓和深静脉血栓(OR =6.2, P =0.005) [21]。大量的抗凝相关物质,包括抗凝血酶Ⅲ、蛋白C、蛋白S 和纤溶酶原等凝血调节因子均经过肾脏丢失,因此导致血液高凝状态 [21]。低蛋白血症以及利尿剂应用均可导致有效血容量减少,肾病综合征继发高脂血症增加了血液黏稠度 [22],此均为发生VTE 的高危因素。此外,肾素-血管紧张素-醛固酮系统过度激活继发高血压导致血管内皮损伤 [22]、组织器官水肿导致静脉回流障碍,也可导致VTE 风险增加。最后,肾脏病变明显的SLE 患者往往疾病活动度更高,病情也更严重,此协同作用导致VTE 风险显著增加。
3、SLE 血液系统损害
SLE 并发VTE 患者血液系统可以表现为血小板减低,但这并不能提示患者存在低凝倾向。相反,血小板减低更可能代表了患者体内高凝,有关研究显示合并血小板减少症的SLE 患者血液中存在高浓度的PMPs 也证明了这一点 [6]。SLE 合并VTE 患者血小板减低的机制与SLE 病情高度活动、抗磷脂抗体直接结合导致血小板活化和聚集有关 [23],同时血栓形成过程也会大量消耗血小板,脾脏内滞留的增加、骨髓造血抑制、药物(比如肝素) 可能也参与了血小板减少的过程。在APS患者中,血小板明显减低还是死亡的高危因素 [24]。所以血小板减低对血栓形成并无保护作用,它意味着出血、高凝同时存在,是血栓再发的高危因素,临床上需要更高度的关注。
二、继发抗磷脂综合征
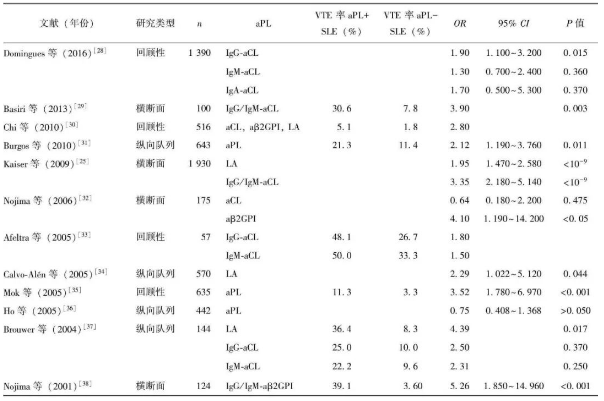
抗磷脂抗体是抗磷脂综合征(antiphospholipid antibody syndrome,APS) 的标志性抗体,其存在往往和血栓形成高风险相关。作为一组针对各种带负电荷磷脂的自身抗体,它包括许多亚型,目前临床常规检测的包括抗β2 糖蛋白Ⅰ抗体(anti-beta 2 glycoprotein Ⅰantibody,antiβ2GPI)、抗 心 磷 脂 抗 体(anticardiolipin antibody,aCL) 和 狼 疮 抗 凝 物(lupus anticoagulant,LAC)。已有大量研究证明SLE静脉血栓形成与aPLs 相关,约40%的SLE 患者合并aPLs 阳性,约20%的APS 继发于SLE,SLE 合并aPLs 阳性患者VTE 事件发生率是阴性者的3 倍左右 [25] 。同时合并3 个aPLs 阳性的APS 患者10年内血栓再发生率明显升高,高达44% [26] 。【表1】列出了近年aPL 与SLE 患者VTE 事件相关研究的数据。
SLE 继发APS 患者静脉血栓事件的风险与aPLs 的表型和滴度、自身免疫状态、传统心血管危险因素有关。Sciascia 等 [27]结合aPLs 表型和传统心血管危险因素构建了APS 评分(Global APS Score,GAPSS) 系统,用于预测SLE 患者血栓形成及不良妊娠事件风险,同时对微血管病变也有一定提示意义。以上风险分层评分系统有助于临床上判别SLE-VTE 高危患者并指导药物治疗,但其纳入项目较少,SLE 特异的危险因素,如病情活动度、肾脏受累等并未纳入。此外,是否存在静脉血栓特异性更高的aPLs,哪一类抗体是真正的致病抗体,均需进一步研究证实。
APS 血栓形成过程复杂,可能有多种机制参与,包括内皮细胞、血小板以及中性粒细胞活化,干扰炎症通路、凝血系统,补体活化等。血管内皮细胞损伤是血栓形成的关键步骤。aPLs 可与内皮细细胞表面的膜联蛋白A5 结合,破坏其与磷脂酰丝氨酸分子形成的内皮保护屏障 [39],与膜联蛋白A2以及toll 样受体4 (toll-like receptor 4,TLR4) 结合后可激活核因子κB (nuclear factor κB,NF-κB) 信号通路,促进TF 表达 [40]。aPLs 还可激活内皮细胞表面的哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,m TOR) 通路 [41]导致血管病变,动物试验证明aPLs 可抑制内皮细胞产生一氧化氮降低血管张力 [42]。血小板也在aPLs 和内皮细胞的血栓前相互作用中发挥重要作用 [43]。aPLs 可活化血小板并促进糖蛋白IIb/IIIa (纤维蛋白原受体) 的表达。aPLs 还可直接与单核细胞、中性粒细胞相互作用,诱导线粒体功能障碍,进而表达TF 和肿瘤坏死因子α (tumor necrosis factor α,TNF-α) 等炎症因子 [44],并诱导产生NETs,而NETs 又能促进凝血酶生成,此现象在抗β2GPI 抗体存在时更为明显 [45]。aPL 与活化细胞表面的β2GPI 二聚体结合后还会抑制组织因子途径抑制物(tissue factor pathway inhibitor,TFPI) [46]以及活化蛋白C (activated protein C,APC) 的活性 [47],影响凝血系统,进而形成血栓前状态。补体途径也参与了这一过程,aPL 可激活经典补体途径,产生膜攻击复合物介导内皮细胞功能障碍 [48],中间产物C5a 还可与中性粒细胞结合,刺激TF 的表达 [49]。
【表1】合并抗磷脂抗体阳性的SLE 患者VTE 事件发生率相关研究回顾
三、其他因素
1、传统的静脉血栓危险因素
当合并传统的静脉血栓事件危险因素时,SLE患者发生VTE 风险会更高。肥胖、久坐、长期卧床引起的血液淤滞,高血压、吸烟 [50]、感染等导致的血管内皮损伤,以及高血脂、肿瘤、外伤、妊娠、V 因子Leiden 点突变等先天性疾病导致的血液高凝状态,均增加了血栓形成风险 [25,35]。值得提出的是,传统血栓危险因素中吸烟除诱导内皮损伤激活凝血通路 [51]外,还会干扰SLE 患者羟氯喹的治疗效果。
2、药物
SLE 患者的常用药物,包括糖皮质激素、沙利度胺等,同样可能会增加静脉血栓事件风险。有研究显示大剂量糖皮质激素的使用与血栓事件可能有关,但该研究无法除外病情活动的混杂因素 [52]。长期使用糖皮质激素继发的血压异常、糖、脂代谢紊乱会对内皮细胞造成损伤。大剂量糖皮质激素使用还和凝血级联系统异常有关,其可导致VIII 因子、vWF、纤维蛋白原激活抑制因子活性的增加,以及纤溶酶原的减少 [53]。沙利度胺、口服避孕药等其他药物的使用,也会引起血液高凝状态增加静脉血栓的风险 [54]。
总之,SLE 患者的静脉血栓栓塞事件风险显著升高,其危险因素极其广泛且错综复杂。SLE 原发病病情活动、抗磷脂抗体的存在以及传统血栓危险因素和药物副作用等具有协同作用,最终导致长期血管损伤和静脉血栓形成。每位SLE 患者都是多种致病因素的独特组合。因此,未来的治疗策略应基于流行病学基础上的个体化风险评估决定该患者的预防血栓风险治疗的强度。积极控制SLE 病情、预防重要脏器损害,重视aPLs 阳性患者,及早进行血栓预防,控制其他传统静脉血栓危险因素,建立适用于SLE 患者的VTE 风险评估量表从而识别VTE 高危患者,可以最大限度地减少静脉血栓事件对SLE 患者生命和健康的有害影响。
* 参考文献:略
作者:尤含笑,赵久良,孙伊多,李梦涛,曾小峰 - 中国医学科学院 北京协和医学院 北京协和医院风湿免疫科风湿免疫病学教育部重点实验室。
通信作者:李梦涛,E-mail:mengtao.li@cstar.org.cn
(DOI:10.3969∕j.issn.1673-8705.2019.03.011)
主编:尹佳;责编:杜伟
责编介绍

杜伟
主治医师,北京协和医学院博士毕业后在北京协和医院皮肤科工作至今。主要研究方向为变态反应性(过敏性)皮肤病及自身免疫性皮肤病。