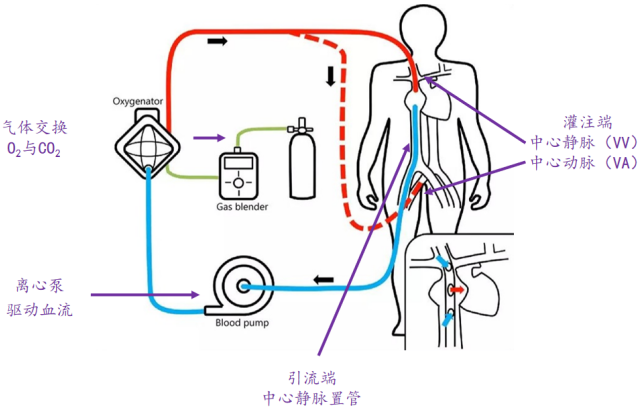
一、ECMO工作原理
通过中心静脉置管将血液引流出来,再通过离心泵驱动血液向前流动,然后通过膜肺进行气体交换,交换后的血液在泵的推动下可回到静脉,即为VV-ECMO,也可回到动脉,即为VA-ECMO。2020年,随着新冠疫情在全球大流行,ECMO的应用在国内得到了迅猛发展,很多医院以及各亚专科ICU都开始陆续开展ECMO工作,ECMO也救治了很多危重症患者。
二、ECMO并发症分类
ECMO并发症可分为ECMO系统并发症(包括设备故障、气栓、插管)和患者自身并发症(包括出血与血栓、院内感染、脏器功能损伤、溶血、辅助流量不足)。
1. 插管问题
(1)插管位置:引流端插管位置不到位可能导致静脉端引流不畅,目标流量无法达到,进而出现管道抖动。对于VV-ECMO,可能会出现再循环增加。如果动脉端压力过高,可能导致插管崩脱或血细胞破坏过多。

(2)插管松脱:静脉端松脱致可导致失血或气栓;动脉端松脱致可致大量失血。一旦出现大量出血,可能在短时间内即出现失血性休克。
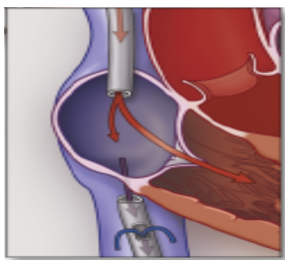
(3)插管处血管损伤:ECMO插管时出现血管穿破或夹层,进而导致血管逆性撕裂。
针对上述置管问题的预防与处理策略:
(1)插管定位:在运行过程中,除了观察管路在体外的长度,还可以通过观察流量变化、有无抖管、引流管负压变化以及患者血流动力学的变化,来确认插管的位置。此外,还可以通过床旁X线进行定位,最直观的方法是利用床旁超声或经食管超声心动图检查(TEE)进行定位。
(2)插管固定:插管定位确认后再固定,观察引流负压和局部周围软组织变化,一旦发现异常应即刻进行调整。当患者躁动时予以镇静,防止意外拔管。
(3)动脉损伤处理:对于VA-ECMO,如果置管过程中出现了动脉损伤,必须另选部位重新插管;损伤处动脉需由外科修补。在ECMO运行过程中一定要警惕内出血,监测血流动力学和血红蛋白的变化。
2. 出血与血栓
2022年发表在Intensive Care Med上的文献显示,在7579例VV-ECMO患者中,40.2%发生≥1次出血或血栓事件。如下图A所示,主要血栓事件(蓝色)为54.9%,出血事件(红色)为45.1%。下图B所示,出血事件主要为管道位置出血,凝血事件主要为膜肺血栓。任何出血和血栓事件都会增加患者的死亡风险(OR>1),如果出现了颅内出血或血栓、脑梗死,患者死亡风险会明显增加[1]。
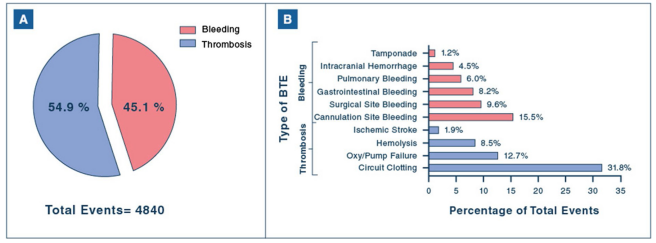
图源:Intensive Care Med, 2022, 48(2):213-224.
导致患者出血的原因包括:①凝血功能紊乱:原发病、凝血因子和血小板消耗;②全身肝素化;③ECMO插管操作;④插管固定不当,止血不彻底;⑤ECMO过程中侵入性操作;⑥其他原因:如呼吸道与消化道黏膜受损、缺氧/再灌注损伤等。
出血的预防和处理:
(1)管道选择:选用肝素涂层管道,减少抗凝药物的使用。
(2)插管处:切开插管后外科细致止血;如ECMO过程中插管处渗血,压、填、局部药物;如仍出血,降低活化凝血时间(ACT)至140~150 s,补充血小板;如还出血,渗血连续2 h,>10 ml/h,重新外科止血。
(3)外科创面:动态观察有无显性/隐性失血征象,调整抗凝和补充凝血成分,再次外科止血。
(4)ECMO运行中:避免不必要的侵入性操作,保护呼吸道与消化道黏膜完整,凝血功能监测和调整。①根据需要调整肝素抗凝强度;②定期监测ACT、活化部分凝血活酶时间(APTT)、血小板计数及功能、纤维蛋白原;③补充凝血成分:新鲜冰冻血浆,血小板,纤维蛋白原,血小板计数<(80~100)×109/L,纤维蛋白原<1.0 g/L,常规补充;明显出血或有出血高风险,纤维蛋白原维持在1.5 g/L;④在顽固性凝血因子损耗及凝血功能障碍情况下,更换ECMO装置;⑤应用抗纤溶药物:如6-氨基己酸、氨甲环酸。
导致血栓的原因:重症患者通常会采取镇静镇痛及制动措施,可导致血液淤滞,血小板和纤维蛋白原沉积,容易形成血栓。此外,血栓的形成也与ECMO系统所用材料有关。
血栓的预防和处理:①抗凝监测:APTT(内源性凝血途径)55~60 s;ACT(与肝素用量有关)180~220 s;抗Xa因子:0.3~0.7 IU/ml;AT-Ⅲ活性(受肝素影响)。②监测血栓:及时发现,立即取栓;必要时更换ECMO系统。
3. 院内感染
ECMO患者是院内感染的高危人群。研究发现,无论是新生儿、儿童,还是成人患者,ECMO支持时间越长,发生院内感染的风险就越高。ECMO启动1周后感染风险开始增加,2周后成人感染风险增加6倍,14天时成人感染发生率约为53%[2]。与非ECMO患者相比,ECMO患者更易发生血行感染[3]。
ECMO相关血行感染的来源有导管、膜肺、呼吸道和消化道。
导管、膜肺相关血行感染的预防:①加强手卫生、保护性隔离;②拔除不必要的动静脉导管,置入PICC;③减少膜肺及管路相关操作;④严格使用输液接头、三通;⑤伤口皮肤消毒,局部换药;⑥调整导管位置时严格消毒;⑦必要时更换ECMO导管;⑧每日评估撤机条件,尽早撤机。
当出现ARDS时,毛细血管基底膜破坏,肺泡通透性增加,细菌可以扩散入血。呼吸道相关血行感染预防策略可以选择:①相对高水平的PEEP防止肺泡塌陷及剪切伤;小潮气量降低肺泡上皮通透性;间断肺复张;②俯卧位改善病变均一性,防止高PEEP导致的气压伤。
重症患者免疫抑制,肠蠕动减弱,肠道菌群失调,肠黏膜缺血缺氧,通透性增加。预防消化道相关血行感染的措施包括:早期肠内营养,使用益生菌,保持大便通畅,监测腹内压。
三、病例分析
患者女性,15岁,学生。主诉:咳嗽咳痰10天,发热1周,呼吸困难4天。诊断为重症支原体肺炎,重度ARDS。
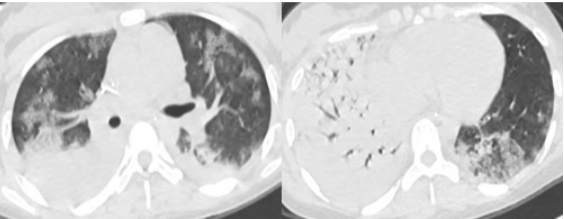
予患者高流量氧疗、无创通气、气管插管有创通气、俯卧位,但其低氧血症和高碳酸血症均无法纠正,最终启动VV-ECMO,整体治疗效果较好。7天后撤机。但患者并发泛耐药鲍曼不动杆菌肺脓肿脓胸,胸水浑浊,胸水培养和BALF培养均为泛耐药鲍曼不动杆菌。

经过反复胸腔闭式引流,多黏菌素B+替加环素(21天)/多西环素+美罗培南(8天)抗感染,患者好转出院,出院后1个月和4个月复查肺部CT,可见病灶吸收良好。尽管如此,院内感染仍然延长了患者的住院时间,增加了医疗费用。因此,ECMO救治过程中一定要警惕并发症的发生。
总之,对于ECMO的临床应用,我们应存有敬畏之心,在实施过程中努力做好每一个细节,制订完善的制度和流程,能够达到熟能生巧,同时还应加强自身的应急反应能力,最终提升ECMO的救治率。
参考文献
[1] Nunez J I, Gosling A F, O'Gara B, et al. Bleeding and thrombotic events in adults supported with venovenous extracorporeal membrane oxygenation: an ELSO registry analysis[J]. Intensive Care Med, 2022, 48(2):213-224.
[2] Bizzarro M J, Conrad S A, Kaufman D A, et al. Infections acquired during extracorporeal membrane oxygenation in neonates, children, and adults[J]. Pediatr Crit Care Med, 2011, 12(3):277-281.
[3] Burket J S, Bartlett R H, Vander Hyde K, et al. Nosocomial infections in adult patients undergoing extracorporeal membrane oxygenation[J]. Clin Infect Dis, 1999, 28(4):828-833.
作者简介

韦超洁
武汉大学中南医院呼吸与危重症医学科;留法博士,副主任医师,硕士研究生导师;中国医学科学院武汉感染性疾病及肿瘤研究中心秘书;武汉医学会呼吸病学分会青年委员;湖北省睡眠研究会睡眠呼吸障碍专业委员会委员;Thorax杂志中文翻译官;主持国家自然科学青年基金1项、中央高校项目1项、省级基金1项、中国医学科学院武汉感染性疾病及肿瘤研究中心项目1项;参与国家自然科学面上项目1项、省级基金1项、市级基金1项;以第一作者/通讯作者发表SCI论文7篇;参与撰写专家共识2部。
本文转载自订阅号「重症肺言」(ID:RCCRC_0067)
原链接戳:ECMO并发症的预防及处理
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


