
摘要
在近年来的临床研究中,不少学者将与特发性肺纤维化存在共同的病理生物学机制,以及类似的临床疾病行为的纤维化性间质性肺疾病统一并称为进展性纤维化性间质性肺疾病,而关于进展性纤维化性间质性肺疾病的定义、诊断标准在大型临床试验中各有不同,并未达成共识。《成人特发性肺纤维化(更新)和进展性肺纤维化:ATS/ERS/JRS/ALAT临床实践指南(2022版)》对除特发性肺纤维化以外的纤维化进行性加重的间质性肺疾病的过程进行统一,首次提出进展性肺纤维化这一临床术语,明确诊断标准,并对其治疗给予建议。本文对该指南中进展性肺纤维化部分进行详细解读。
【关键词】肺疾病,间质性;进展性纤维化性间质性肺疾病;进展性肺纤维化;诊断标准;治疗建议
间质性肺疾病(interstitial lung disease,ILD)是一组弥漫性肺部病变,以肺泡单位的炎症和间质纤维化为基本病变的肺部疾病的总称。由于ILD的病因不同,其病理表现、治疗策略和预后也不尽相同[1]。大量临床研究发现,部分ILD患者在疾病过程中最终出现肺纤维化,尽管是在经过祛除病因和常规治疗(如糖皮质激素和免疫抑制剂)后,其肺纤维化病程仍呈进行性进展,过去将这些疾病称为纤维化性ILD[2],从2018年起临床上将这一表型称为进展性纤维化性ILD(progressive fibrosing ILD,PF-ILD)[3]。目前研究公认特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是典型的慢性持续进展表型的纤维化性ILD之一[4]。PF-ILD的提出提示研究者对ILD的认识也从病因和疾病类型扩展到疾病行为或自然病程,对促进ILD的评估与治疗具有重要意义,但如何评估和管理PF-ILD并未形成统一标准[5-6]。
《成人特发性肺纤维化(更新)和进展性肺纤维化:ATS/ERS/JRS/ALAT临床实践指南(2022版)》[7](简称“2022版指南”)对除IPF以外的纤维化进行性加重的ILD的过程进行统一,首次提出进展性肺纤维化(progressive pulmonary fibrosis,PPF)这一临床术语,用于替代PF-ILD,描述且明确了诊断标准,并给予治疗建议。本文对2022版指南中关于PPF临床实践指南部分做出详细解释。
1、PPF的定义
2022版指南中首次提出PPF的定义,即:具有肺纤维化放射学证据的已知或未知病因的除IPF外的ILD患者,在过去1年内,符合以下3项标准中至少2项。(1)呼吸道症状恶化。(2)有疾病进展的生理证据,包括:①FVC%pred绝对值下降≥5%;②校正血红蛋白后的DLCO%pred绝对值下降≥10%。(3)一种或多种疾病进展的放射学证据,包括:①牵拉性支气管扩张和细支气管扩张的范围或严重程度增加;②伴有牵拉性支气管扩张的新增磨玻璃影;③新的细小网格影;④网状结构异常的范围或粗糙度增加;⑤新出现的或增多的蜂窝影;⑥肺叶体积丢失增加。对比在2019年意大利第三届ILD国际峰会上专家工作组提出关于PF-ILD建议诊断标准(简称“2019版PF-ILD共识”)[5]:ILD患者在接受常规治疗后的24个月内,达到以下任何1条即可:(1)FVC%pred相对下降≥10%;(2)FVC%pred相对下降≥5%,并且DLCO%pred相对下降≥15%;(3)FVC%pred相对下降≥5%,并且高分辨率CT(high resolution computed tomography,HRCT)上纤维化增加(影像科医生判断);(4)FVC%pred相对下降≥5%,并且呼吸系统症状进展;(5)患者呼吸症状持续恶化,且HRCT示肺纤维化加重。既往研究显示临床医生在识别进展性纤维化表型至死亡之间的中位时间约为30~45个月[8],2019版PF-ILD共识推荐的24个月观察时间可能延误PF-ILD抗纤维化时机。2022版指南将观察期缩短为1年内,以期达到早期识别及治疗。另外,相比2019版PF-ILD共识,2022版指南更详细地描述了纤维化进展的形态学定义,有助于提高呼吸内科医生、影像科医生对形态学是否存在进展的认知。
2022版指南特别强调:(1)PPF是不包含有IPF的定义,而既往PF-ILD这一术语涵盖了包括IPF在内的一系列具体的ILD,如慢性过敏性肺炎(chronic hypersensitivity pneu-monitis,CHP)、结节病、结缔组织病相关间质性肺疾病(connective tissue disease-associated interstitial lung dis-ease,CTD-ILD)。CTD-ILD包括类风湿性关节炎相关ILD、系统性硬化病相关ILD、混合性结缔组织病相关ILD)、特发性非特异性间质性肺炎(idiopathic non-specific interstitial pneumonia, iNSIP)和未分类的特发性间质性肺疾病(unclassified idiopathic interstitial lung disease,u-ILD)等[8];(2)PPF不是一个诊断,只是疾病行为,用于描述随着时间进展ILD纤维化逐渐加剧的一个过程,其中同样包括了一大类具有与IPF类似的临床表现、影像学变化及相似预后的疾病过程,根据既往的临床试验中发现多种类型ILD可出现PPF,依次是CHP、CTD-ILD、iNSIP、u-ILD等[3](图1),另外指南列出可潜在表现为PPF的ILD,见表1[7];(3)虽然PPF判断标准来自多项使用不同标准的临床研究,但是通过这些标准所确定的人群,其疾病进展过程是相似的;(4)PPF仅与预后相关,尚不清楚这类患者是否适宜抗纤维化治疗。
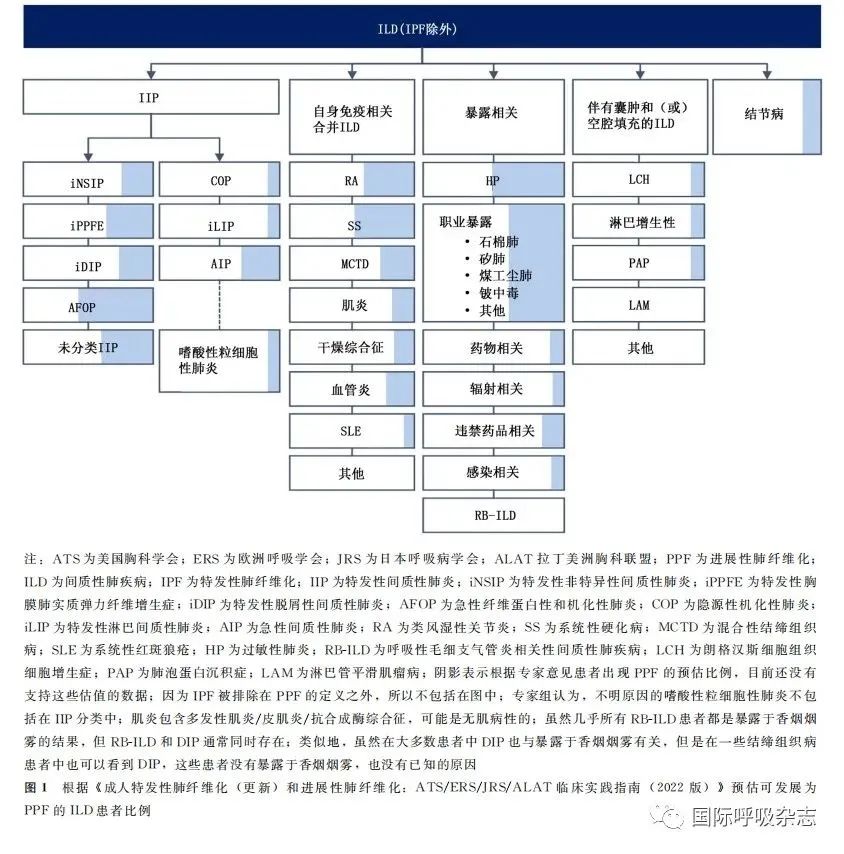

经专家组多方考虑最终选定了PPF这一新术语,并给出了如下3点解释:首先,疾病进展是进行性肺纤维化的结果,不仅发生在肺间质也在肺实质;其次,疾病进展引发的临床病程与IPF相似;最后,PPF用词简单,且较易理解。在讨论过程中,专家组曾考虑过使用“进行性纤维化表型”这一术语,然而“表型”意味着有一个已确定的基因型,但目前尚没有已知的与PPF相关的基因型,所以“进行性纤维化表型”一词被否决。
2、PPF的生理学标准
关于PPF患者的生理学证据,目前研究公布的数据较少。考虑到PPF和IPF的疾病行为和预后具有可比性[4],所以专家组通过参考既往IPF患者临床参数来推断制定PPF的生理学标准。在这个过程中专家组分别讨论了包括FVC、DLCO、步行距离的变化、急性加重次数、住院模式、新发或肺动脉高压加重和生活质量的变化。结合既往文献报道,FVC和DLCO不易受其他相关因素影响[9-11],专家组最终选择FVC和DLCO作为评估PPF的临床参数,指南认为判断PPF生理学证据是基于随访1年内FVC%pred和(或)DLCO%pred绝对值下降,其计算方法为初始测量值-最终测量值,即:随访1年内FVC%pred绝对值下降≥5%和(或)随访1年内DLCO%pred绝对值下降≥10%(经血红蛋白校正)。
FVC是IPF患者随访中最常用的生理学指标,既往研究发现无论是其相对下降或绝对下降均与患者预后相关[9],而在最近的关于PPF的临床研究中如尼达尼布INBU-ILD试验[12]、吡非尼酮RELIEF试验[13]和u-ILD试验[14],均将FVC作为判断疾病是否出现进展的依据。
根据既往的临床试验,研究者认为DLCO的变化并不是一个很好的终点,因为测量结果存在易变性,容易受患者原发病、实验室技术、机器等影响,对判断肺纤维化进展产生误差,但DLCO的变化(经血红蛋白校正后)仍是多种纤维化性肺病患者病死率的一致且强有力的预测因子[10-11]。另外,2022版指南再次强调以DLCO为判断依据时,必须排除导致DLCO下降的其他原因,经血红蛋白校正后DLCO%pred绝对值下降≥10%提示存在PPF,尤其同时合并FVC%pred绝对值下降≥5%或胸部HRCT提示纤维化病灶进展。
3、PPF的影像学标准
HRCT是诊断肺纤维化、判断疾病是否进展较为敏感和特异的检查方法之一。研究发现,在非IPF的ILD中,影像学的进展类型是可变的,可能由最初的异常磨玻璃影和(或)牵拉性支气管/细支气管扩张的增加逐渐演变为网状影,而随着疾病进展,网格影演变为蜂窝影,最终形成肺纤维化[15]。所以2022版指南强调判断肺纤维化是否进展,需要对比初始和随访HRCT中含有纤维化特征的肺容积占上、中、下肺野的比例,比例升高表明纤维化进展。规定的纤维化特征主要包括:牵拉性支气管扩张和细支气管扩张的范围或严重程度增加、伴有牵拉性支气管扩张的新增磨玻璃影、新的细小网格影、网状结构异常的范围或粗糙度增加、新出现的或增多的蜂窝影、肺叶体积丢失增加。在这点与IPF的进展影像评估有些不同。IPF胸部HRCT提示疾病进展,通常为普通型间质性肺炎(usual interstitial pneumonia,UIP)特征增多[16],即蜂窝影、牵拉性支气管扩张和细支气管扩张的比例增多。
2022版指南强调胸部HRCT在PPF患者中的随访具有很重要的作用,当临床怀疑纤维化加重时,应在随访时进行HRCT检查,但关于患者的HRCT随访频率暂无统一推荐。目前研究发现,对于肺功能稳定的系统性硬化病患者,在基线检查后12~24个月内复查胸部HRCT可能有助于及时发现PPF,可提示临床医生及时干预,最终可能影响患者预后[17]。2022版指南建议可每年行1次HRCT检查评估是否存在纤维化进展,另一方面可以筛查相关并发症,尤其是肺癌。
2022版指南提到肺间质异常(interstitial lung abnormality,ILA),该名词在2020年Fleischner协会发布的ILA专家共识文件[18]中明确为影像学名词,指在非疑诊ILD的个体中偶然发现的、累及至少5%肺区的非重力依赖性异常,包括磨玻璃或网状异常、肺变形、牵引性支气管扩张、蜂窝状异常和非气肿囊肿。ILA根据是否存在纤维化可分为UIP型和非UIP型(磨玻璃影、马赛克征、实变影)。其中,“纤维化”被定义为伴有牵拉性支气管扩张和(或)蜂窝影的肺部结构病变。研究发现UIP和可能UIP型的胸膜下纤维化性ILA更容易进展,且生存率更低,进一步提示胸膜下纤维化性ILA,尤其是UIP和可能UIP型,可能是IPF或者是PPF的早期表现[19],提示对其进行识别有助于早期诊断与及早治疗。
4、PPF的循证治疗
专家指出目前没有专门针对PPF的研究,但是有3项研究的入组标准比较符合PPF的定义,如INBU-ILD试验[12]、RELIEF试验[13]和u-ILD试验[14]。专家组从多个维度进行综合分析判断药物的安全性和有效性,主要包括:死亡率和疾病进展(FVC变化),重要转归包括第1秒用力呼气容积(forced expiratory volume in one second,FEV1)、肺总量、DLCO和6分钟步行试验、呼吸系统症状(圣乔治呼吸问卷、莱斯特咳嗽问卷、UCSD-SOBQ或咳嗽评分)和不良事件。
吡非尼酮是一种具有广谱抗纤维化、抗炎和抗氧化特性的吡啶化合物,可以延缓IPF纤维化的进展,并可能延长患者的生存期,是治疗轻-中度IPF患者的指南推荐用药[20-21]。专家组对于吡非尼酮的推荐意见源于两项针对PPF的研究:RELIEF研究是一项为期48周的多中心、随机、双盲、安慰剂对照、ⅡB期研究[13],纳入CHP、CTD-ILD和石棉肺患者,但是由于入组缓慢导致中期分析无效,所以研究提前终止。另一项是为期24周的多国、多中心、随机双盲、安慰剂对照、Ⅱ期研究的u-ILD试验[14]。
u-ILD研究中,24周后吡非尼酮组FVC下降绝对值比对照组少96.3 ml(P=0.002)。其余肺功能的指标:RELIEF研究显示吡非尼酮延缓DLCO下降达0.40 mmol·kPa-1·min-1,u-ILD研究显示其将DLCO%pred下降>15%的风险降低了75%;两项研究综合分析吡非尼酮减缓6分钟步行试验的下降达25.2 m,但是两项研究发现吡非尼酮在延缓患者生存率方面较安慰剂差异无统计学意义,另外不良反应以消化道不适和光敏为主。
专家组认为吡非尼酮是一种很有前景的治疗PPF的药物,但提出两个值得考虑的问题:(1)基于127例非纤维化性u-ILD发展的PPF患者做出决定值得进一步考量;(2)如果专家对u-ILD的抗纤维化治疗进行推荐,可能会导致临床医生放弃ILD病因的检查,但目前的证据又不足以支持这样的做法。因此基于以上证据,对于吡非尼酮的疗效、有效性和安全性,推荐在以下两个人群中进一步研究验证:(1)一般表现为PPF的非IPF ILD;(2)一般表现为PPF的非IPF的ILD特定类型。
尼达尼布是一种酪氨酸酶抑制剂,可干扰成纤维细胞的增殖、迁移和分化,以及肺中细胞外基质成分的分泌,同样是治疗IPF患者的指南推荐用药[22-24]。专家组对于尼达尼布的推荐基于INBU-ILD研究及该研究事后分析的结果。INBU-ILD临床试验是一项多国、多中心、随机、双盲、安慰剂对照、平行分组的Ⅲ期临床研究,目的是评估52周期间尼达尼布(150 mg,2次/d)对PPF患者的有效性、安全性和耐受性。事后分析比较了尼达尼布在不同类型的ILD的效果。INBU-ILD研究结果显示[12],与安慰剂相比,52周内使用尼达尼布治疗患者FVC年下降率更低(-80.8 ml/年比-187.8 ml/年,Δ=107.0 ml/年,P<0.001);影像学表现为UIP患者使用尼达尼布延缓FVC年下降率为82.9 ml/年,与安慰剂组(211.1 ml/年)比较差异有统计学意义(P<0.001);而表现为非UIP患者使用尼达尼布延缓FVC年下降率为79.0 ml/年,与安慰剂组(154.2 ml/年)比较差异有统计学意义(P=0.014)。亚组分析发现,尼达尼布较安慰剂能延缓CTD-ILD、纤维化性NSIP或纤维化性职业肺疾病的FVC下降,但是尼达尼布与安慰剂在延缓纤维化性过敏性肺炎结节病或u-ILD的FVC下降方面差异无统计学意义。尼达尼布的不良反应主要表现为胃肠道反应,包括腹痛、腹泻、恶心、肝酶升高等。专家组建议尼达尼布用于治疗IPF以外的纤维化型ILD经标准管理失败的PPF患者,也建议尼达尼布在特定类型的PPF人群进行临床试验以进一步确认其有效性和安全性。
2022版指南可解决目前部分PPF的临床需求,但仍有很多问题亟待解决,如:(1)明确对于不同病因的ILD亚型患者,尽管在相对较短的时间内进行了初始治疗,但仍出现进展性和不可逆纤维化表型的原因;(2)验证血清生物标志物以识别PPF风险患者;(3)验证由大型HRCT数据集开发的卷积神经网络(如机器和深度学习算法),其可能有助于疾病模式识别、预后判断和识别进展,以及表征偶然检测到的ILA;(4)在可表现出PPF的各种类型ILD中,优先选择存在初始治疗(糖皮质激素联合免疫抑制剂)和抗纤维化药物具有先后顺序的临床研究。因此未来需要开展大规模纤维化ILD队列研究,评估早期抗纤维化或抗炎、抗纤维化联合治疗的效果,指导治疗决策。
(参考文献略)
作者:毛萌萌 郭炳鹏 韩茜 - 广州医科大学附属第一医院呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 呼吸疾病国家重点实验室 广州呼吸健康研究院,广州 510120;通信作者:韩茜,Email:hanqian1020@yahoo.com
引用本文:毛萌萌,郭炳鹏,韩茜.《成人特发性肺纤维化(更新)和进展性肺纤维化:ATS/ERS/JRS/ALAT临床实践指南(2022版)》解读(一):进展性肺纤维化识别与治疗[J].国际呼吸杂志,2023,43(11):1245-1250.DOI:10.3760/cma.j.cn131368-20231013-00247.
基金项目:国家自然科学基金(82170073);国家重点研发计划(2021YFC2500701);广东省基础与应用基础研究基金自然科学基金(2022A1515012501);广州市卫生健康科技项目(20231A011080)
本文转载自订阅号「国际呼吸杂志」(ID:guojihuxizazhi)
原链接戳:【指南解读】《成人特发性肺纤维化(更新)和进展性肺纤维化:ATS/ERS/JRS/ALAT临床实践指南(2022版)》解读(一)
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


