
摘要
肺结核诊断延迟不仅造成患者个体的疾病进展和治疗困难,而且在群体层面导致结核病的持续传播。作为肺结核患者主要的首诊场所,综合医疗机构肺结核的早期发现对于实现“终止结核病流行”策略目标具有重要意义。国家呼吸内科医疗质量控制中心、中华医学会结核病学分会、中国防痨协会结核病控制专业分会、中日友好医院共同组织专家,在借鉴世界卫生组织相关指南的基础上,补充国内外相关研究证据,结合我国结核病防治实践,制定了《综合医疗机构肺结核早期发现临床实践指南》。本指南系统总结了肺结核诊断技术的特点,提出了在综合医疗机构就诊的不同目标人群的肺结核筛查路径,为全国各级综合医疗机构进一步完善和优化肺结核早期发现提供循证证据和临床实践指引。
【关键词】结核,肺;医院,综合;早期诊断;总结性报告 (主题)

识别二维码观看
《综合医疗机构肺结核早期发现临床实践指南》发布会
制订指南背景
结核病仍然是严重威胁人类健康和生命的重大传染病。据世界卫生组织(World Health Organization,WHO)报道,2022年全球估算结核病发病数为1060万例,发病率为133/10万;我国估算结核病发病数为74.8万例,发病率为52/10万,为全球第三大结核病高负担国家[1]。同时,我国有庞大的结核分枝杆菌潜伏感染(latent tuberculosis infection,LTBI)人群,据估算,我国 5 岁及以上人群结核分枝杆菌潜伏感染率为 18.1%(95%CI:13.7%~22.4%)[2]。
围绕早期发现、规范治疗及管理结核病患者开展的传染源控制措施,是结核病防治的基石。据估计,在我国2022年新发的结核病患者中,约有70%的患者被发现并报告[1]。一项针对病原学阳性肺结核患者的多中心回顾性队列研究结果显示:87.5%的肺结核患者首诊机构为综合医院,从就诊到确诊的中位时间为20 d;57.3%的患者存在诊断延迟(首次就诊到诊断超过14 d),非定点医疗机构远高于定点医疗机构,分别为61.8%和37.0%[3]。诊断延迟不仅造成患者个体的疾病进展和治疗困难,而且在群体层面导致结核病的持续传播。
据统计,2021年我国共有综合医疗机构20 307家[4],其中,约95%为结核病非定点医疗机构[5]。结核病非定点医疗机构对肺结核的早期识别和诊断、减少诊疗延迟及减少传播有至关重要的作用。本指南聚焦如何在综合医疗机构早期发现肺结核,在借鉴WHO结核病患者发现相关指南的基础上,结合我国结核病临床实践和相关研究,提出临床应用指导及循证依据。
指南制订方法
本指南由国家呼吸内科医疗质量控制中心、中华医学会结核病学分会、中国防痨协会结核病控制专业分会和中日友好医院共同发起,并得到《中国防痨杂志》和《结核与肺部疾病杂志》编辑委员会的支持。本指南制订过程中设置了专家委员会、方法学组、秘书组、文献整理组、共识组、撰写组和外审组等7个工作组,工作组所有成员均书面声明没有利益冲突关系。
指南范围及技术问题的提出由撰写组起草,使用德尔菲法征集不同领域专家意见,经由专家委员会讨论审定。
指南证据检索由秘书组及文献整理组完成。文献检索数据库包括中文数据库的中国知网、万方数据、维普数据库、中华医学期刊全文数据库,以及英文数据库的PubMed等。
指南推荐建议是在WHO相关指南及我国相关的结核病防治工作技术规范的基础上,检索国内外相关研究进展和临床实践经验,综合考虑我国综合医疗机构的工作基础、防控技术措施升级、干预措施利弊等因素,通过研讨会议的方式达成共识;形成初步推荐意见及依据说明,经外审组专家会议审议并提出改进意见,最终形成指南终稿;专家委员会对指南终稿进行评审、完善和批准。
本指南已在国际实践指南注册平台(Practice Guideline Registration for Transparency,PREPARE;http://guidelines-registry.org)进行双语注册(注册号:PREPARE-2023CN167)。
本指南主要供综合医疗机构相关临床科室的医生在工作中参考使用。指南发布后将通过学术会议交流、医学网站及公众号宣传、全国范围宣贯培训、简化版指南撰写等多种形式进行传播。
肺结核诊断标准
结核分枝杆菌感染是结核病发病的前提。LTBI是指机体内感染了结核分枝杆菌,但没有发生临床结核病,没有临床细菌学或者影像学方面活动性结核病的证据[6]。
肺结核指发生在肺组织、气管、支气管和胸膜的结核病变,85%以上的结核病为肺结核[7]。肺结核的诊断是以病原学检测为主,结合流行病学史、临床表现、胸部影像学检查、免疫学检测及鉴别诊断等进行综合分析做出;以病原学、病理学结果作为确诊依据[8]。肺结核的诊断分为疑似病例、临床诊断病例和确诊病例,见图1。
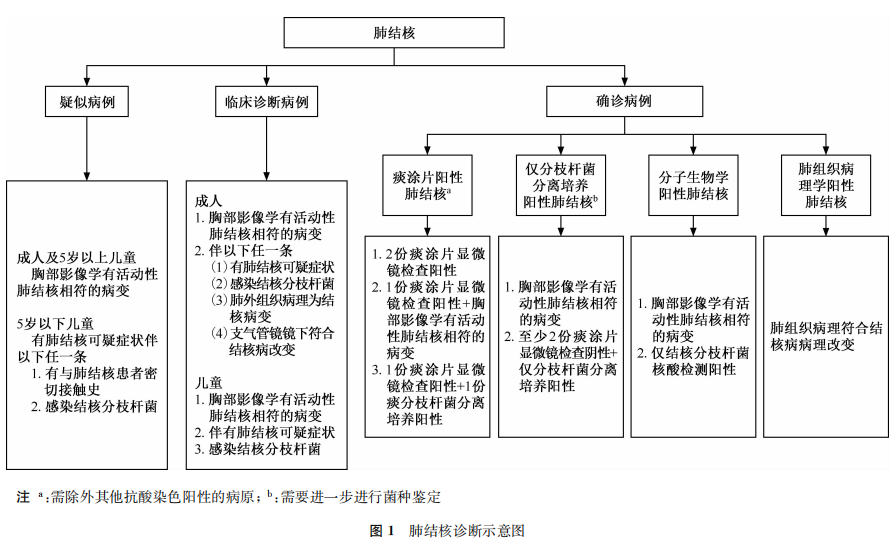
诊断技术
本指南对目前常用的各类肺结核检查和检测技术的优缺点及临床应用范围进行整理,主要包括病原学检测、胸部影像学检查、免疫学检测、病理学检查和支气管镜检查等,临床上应综合考虑不同目标人群,方法的敏感度、特异度和便利性等因素合理选择。
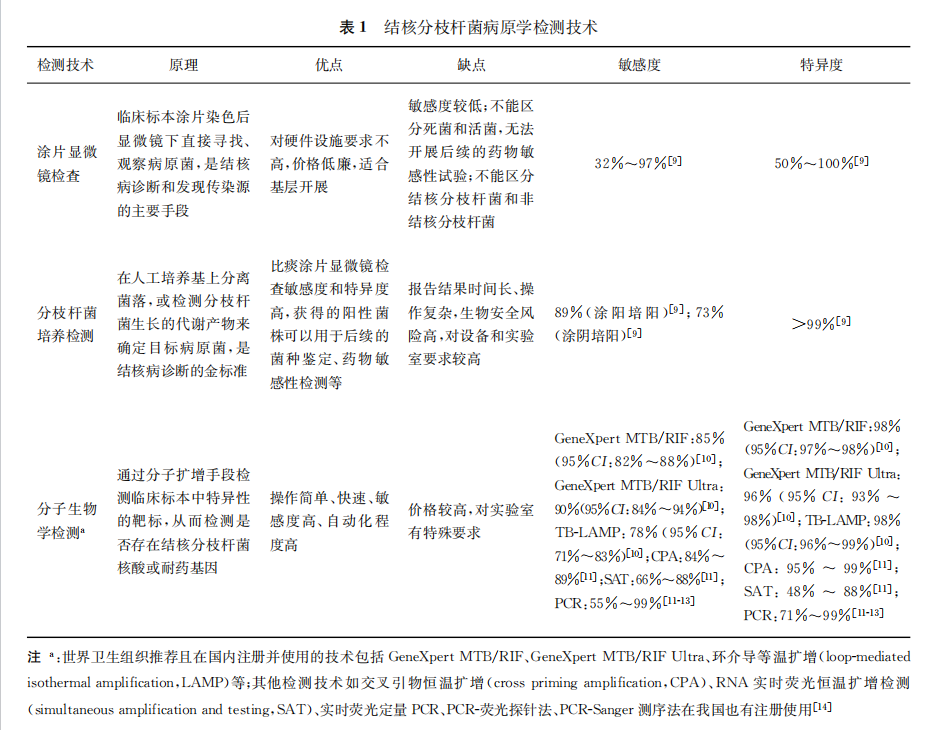
一、病原学检测
肺结核诊断以病原学检测为主。常用的病原学检测方法包括痰涂片显微镜检查、分枝杆菌分离培养检测和分子生物学检测。痰涂片显微镜检查价格低廉、结果报告快、操作简便,但敏感度不高;分枝杆菌分离培养检测敏感度较高,是肺结核实验室诊断的金标准,但检测周期过长;分子生物学技术的时效性优于痰涂片显微镜检查和分枝杆菌分离培养方法,且敏感度高、特异度好。具体见表1。
二、影像学检查
影像学检查是肺结核筛查、诊断、鉴别诊断、疗效评价的重要技术方法,包括胸部X线、胸部CT扫描和胸部超声检查等。胸部X线检查有较高的敏感度,价格便宜,操作简单、快速。胸部CT扫描对病变判别准确度更高。计算机辅助检测软件可通过人工智能识别系统帮助影像科医生初筛结核病相关影像特征。胸部超声检查是结核性胸膜炎首选的影像学检查方法,操作简单、费用低廉、无放射性。
三、免疫学检测
结核病的免疫学检测主要用于结核分枝杆菌感染的诊断,主要包括结核菌素皮肤试验(tuberculin skin test,TST)、结核分枝杆菌特异抗原皮肤试验(Mycobacterium tuberculosis antigen-based skin test,TBST)和γ-干扰素释放试验(interferon-γ release assay,IGRA)。具体见表2。

四、病理学检查
病理学检查是结核病诊断的重要方法,特别是对痰菌阴性肺结核和肺外结核等疑难患者的诊断具有重要价值。传统病理学诊断包括光镜下观察组织学形态特征和抗酸染色查找抗酸杆菌。结核病的组织学形态缺乏特异性,与其他肉芽肿相关疾病鉴别诊断比较困难。抗酸染色阳性率约为30%~40%[18-19]。分子病理技术可将结核病诊断阳性率提高到70%以上,特异度提高到90%以上[20-21]。分子病理技术对人员及硬件要求较高。
五、支气管镜检查
支气管镜检查是肺结核的辅助诊断方法,通过支气管镜可直接观察气道壁及管腔内情况,同时,还可以经支气管镜获取活检、刷检及灌洗等标本进行相关检测,为气管支气管结核、菌阴肺结核、耐药肺结核及纵隔肺门淋巴结结核等诊断提供依据。经气管镜获取的标本较痰标本的阳性检出率显著提高。
肺结核早期发现的目标人群及筛查方式
一、肺结核可疑症状者
(一)目标人群定义
1. 15岁及以上人群:肺结核可疑症状指具有以下3个条件中任一条件:(1)咳嗽、咳痰≥2周;(2)咯血或血痰;(3)咳嗽、咳痰不足2周,且伴有发热、胸痛、盗汗、食欲不振、乏力、体质量减轻中的任一症状。
2. 15岁以下人群:肺结核可疑症状指具有以下3个条件中任一条件:(1)咳嗽≥2周;(2)发热≥2周;(3)过去3个月内体质量增加不明显或体质量减轻。5岁以下儿童肺结核症状不典型,包括持续咳嗽、发热、厌食、体质量增加不明显或体质量减轻、嗜睡、玩耍减少或活动减少。
以上目标人群指未感染HIV或HIV感染状况未知的人群。
(二)目标人群结核病发病证据
2000年全国结核病流行病学抽样调查发现,肺结核可疑症状者(2000年调查时定义:咳嗽、咳痰≥3周或咯血)中痰涂片阳性肺结核检出率为7.08%[22]。2010年全国结核病流行病学抽样调查发现:具有咳嗽<2周、2~3周和≥3周症状的人群中,肺结核检出率分别为0.17%、1.53%和3.13%;具有咯血<2周、2~3周和≥3周症状的人群中,肺结核检出率分别为1.59%、5.56%和5.85%;同时具有咳嗽和咯血<2周、2~3周和≥3周症状的人群中,肺结核检出率分别为1.64%、7.89%和6.58%[23]。2013—2015年我国一项多中心前瞻性队列研究发现,在结核病发病重点人群(65岁及以上老年人、糖尿病患者、HIV感染者/AIDS患者、既往结核病患者及活动性肺结核密切接触者)中,1323例可疑症状者中肺结核检出率为5.29%[24]。
(三)推荐意见
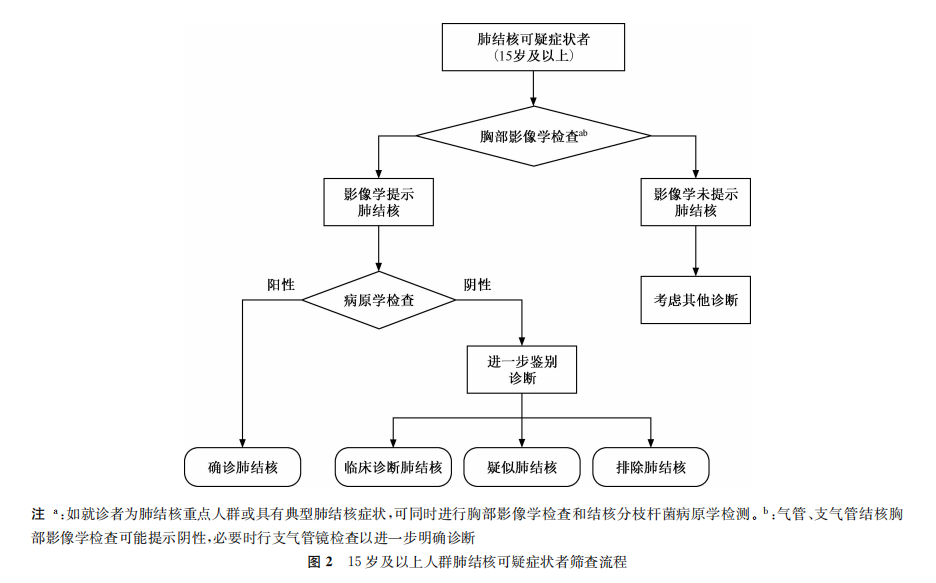
推荐意见1:对具有肺结核可疑症状的15岁及以上人群,进行胸部影像学检查,若存在与肺结核相符的异常表现,进行结核分枝杆菌病原学检测。病原学检测优先推荐结核分枝杆菌分子生物学检测技术,筛查流程见图2。(强烈推荐,高质量证据)
推荐意见2:对具有肺结核可疑症状的15岁以下人群,建议进行结核分枝杆菌病原学检测和免疫学检测。病原学检测优先推荐结核分枝杆菌分子生物学检测技术。若病原学检测结果为阴性但免疫学检测结果为阳性,进行胸部影像学检查。若难以获得合格的痰标本,可采集胃液或粪便标本进行检测。筛查流程见图3。(强烈推荐,中等质量证据)

(四)推荐意见说明
1.对于未感染HIV或HIV感染状况未知的15岁及以上人群:2022年的一项系统综述表明,在未感染HIV或HIV感染状况未知的人群中,2周及以上咳嗽的症状筛查联合胸部影像学筛查的敏感度和特异度分别达到99.2%(95%CI:96.8%~99.8%)和84.9%(95%CI:81.2%~88.1%)[25]。WHO在结核病诊断指南中推荐分子生物学检测作为病原学检测首选技术[26]。对于有结核病症状和体征的患者,同时开展病原学检测和影像学检查,相对于先影像学检查后病原学检测的诊断流程,肺结核检出率更高,但检测成本更高[27]。
2.对于未感染HIV或HIV感染状况未知的15岁以下人群:WHO推荐对于具有肺结核症状的儿童,应优先使用分子生物学检测[28]。由于儿童结核病症状缺乏特异性,大约30%的儿童可能会接受不必要的检测或治疗[29]。因此,应密切监测儿童对治疗的反应,警惕儿童结核病的过度诊疗。
二、胸部影像学提示疑似肺结核患者
(一)目标人群定义
胸部影像学检查显示具有肺结核影像特征的人群。
(二)目标人群结核病发病证据
在2022年开展的基于1992—2021年的37篇相关研究的模型分析结果显示,估计每1000例进行胸部X线摄片(简称“胸片”)检查者中有113例胸片结果异常,其中5例被确诊为肺结核;每1000例中有48例胸片结果提示疑似肺结核,其中4例被确诊为肺结核[25]。国际移民组织于2011—2015年对1 204 569名移民和难民开展胸片检查的结果显示,在63 884例胸片提示“疑似肺结核”的移民和难民中,6.8%被确诊为肺结核[30]。2021年北京市对高中及高中以下学段入学新生开展肺结核筛查的结果显示,在467 088名新生中,发现183例胸片异常者,有7例(4.0%)学生被确诊为活动性肺结核[31]。2022年贵州省毕节市对学生肺结核密切接触者开展筛查的结果显示,在8766名接受筛查的密切接触者中,发现211例胸片异常者,有21例(10%)学生被确诊为肺结核[32]。
(三)推荐意见
推荐意见3:对于15岁及以上人群,当胸部影像学提示疑似肺结核时,要询问肺结核可疑症状,并进行病原学检测,优先推荐分子生物学检测。若病原学检测结果阳性,则可确诊为肺结核;若具有肺结核可疑症状,但病原学检测结果阴性,则为临床诊断肺结核;其他情况需要进一步鉴别诊断。筛查流程见图4。(强烈推荐,高质量证据)

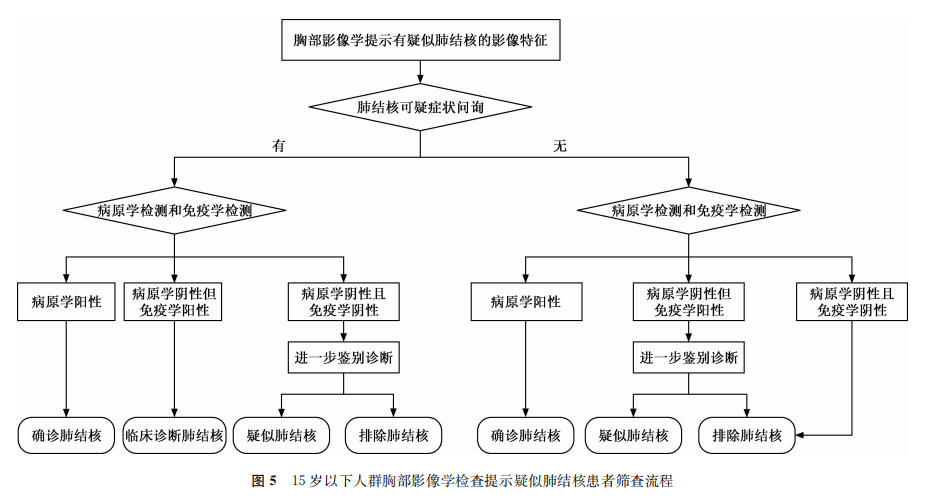
推荐意见4:对于15岁以下人群,当胸部影像学提示疑似肺结核时,要询问肺结核可疑症状,建议进行病原学检测和免疫学检测。病原学检测优先推荐分子生物学技术检测;若难以获得合格的痰标本,可采集胃液或粪便标本进行检测。若病原学检测结果阳性,则可确诊为肺结核;若具有可疑症状且免疫学检测结果阳性,但病原学检测结果阴性,则为临床诊断肺结核;若无可疑症状,且病原学和免疫学检测结果均为阴性,则可暂排除肺结核,其他情况需要进一步鉴别诊断。筛查流程见图5。(强烈推荐,中等质量证据)
(四)推荐意见说明
在结核病患病率高于500/10万的一般人群中,胸片检查发现异常后进行分子生物学检查,能够发现80%的结核病患者,阳性预测值为64.4%,阴性预测值为99.9%[33]。儿童或青少年结核病患者带菌量少,采集儿童胃液或粪便标本,使用更敏感的GeneXpert MTB/RIF Ultra方法进行检测,敏感度为53%~64%,特异度为95%~98%[34]。此外,由于儿童结核病本身和标本的特殊性,免疫学检测在儿童结核病的检测中具有独特价值,不同检测方法的联合检测有助于提高儿童结核病的检出率,因此,应当重视分子生物学和免疫学方法的检测结果[35]。
三、免疫学检测提示结核分枝杆菌感染者
(一)目标人群定义
经TST、TBST、IGRA检测,符合结核分枝杆菌感染诊断标准者。免疫学检测阳性不能区分LTBI、活动性结核病及陈旧性结核病。
在卡介苗接种地区和(或)非结核分枝杆菌感染流行地区,以TST硬结平均直径≥10 mm为结核分枝杆菌感染标准;HIV阳性、接受免疫抑制剂治疗>1个月者,TST硬结平均直径≥5 mm为结核分枝杆菌感染标准[8]。TBST以红晕或硬结平均直径大者为判断标准,平均直径≥5 mm判定为结核分枝杆菌感染。IGRA结果为阳性则判定为结核分枝杆菌感染[8]。
(二)目标人群结核病发病证据
2013年我国5岁及以上人群结核分枝杆菌潜伏感染率为18.1%(95%CI:13.7%~22.4%);15岁及以上人群结核分枝杆菌潜伏感染率为20.34%(95%CI:15.6%~25.1%)[2]。LTBI者如不进行治疗,一生中大约有5%~10%的几率会发展成活动性结核病,通常发生在初次感染后的前5年内。部分人群因各种原因导致免疫功能低下,其发展为活动性结核病的几率数倍或数十倍于普通人群[36]。
2020年一篇系统综述评价了TST和IGRA预测高危人群发生活动性结核病的能力。TST的阳性预测值为2.3%(95%CI:1.5%~3.1%),阴性预测值为99.3%(95%CI:99.0%~99.5%);TST阳性人群发生活动性结核病的风险是TST阴性人群的4.24倍(95%CI:3.30~5.46)。对TST和IGRA进行平行比较,TST 5 mm、TST 10 mm和IGRA的阳性预测值分别为1.3%(95%CI:0.1%~3.7%)、1.8%(95%CI:0.8%~3.1%)和4.2%(95%CI:2.5%~6.3%);TST 5 mm、TST 10 mm和IGRA的阴性预测值分别为99.1%(95%CI:96.8%~100%)、99.2%(95%CI:98.6%~99.6%)和99.4%(95%CI:98.8%~99.8%)[37]。
(三)推荐意见
推荐意见5:对免疫学检测提示结核分枝杆菌感染者应开展肺结核可疑症状筛查及影像学检查。对有肺结核可疑症状、胸部影像学提示疑似肺结核患者,参照推荐意见1~4开展后续检查。(强烈推荐,中等质量证据)
推荐意见6:免疫学检测结果为阳性时,如胸部影像学检查排除活动性肺结核可能,且没有肺外结核的相关临床表现,可诊断为结核分枝杆菌潜伏感染,根据患者近期暴露及免疫受损情况判定是否给予预防性抗结核治疗。通常无需重复进行免疫学检测,亦不建议通过复查免疫学检测判定治疗效果。(强烈推荐,中等质量证据)
(四)推荐意见说明
目前推荐的预防性抗结核治疗方案可降低结核病发病率的60%~90%[36]。通过预防性抗结核治疗来预防活动性结核病是WHO“终止结核病流行”策略的重要组成部分。WHO推荐以下人群应接受预防性抗结核治疗,包括:HIV感染者,病原学阳性肺结核患者家庭密切接触者,接受肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)抑制剂治疗的患者,以及血液透析、骨髓移植、实体器官移植、矽肺、口服糖皮质激素治疗的患者等[36]。
目前的免疫学检测方法均是基于宿主对体内结核分枝杆菌抗原产生的持续性适应性免疫反应这一原理。通常情况下,宿主免疫状态不会短期内发生显著变化,适应性免疫获得后效应T淋巴细胞将在较长一段时间存在于体内[38],因此,不推荐短期内重复进行免疫学检测,亦不推荐以免疫学检测结果作为预防性治疗效果评价的指标。从成本效益比看,IGRA单用比TST联合IGRA检测具有更高的成本效益[39]。
四、不明原因发热(fever of unknown origin,FUO)患者
(一)目标人群定义
FUO是指发热时间持续≥3周,体温多次>38.3 ℃,经≥1周完整的病史询问、体格检查和常规实验室检查后仍不能确诊的临床情况。
(二)目标人群结核病发病证据
我国2家综合医院于2000—2010年间对近1700例FUO患者的研究显示,FUO的病因以感染性疾病为主(39%~49%),感染性疾病中结核病所占比例最高(30.3%~48.7%)[40-43]。一项对土耳其1990—2006年857例FUO患者的系统综述显示,感染性疾病占FUO病因的47%,其中结核病占36.4%[44]。
(三)推荐意见
推荐意见7:对不明原因发热患者应进行结核分枝杆菌感染免疫学检测和病原学检测等。对结核分枝杆菌感染免疫学检测阳性的不明原因发热患者,应积极寻找肺结核或肺外结核病灶,以获取相应部位临床标本或组织标本进行病原学检测和(或)病理检查。结核分枝杆菌感染免疫学检测阴性的不明原因发热患者,若不存在高龄、低体质量指数、营养不良、免疫抑制状态等导致假阴性的临床情况,可基本排除结核病的可能。(强烈推荐,低质量证据)
(四)推荐意见说明
引起FUO的病因有200多种,应谨慎、仔细评估病史采集、体格检查、实验室和影像学检查中收集的信息。病史采集和体格检查可初步提供一些指向诊断的局部症状和体征。目前,建立一个统一的FUO的诊断流程是较为困难的。针对每例患者,临床医生应该结合既往诊治经验,进行个体化评估。
表现为FUO的结核病诊断较为困难,病因包括肺结核、肺外结核或两者同时存在,因累及部位不同,伴随症状各异,从发病到诊断的时间为3~77周,中位时间为14周。诊断依据方面,病原学诊断比例不高(约30%),相当一部分患者需结合免疫学检测及其他检查结果,或通过诊断性抗结核治疗效果做出诊断[44]。
IGRA、TBST均具有较高特异度,多在95%以上,相较于TST高出33.47%。在卡介苗接种人群中,这种差异进一步扩大至67.39%[36]。在预测高风险人群发展为活动性结核病的研究中,TST 5 mm、TST 10 mm和IGRA的阴性预测值分别为99.1%(95%CI:96.8%~100.0%)、99.2% (95%CI:98.6%~99.6%)和99.4%(95%CI:98.8%~99.8%)[44];即:免疫学检测阴性时,如为免疫功能正常者,可基本排除结核病。
五、病因不明的胸腔积液患者
(一)目标人群定义
影像学检查提示胸腔积液且病因不明的患者。
(二)目标人群结核病发病证据
结核性胸膜炎是我国胸腔积液最常见的病因之一。我国2018年进行的一项包括50个城市56家综合医院的横断面调查显示,24 711例成人胸腔积液住院患者中,结核性胸膜炎占12.3%,按年龄分组后在18~39岁胸腔积液患者中,结核性胸膜炎是最常见的病因[45]。来自北京6家综合医院呼吸科以胸腔积液为主要表现的住院患者中,结核性胸膜炎占49.6%(331/668)[46]。一项通过内科胸腔镜对渗出性胸腔积液的病因进行诊断的研究中,结核性胸膜炎占47%(73/156)[47]。
(三)推荐意见
推荐意见8:对疑似结核性胸膜炎患者的胸腔积液在常规检查的同时,开展结核分枝杆菌病原学检测,优先选择分子生物学检测。(强烈推荐,低质量证据)
推荐意见9:在胸腔积液结核分枝杆菌病原学检测阴性或无法获得时,推荐使用腺苷脱氨酶(adenosine deaminase,ADA)诊断结核性胸膜炎。以淋巴细胞为主的渗出性胸腔积液且ADA≥40 U/L可诊断结核性胸膜炎,但要除外可引起ADA增高的其他临床疾病。对于诊断困难的疑诊结核性胸膜炎患者,推荐进行胸膜活检术。(有条件推荐,低质量证据)
影像学提示胸腔积液且病因未明患者结核性胸腔积液筛查流程见图6。
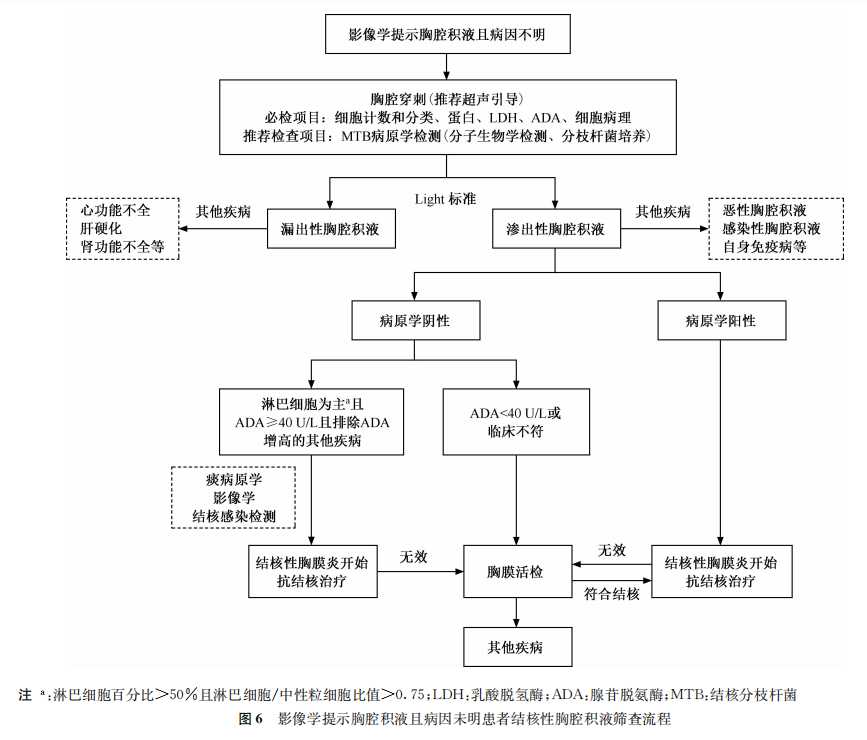
(四)推荐意见说明
胸腔积液或胸膜组织结核分枝杆菌病原学阳性具有确诊价值,胸腔积液涂片抗酸杆菌染色的阳性率在未感染HIV的患者中仅为0~5.5%[48-52];胸腔积液分枝杆菌液体培养的敏感度高于固体培养,分别是24.0%~63.0%[52-54]和7.0%~58.0%[48-49,55];胸膜组织的分枝杆菌培养敏感度为30.2%~71.0%[48,53,55-57];基于Meta分析的全自动GeneXpert MTB/RIF在结核性胸膜炎中以培养阳性为参考标准,诊断的敏感度为49.5%,特异度为98.9%;以临床综合指标为参考标准,诊断的敏感度为18.9%,特异度为98.9%[58];新一代GeneXpert MTB/RIF Ultra在确诊的结核性胸膜炎中诊断的敏感度为63.3%,在临床诊断的结核性胸膜炎中诊断的敏感度为19.8%,特异度为98.8%[52]。
典型的结核性胸腔积液为单侧少-中量稻草色淋巴细胞为主的渗出液,淋巴细胞为主指淋巴细胞百分比>50%且淋巴细胞/中性粒细胞比值>0.75[59]。胸腔积液ADA水平用于诊断结核性胸膜炎有很高的准确率,其被广泛认可的诊断界值为ADA≥40 U/L,Meta分析汇总的敏感度为93%,特异度为90%[60]。ADA增高还可见于多种非结核性胸腔积液,如复杂肺炎旁积液,细菌性脓胸、淋巴瘤、胸膜间皮瘤、胸膜转移性肿瘤、类风湿相关胸腔积液等。临床上需要结合其他化验或进行胸膜活检以明确。
胸膜活检组织病理呈现典型的干酪样肉芽肿有助于诊断结核性胸膜炎[61-62]。超声引导下胸膜活检侵入性小、经济、易开展[62]。胸腔镜可以直视下观察胸膜病变和有目的地获取胸膜组织,是诊断结核性胸膜炎和不明原因胸腔积液的最好方法[63]。
六、肺结核重点人群
(一)目标人群定义
本指南的重点人群系指HIV感染者/AIDS患者、非HIV免疫抑制人群、终末期肾脏病患者、矽肺患者、肺结核患者密切接触者及糖尿病患者。
其中,本指南将非HIV免疫抑制人群定义为至少包含下述一条判定标准:接受皮质类固醇激素治疗(强的松≥20 mg/d持续14 d或强的松累积治疗剂量超过600 mg,或其他等效方案)、罹患血液系统或实体脏器恶性肿瘤、实体器官移植受者、造血干细胞移植受者、存在原发性免疫缺陷病、接受TNF-α抑制剂或其他免疫抑制药物[64-65]。肺结核患者密切接触者是指与肺结核患者确诊前3个月至启动抗结核治疗后14 d内共享同一封闭空间的人。
(二)目标人群结核病发病证据
结核病是HIV感染者/AIDS患者最常见的机会性感染和主要死因,而HIV感染也是导致结核病发病和治疗失败的重要影响因素。据估算,HIV感染者结核病的患病率约是未感染者的18倍(95%CI:15~21)[66]。一项荟萃分析纳入了来自34个国家的46项队列研究,结果显示,儿童中HIV感染者/AIDS患者罹患活动性结核病的可能性是未感染者的3.5倍[67]。一项纳入3237例AIDS死亡患者尸检结果的荟萃分析发现,37.2%(95%CI:25.7%~48.7%)的死因可归因于肺结核,而其中45.8%(95%CI:32.6%~59.1%)的患者在死亡前未被确诊为肺结核[68]。
研究表明,应用TNF-α拮抗剂的人群罹患结核病风险为普通人群的12倍(RR =12.2,95%CI:9.7~15.5)[69]。实体器官移植者结核病发病率为普通人群的26.6倍[70],肾移植受者结核病发病率为普通人群的11.4倍(95%CI:3.0~43.4)[71],造血干细胞移植受者结核病发病率为普通人群的10~40倍[72]。终末期肾脏病患者活动性结核病的患病风险是一般人群的3倍[71],接受透析治疗的终末期肾脏病患者结核病累积并发率为1.2%~28.0%,为一般人群的6.9~52.5倍[73]。肺结核患者密切接触者中活动性肺结核的检出率为7.8%(95%CI:5.6%~10.0%),LTBI的检出率为47.2%(95%CI:30.0%~61.4%)[74]。对低收入人群肺结核患者密切接触者的研究显示,其活动性结核病检出率为3.1%(95%CI:2.2%~4.4%)[75]。矽肺患者较一般人群罹患结核病的相对风险为4.01(95%CI:2.88~5.58)[70,76],接触二氧化硅而并未诊断为矽肺的患者也是结核病患病高风险人群,二氧化硅暴露史可使其罹患肺结核的风险升高2.8~39.0倍[77]。
我国成人糖尿病患病率约为11.2%[78]。罹患糖尿病增加结核病发病风险( RR =3.11,95%CI:2.27~4.26)[79];合并糖尿病的肺结核患者更易出现空洞性病变,伴有更高的细菌负荷,提示更具有传染性[80]。糖尿病也是影响结核病治疗效果的危险因素之一,合并糖尿病的肺结核患者治疗强化期结束后痰菌阴转率明显低于未合并糖尿病者[81-83]。
(三)推荐意见
推荐意见10:对HIV感染者/AIDS患者、非HIV感染免疫抑制人群、终末期肾脏病患者和矽肺患者等肺结核重点人群推荐开展结核分枝杆菌感染检测和结核病筛查,包括结核病症状、胸部影像学、免疫学检测。对诊断为结核分枝杆菌潜伏感染者进行预防性抗结核治疗。随访时需注意症状筛查,对无症状者推荐每年进行一次胸部影像学检查,如存在肺结核可疑症状或影像学不能排除肺结核,参照推荐意见1~4。(强烈推荐,中等质量证据)
推荐意见11:对肺结核患者密切接触者推荐开展结核分枝杆菌感染检测和结核病筛查,包括结核病症状、胸部影像学、免疫学检测。对诊断为结核分枝杆菌潜伏感染者进行预防性抗结核治疗。在肺结核患者确诊的第6、12和24个月时,对其密切接触者进行结核病症状筛查和胸部影像学检查。(强烈推荐,中等质量证据)
推荐意见12:对糖尿病患者首次诊断时推荐进行结核病症状筛查和胸部影像学检查,随访时需注意症状筛查,对无症状者推荐每年进行一次胸部影像学检查,如存在肺结核可疑症状或影像学不能排除肺结核,参照推荐意见1~4。(有条件推荐,低质量证据)
注:推荐意见中所提及的胸部影像学检查适用于15岁及以上人群。
(四)推荐意见说明
一项荟萃分析发现,在接受抗逆转录病毒疗法(antiretroviral therapy,ART)的HIV感染者/AIDS患者中单独使用四症状筛查(包括咳嗽、发热、盗汗及体质量减轻)的敏感度为51.0%(95%CI:28.4%~73.2%),特异度为70.7%(95%CI:47.8%~86.4%);在未接受ART的HIV感染者/AIDS患者中单独使用四症状筛查的敏感度为89.4%(95%CI:83.0%~93.5%),特异度为28.1%(95%CI:18.6%~40.1%)。对接受ART的HIV感染者/AIDS患者开展可疑症状筛查与胸部影像学检查的敏感度为84.6%(95%CI:69.7%~92.9%),特异度为29.8%(95%CI:26.3%~33.6%);对未接受ART的HIV感染者/AIDS患者同时开展可疑症状筛查与胸部影像学检查,敏感度为94.3%(95%CI:76.2%~98.8%),特异度为20.1%(95%CI:7.6%~43.8%)[84]。韩国开展的一项回顾性研究纳入2009年新诊断为2型糖尿病的331 601例患者,3年随访期间新诊断肺结核1533例(0.46%),其中,647例(42.2%)在随访的第1年内确诊[85]。一项涵盖4个国家的回顾性研究发现,在2063例2型糖尿病患者中,通过筛查新检出14例肺结核患者,其中13例基于症状筛查检出[86]。一项纳入了25项研究的荟萃分析显示,大多数肺结核继发病例在指示病例确诊的1年内被发现,且大部分患者的药物敏感性试验结果与指示病例一致[74]。另一项荟萃分析纳入了95项来自中低收入国家的研究,结果表明,家庭密切接触者的肺结核患病率为3.1%(95%CI:2.1%~4.5%),在暴露后的第1年内患病率最高,约为1.5%[75]。
指南的局限性及进一步研究方向
本指南是以WHO相关指南、我国结核病防治工作技术规范及国内外研究进展和经验总结为基础制定而成,对于某些特定目标人群的筛查方式及流程、不同筛查策略,以及不同技术措施组合的筛查效率、近远期影响及其卫生经济学评价等方面循证依据较少。未来需要进一步研究的内容包括:(1)评估在综合医疗机构不同目标人群中进行肺结核筛查的效果,使目标人群更精准,筛查更具成本效益;(2)比较不同筛查方式、筛查流程的敏感度、特异度,以及在不同目标人群中应用的社会经济学数据;(3)研究在综合医疗机构开展常规结核病早期筛查对于全国结核病防治成效的近期及远期影响。
各级综合医疗机构在按照本指南推荐的策略开展肺结核患者筛查时,需结合本地区和本医疗机构的实际进行优化,并在实践中开展评估,为进一步修订和完善我国综合医疗机构肺结核早期发现策略提供新的研究证据。
doi:10.19982/j.issn.1000-6621.20230428.
基金项目:北京结核病综合防控关键技术研究(D181100000418005);传染病智慧化多点触发预警技术研究(2021-I2M-1-044)
作者:国家呼吸内科医疗质量控制中心;中华医学会结核病学分会;中国防痨协会结核病控制专业分会;中日友好医院
通信作者: 李燕明,Email:lymyl@263.com;刘宇红,Email:liuyuhong0516@126.com;张慧,Email:zhanghui@chinacdc.cn;曹彬,Email:caobin_ben@163.com
指南制定工作组成员 张慧、成君、张灿有(中国疾病预防控制中心结核病预防控制中心);王黎霞、李敬文、范永德、郭萌(《中国防痨杂志》期刊社);沈鑫、陈静(上海市疾病预防控制中心);刘宇红、高孟秋、杨新婷、张立杰、李志丽(首都医科大学附属北京胸科医院);曹彬、崔晓敬(中日友好医院);李燕明、方创森(北京医院)
外部评议专家组成员 刘海涛(国家疾病预防控制局传染病防控司艾滋病结核病管理处);刘剑君(中国防痨协会);李晓北、杜建、逄宇、侯代伦(首都医科大学附属北京胸科医院);李仁忠(中国疾病预防控制中心结核病预防控制中心);林明贵(北京清华长庚医院);吕平欣(北京老年医院);王政(首都医科大学附属北京朝阳医院);陈余清(蚌埠医学院第一附属医院);周琳(广东省人民医院);李时悦(广州医科大学附属第一医院);房宏霞(深圳市龙华区慢性病防治中心);黄陆颖(广西壮族自治区人民医院);张湘燕(贵州省人民医院);蔡志刚(河北医科大学第二医院);张晓菊(河南省人民医院);陈宏(哈尔滨医科大学附属第二医院);于艳玲(黑龙江省防痨协会);刘辉国(华中科技大学同济医学院附属同济医院);王卫华(武汉市中心医院);李园园(中南大学湘雅医院);黄建安(苏州大学附属第一医院);张伟(南昌大学第一附属医院);李玉苹(温州医科大学附属第一医院);郭述良(重庆医科大学附属第一医院);高谦(复旦大学);王玮(中国医科大学附属第一医院);施熠炜(山西医科大学第一医院);杨拴盈(西安交通大学第二附属医院);宋元林(复旦大学附属中山医院);刘丹(四川大学华西医院);吴琦(天津市海河医院);贾斌(新疆医科大学第一附属医院);张云辉(云南省第一人民医院)
参考文献
[1] World Health Organization. Global tuberculosis report 2023. Geneva: World Health Organization, 2023.
[2] 高磊, 张慧, 胡茂桂, 等. 基于多中心调查数据和空间统计模型的全国结核分枝杆菌潜伏感染率估算. 中国防痨杂志, 2022, 44(1): 54-59. doi:10.19982/j.issn.1000-6621.20210661.
[3] Zhang L, Weng TP, Wang HY, et al. Patient pathway analysis of tuberculosis diagnostic delay: a multicentre retrospective cohort study in China. Clin Microbiol Infect, 2021, 27(7): 1000-1006. doi:10.1016/j.cmi.2020.12.031.
[4] 国家卫生健康委员会. 2021年中国卫生健康统计年鉴. 北京: 中国协和医科大学出版社, 2021.
[5] Du X, Li T, Liu X, et al. Health Facilities and Treatment Service Models of the National Tuberculosis Program-China, 2010—2020. China CDC Wkly, 2021, 3(13): 274-278. doi:10.46234/ccdcw2021.071.
[6] 中华人民共和国国家卫生和计划生育委员会. WS 196—2017 结核病分类. 2017-11-09.
[7] 医学名词审定委员会结核病学名词审定分委员会. 结核病学名词. 北京: 科学出版社, 2019.
[8] 中华人民共和国国家卫生和计划生育委员会. WS 288—2017 肺结核诊断. 2017-11-09.
[9] Pai M, Behr MA, Dowdy D, et al. Tuberculosis. Nat Rev Dis Primers, 2016, 2: 16076. doi:10.1038/nrdp.2016.76.
[10] World Health Organization. WHO operational handbook on tuberculosis. Module 3: Diagnosis-Rapid diagnostics for tuberculosis detection, 2021 update. Geneva: World Health Organization 2021.
[11] Deng S, Sun Y, Xia H, et al. Accuracy of Commercial Molecular Diagnostics for the Detection of Pulmonary Tuberculosis in China: A Systematic Review. Sci Rep, 2019, 9(1): 4553. doi:10.1038/s41598-019-41074-8.
[12] Deng Y, Ma Z, Su B, et al. Accuracy of the InnowaveDX MTB/RIF test for detection of Mycobacterium tuberculosis and rifampicin resistance: a prospective multicentre study. Emerg Microbes Infect, 2023, 12(1): 2151382. doi:10.1080/22221751.2022.2151382.
[13] 王艳萍, 谭云洪, 李欣, 等. InnowaveDX MTB/RIF对结核分枝杆菌复合群及利福平耐药检测性能评估. 中华结核和呼吸杂志, 2023, 46(7): 658-663. doi:10.3760/cma.j.cn112147-20221104-00877.
[14] 中华医学会结核病学分会临床检验专业委员会. 结核病病原学分子诊断专家共识. 中华结核和呼吸杂志, 2018, 41(9): 688-695. doi:10.3760/cma.j.issn.1001-0939.2018.09.008.
[15] 郭同磊, 曹雪芳, 高磊. 《结核分枝杆菌重组蛋白皮肤试验操作规范》解读. 中国防痨杂志, 2023, 45(2): 130-133. doi:10.19982/j.issn.1000-6621.20220407.
[16] World Health Organization. WHO operational handbook on tuberculosis. Module 3: Diagnosis-Tests for tuberculosis infection. Geneva: World Health Organization, 2021.
[17] Krutikov M, Faust L, Nikolayevskyy V, et al. The diagnostic performance of novel skin-based in-vivo tests for tuberculosis infection compared with purified protein derivative tuberculin skin tests and blood-based in vitro interferon-γ release assays: a systematic review and meta-analysis. Lancet Infect Dis, 2022, 22(2): 250-264. doi:10.1016/s1473-3099(21)00261-9.
[18] 张登才, 刘斌, 张丽华, 等. 抗酸染色在结核病病理诊断中的价值. 中国防痨杂志, 2014, 36(4): 274-278.
[19] 孙亚欣, 张志超, 董美玲, 等. 108例结核病变组织抗酸染色结果分析. 中国实验诊断学, 2011, 15(9): 1586-1587. doi:10.3969/j.issn.1007-4287.2011.09.064.
[20] 郝颖华, 罗森源, 汤显斌. 即时荧光定量PCR法对石蜡包埋组织中结核杆菌的检测价值探究. 中华病理学杂志, 2020, 49(10): 1068-1070. doi:10.3760/cma.j.cn112151-20200327-00263.
[21] 方木通, 杨倩婷, 王仲元, 等. 病理组织中的病原学检查对结核病的诊断价值.中华传染病杂志, 2021, 39(2): 92-96. doi:10.3760/cma.j.cn311365-20191124-00391.
[22] 杨华林, 王黎霞, 端木宏谨, 等. 利用症状者检查作为肺结核患病率调查方法的研究. 中国防痨杂志, 2004, 26(2): 81-83. doi:10.3969/j.issn.1000-6621.2004.02.006.
[23] Cheng J, Wang L, Zhang H, et al. Diagnostic value of symptom screening for pulmonary tuberculosis in China. PLoS One, 2015, 10(5): e0127725. doi:10.1371/journal.pone.0127725.
[24] 张慧, 成君, 于艳玲, 等. 基于社区的重点人群肺结核主动发现干预效果评价:多中心前瞻性队列研究. 中国防痨杂志, 2021, 43(12): 1248-1259. doi:10.3969/j.issn.1000-6621.2021.12.005.
[25] Van’t Hoog A, Viney K, Biermann O, et al. Symptom- and chest-radiography screening for active pulmonary tuberculosis in HIV-negative adults and adults with unknown HIV status. Cochrane Database Syst Rev, 2022, 3(3): CD010890. doi:10.1002/14651858.CD010890.pub2.
[26] World Health Organization. WHO consolidated guidelines on tuberculosis: Module 3: diagnosis-rapid diagnostics for tuberculosis detection. Geneva: World Health Organization, 2020.
[27] Van’t Hoog AH, Onozaki I, Lonnroth K. Choosing algorithms for TB screening: a modelling study to compare yield, predictive value and diagnostic burden. BMC Infect Dis, 2014, 14: 532. doi:10.1186/1471-2334-14-532.
[28] World Health Organization. WHO consolidated guidelines on tuberculosis: Module 5: Management of tuberculosis in children and adolescents. Geneva: World Health Organization, 2022.
[29] Vonasek B, Ness T, Takwoingi Y, et al. Screening tests for active pulmonary tuberculosis in children. Cochrane Database Syst Rev, 2021, 6(6): CD013693. doi:10.1002/14651858.CD013693.pub2.
[30] World Health Organization. Chest radiography in tuberculosis detection: summary of current WHO recommendations and guidance on programmatic approaches. Geneva: World Health Organization, 2016.
[31] 陶荔莹, 徐征, 赵鑫, 等. 2021年北京市高中及以下学段入学新生肺结核筛查结果分析. 中国防痨杂志, 2023, 45(1): 111-115. doi:10.19982/j.issn.1000-6621.20220308.
[32] 汪犇, 陈玮, 李进岚, 等. 贵州省毕节市学生肺结核密切接触者筛查结果分析. 中国预防医学杂志, 2023, 24(9): 906-911. doi:10.16506/j.1009-6639.2023.09.005.
[33] World Health Organization. WHO consolidated guidelines on tuberculosis: Module 2: screening-systematic screening for tuberculosis disease. Geneva: World Health Organization, 2021.
[34] World Health Organization. WHO operational handbook on tuberculosis: module 5: management of tuberculosis in children and adolescents. Geneva: World Health Organization, 2022.
[35] 吕纯阳, 罗晶晶, 石华, 等. 儿童结核病的实验室诊断现状与进展. 中国防痨杂志, 2020, 42(2): 178-184. doi:10.3969/j.issn.1000-6621.2020.02.018.
[36] World Health Organization. WHO consolidated guidelines on tuberculosis: tuberculosis preventive treatment: module 1: prevention. Geneva: World Health Organization, 2020.
[37] Zhou G, Luo Q, Luo S, et al. Interferon-γ release assays or tuberculin skin test for detection and management of latent tuberculosis infection: a systematic review and meta-analysis. Lancet Infect Dis, 2020, 20(12): 1457-1469. doi:10.1016/s1473-3099(20)30276-0.
[38] Goletti D, Delogu G, Matteelli A, et al. The role of IGRA in the diagnosis of tuberculosis infection, differentiating from active tuberculosis, and decision making for initiating treatment or preventive therapy of tuberculosis infection. Int J Infect Dis, 2022, 124 Suppl 1: S12-S19. doi:10.1016/j.ijid.2022.02.047.
[39] Sousa S, Rocha D, Silva JC, et al. Comparing the cost-effectiveness of two screening strategies for latent tuberculosis infection in Portugal. Pulmonology, 2021, 27(6): 493-499. doi:10.1016/j.pulmoe.2021.04.002.
[40] 《中华传染病杂志》编辑委员会. 发热待查诊治专家共识. 中华传染病杂志, 2017, 35(11): 641-655. doi:10.3760/cma.j.issn.1000-6680.2017.11.001.
[41] 马锦玲, 刘宏伟, 程友琴, 等. 不明原因发热689例病因分析. 疑难病杂志, 2010, 9(8): 587-589. doi:10.3969/j.issn.1671-6450.2010.08.014.
[42] 段文利. 不明原因发热病因变迁图绘出:结核病始终位列病因首位未获明确诊断比例明显上升. 协和医学杂志, 2013, 4(2):122.
[43] 侍效春, 刘晓清, 李侠, 等. 综合医院以不明原因发热为表现的结核病100例临床分析. 中华内科杂志, 2010, 49(12): 1002-1005. doi:10.3760/cma.j.issn.0578-1426.2010.12.004.
[44] Kaya A, Ergul N, Kaya SY, et al. The management and the diagnosis of fever of unknown origin. Expert Rev Anti Infect Ther, 2013, 11(8): 805-815. doi:10.1586/14787210.2013.814436.
[45] Tian P, Qiu R, Wang M, et al. Prevalence, Causes, and Health Care Burden of Pleural Effusions Among Hospitalized Adults in China. JAMA Netw Open, 2021, 4(8): e2120306. doi:10.1001/jamanetworkopen.2021.20306.
[46] 孙永昌, 王广发, 胡红, 等. 北京市部分医院胸腔积液诊断状况调查. 中华结核和呼吸杂志, 2001, 24(2): 124-125. doi:10.3760/j:issn:1001-0939.2001.02.029.
[47] Christopher DJ, Dinakaran S, Gupta R, et al. Thoracoscopic pleural biopsy improves yield of Xpert MTB/RIF for diagnosis of pleural tuberculosis. Respirology, 2018, 23(7): 714-717. doi:10.1111/resp.13275.
[48] Valdés L, Alvarez D, San José E, et al. Tuberculous pleurisy: a study of 254 patients. Arch Intern Med, 1998, 158(18): 2017-2021. doi:10.1001/archinte.158.18.2017.
[49] 杨新婷, 关国英, 王亚红, 等. 结核性胸膜炎的临床特征及诊断技术分析. 中国防痨杂志, 2017, 39(11): 1162-1168. doi:10.3969/j.issn.1000-6621.2017.11.003.
[50] Ko Y, Kim C, Chang B, et al. Loculated Tuberculous Pleural Effusion: Easily Identifiable and Clinically Useful Predictor of Positive Mycobacterial Culture from Pleural Fluid. Tuberc Respir Dis (Seoul), 2017, 80(1): 35-44. doi:10.4046/trd.2017.80.1.35.
[51] Bielsa S, Acosta C, Pardina M, et al. Tuberculous Pleural Effusion: Clinical Characteristics of 320 Patients. Arch Bronconeumol (Engl Ed), 2019, 55(1): 17-22. doi:10.1016/j.arbres.2018.04.014.
[52] Wang G, Wang S, Yang X, et al. Accuracy of Xpert MTB/RIF Ultra for the Diagnosis of Pleural TB in a Multicenter Cohort Study. Chest, 2020, 157(2): 268-275. doi:10.1016/j.chest.2019.07.027.
[53] Ruan SY, Chuang YC, Wang JY, et al. Revisiting tuberculous pleurisy: pleural fluid characteristics and diagnostic yield of mycobacterial culture in an endemic area. Thorax, 2012, 67(9): 822-827. doi:10.1136/thoraxjnl-2011-201363.
[54] Yang X, Chen N, Duan H, et al. Cell-free Mycobacterium tuberculosis DNA test in pleural effusion for tuberculous pleurisy: a diagnostic accuracy study. Clin Microbiol Infect, 2020, 26(8): 1089.e1-1089.e6. doi:10.1016/j.cmi.2019.11.026.
[55] Seibert AF, Haynes J Jr, Middleton R, et al. Tuberculous pleural effusion. Twenty-year experience. Chest, 1991, 99(4): 883-886. doi:10.1378/chest.99.4.883.
[56] Maartens G, Bateman ED. Tuberculous pleural effusions: increased culture yield with bedside inoculation of pleural fluid and poor diagnostic value of adenosine deaminase. Thorax, 1991, 46(2): 96-99. doi:10.1136/thx.46.2.96.
[57] 张芸, 姜广路, 王冲, 等. 经内科胸腔镜胸膜病变活检对结核性胸膜炎的诊断价值. 中国防痨杂志, 2020, 42(11): 1158-1164. doi:10.3969/j.issn.1000-6621.2020.11.004.
[58] Kohli M, Schiller I, Dendukuri N, et al. Xpert MTB/RIF Ultra and Xpert MTB/RIF assays for extrapulmonary tuberculosis and rifampicin resistance in adults. Cochrane Database Syst Rev, 2021, 1(1): CD012768. doi:10.1002/14651858.CD012768.pub3.
[59] Villena V, López-Encuentra A, García-Luján R, et al. Clinical implications of appearance of pleural fluid at thoracentesis. Chest, 2004, 125(1): 156-159. doi:10.1378/chest.125.1.156.
[60] Aggarwal AN, Agarwal R, Sehgal IS, et al. Adenosine deami-nase for diagnosis of tuberculous pleural effusion: A systematic review and meta-analysis. PLoS One, 2019, 14(3): e0213728. doi:10.1371/journal.pone.0213728.
[61] Lewinsohn DM, Leonard MK, LoBue PA, et al. Official American Thoracic Society/Infectious Diseases Society of America/Centers for Disease Control and Prevention Clinical Practice Guidelines: Diagnosis of Tuberculosis in Adults and Children. Clin Infect Dis, 2017, 64(2): 111-115. doi:10.1093/cid/ciw778.
[62] Koegelenberg CF, Irusen EM, von Groote-Bidlingmaier F, et al. The utility of ultrasound-guided thoracentesis and pleural biopsy in undiagnosed pleural exudates. Thorax, 2015, 70(10): 995-997. doi:10.1136/thoraxjnl-2014-206567.
[63] Diacon AH, Van de Wal BW, Wyser C, et al. Diagnostic tools in tuberculous pleurisy: a direct comparative study. Eur Respir J, 2003, 22(4): 589-591. doi:10.1183/09031936.03.00017103a.
[64] Ramirez JA, Musher DM, Evans SE, et al. Treatment of Community-Acquired Pneumonia in Immunocompromised Adults: A Consensus Statement Regarding Initial Strategies. Chest, 2020, 158(5): 1896-1911. doi:10.1016/j.chest.2020.05.598.
[65] Santín Cerezales M, Navas Elorza E. Tuberculosis in special populations. Enferm Infecc Microbiol Clin, 2011, 29 Suppl 1: 20-25. doi:10.1016/s0213-005x(11)70014-3.
[66] World Health Organization. Global tuberculosis report 2001. Geneva: World Health Organization, 2001.
[67] Martinez L, Cords O, Horsburgh CR, et al. The risk of tuberculosis in children after close exposure: a systematic review and individual-participant meta-analysis. Lancet, 2020, 395(10228): 973-984. doi:10.1016/s0140-6736(20)30166-5.
[68] Gupta RK, Lucas SB, Fielding KL, et al. Prevalence of tuberculosis in post-mortem studies of HIV-infected adults and children in resource-limited settings: a systematic review and meta-analysis. AIDS, 2015, 29(15): 1987-2002. doi:10.1097/qad.0000000000000802.
[69] Tubach F, Salmon D, Ravaud P, et al. Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: The three-year prospective French Research Axed on Tolerance of Biotherapies registry. Arthritis Rheum, 2009, 60(7): 1884-1894. doi:10.1002/art.24632.
[70] Torre-Cisneros J, Doblas A, Aguado JM,et al. Tuberculosis after solid-organ transplant: incidence, risk factors, and clinical characteristics in the RESITRA (Spanish Network of Infection in Transplantation) cohort. Clin Infect Dis, 2009, 48(12): 1657-1665. doi:10.1086/599035.
[71] Al-Efraij K, Mota L, Lunny C, et al. Risk of active tuberculosis in chronic kidney disease: a systematic review and meta-analysis. Int J Tuberc Lung Dis, 2015, 19(12): 1493-1499. doi:10.5588/ijtld.15.0081.
[72] Redelman-Sidi G, Sepkowitz KA. IFN-γ release assays in the diagnosis of latent tuberculosis infection among immunocompromised adults. Am J Respir Crit Care Med, 2013, 188(4): 422-431. doi:10.1164/rccm.201209-1621CI.
[73] Hussein MM, Mooij JM, Roujouleh H. Tuberculosis and chronic renal disease. Semin Dial, 2003, 16(1): 38-44. doi:10.1046/j.1525-139x.2003.03010.x.
[74] Shah NS, Yuen CM, Heo M, et al. Yield of contact investigations in households of patients with drug-resistant tuberculosis: systematic review and meta-analysis. Clin Infect Dis, 2014, 58(3): 381-391. doi:10.1093/cid/cit643.
[75] Fox GJ, Barry SE, Britton WJ, et al. Contact investigation for tuberculosis: a systematic review and meta-analysis. Eur Respir J, 2013, 41(1): 140-156. doi:10.1183/09031936.00070812.
[76] Ehrlich R, Akugizibwe P, Siegfried N, et al. The association between silica exposure, silicosis and tuberculosis: a systematic review and meta-analysis. BMC Public Health, 2021, 21(1): 953. doi:10.1186/s12889-021-10711-1.
[77] Nandi SS, Dhatrak SV, Sarkar K. Silicosis, progressive massive fibrosis and silico-tuberculosis among workers with occupational exposure to silica dusts in sandstone mines of Rajasthan state: An urgent need for initiating national silicosis control programme in India. J Family Med Prim Care, 2021, 10(2): 686-691. doi:10.4103/jfmpc.jfmpc_1972_20.
[78] Li Y, Teng D, Shi X,et al. Prevalence of diabetes recorded in Mainland of China using 2018 diagnostic criteria from the American Diabetes Association: national cross sectional study. BMJ, 2020, 369: m997. doi:10.1136/bmj.m997.
[79] Jeon CY, Murray MB. Diabetes mellitus increases the risk of active tuberculosis: a systematic review of 13 observational studies. PLoS Med, 2008, 5(7): e152. doi:10.1371/journal.pmed.0050152.
[80] Viswanathan V, Kumpatla S, Aravindalochanan V, et al. Prevalence of diabetes and pre-diabetes and associated risk factors among tuberculosis patients in India. PLoS One, 2012, 7(7): e41367. doi:10.1371/journal.pone.0041367.
[81] Baker MA, Harries AD, Jeon CY, et al. The impact of diabetes on tuberculosis treatment outcomes: a systematic review. BMC Med, 2011, 9: 81. doi:10.1186/1741-7015-9-81.
[82] Sanghani RN, Udwadia ZF. The association of diabetes and tuberculosis: impact on treatment and post-treatment outcomes. Thorax, 2013, 68(3): 202-203. doi:10.1136/thoraxjnl-2012-202976.
[83] Viswanathan V, Vigneswari A, Selvan K, et al. Effect of diabetes on treatment outcome of smear-positive pulmonary tuberculosis-a report from South India. J Diabetes Complications, 2014, 28(2): 162-165. doi:10.1016/j.jdiacomp.2013.12.003.
[84] Hamada Y, Lujan J, Schenkel K, et al. Sensitivity and specificity of WHO’s recommended four-symptom screening rule for tuberculosis in people living with HIV: a systematic review and meta-analysis. Lancet HIV, 2018, 5(9): e515-e523. doi:10.1016/s2352-3018(18)30137-1.
[85] Elzi L, Steffen I, Furrer H, et al. Improved sensitivity of an interferon-gamma release assay (T-SPOT.TBTM) in combination with tuberculin skin test for the diagnosis of latent tuberculosis in the presence of HIV co-infection. BMC Infect Dis, 2011, 11: 319. doi:10.1186/1471-2334-11-319.
[86] Heo EY, Choi NK, Yang BR, et al. Tuberculosis is frequently diagnosed within 12 months of diabetes mellitus. Int J Tuberc Lung Dis, 2015, 19(9): 1098-1101. doi:10.5588/ijtld.14.0772.
本文内容来源自“中国防痨杂志期刊社”,原链接:指南·规范·共识 | 综合医疗机构肺结核早期发现临床实践指南
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry


