新型冠状病毒疾病(COVID-19)是一种由新型冠状病毒(SARS-CoV-2)引起的传染病,可导致全身多系统的并发症,尤其观察到患者动静脉血栓的风险均增加。COVID-19大流行是一场持续的全球危机。
目前有几种疫苗已经在欧盟获得许可和使用,其中阿斯利康COVID-19疫苗在接种后出现了静脉血栓形成的并 发症,尤其是少见部位血栓。2021年4月1日血栓和止血研究学会(GTH)因这些血栓事件发布了关于该并发症的识别、诊断和治疗的指导声明。2021年4月9日,新英格兰杂志(NEJM)同时发表了2篇对于这些血栓事件的报道及相关的研究。
根据目前的研究,我们可以得出阿斯利康COVID-19疫苗接种相关血栓形成与肝素诱导的血小板减少症(Heparin-induced thrombocytopenia,HIT)有共同的病理生理特征,被称为疫苗诱导的促血栓形成免疫性血小板减少症(Vaccine-induced prothrombotic immune thrombocytopenia,VIPIT),被认为与疫苗接种后免疫反应导致的血小板抗体生成相关。上述的研究及声明也提出了VIPIT的确诊及治疗方法,下面将进行介绍。
一、背景
2021年3月15日,由于发现接种个体血栓形成风险升高,阿斯利康COVID-2019疫苗(AZD1222)被德国卫生部门及其他欧洲国家暂时叫停。但欧洲药品管理局(EMA)安全委员会对疫苗潜在的风险及获益进行评估后,在2021年3月19日重新批准使用该疫苗。在此之前,该疫苗已完成了超过160万次的接种,保罗•埃尔利希研究所(PEI)报道了13例脑静脉或静脉窦血栓。这13例患者为12例女性和1例男性,年龄在20-63岁之间,在疫苗接种后4-16天之间发生血栓形成。这些患者同时存在血小板减少,这提示免疫因素在其中起到作用,导致易栓倾向而形成血栓。
该疫苗在挪威被用于小于65岁的医务工作者,在3月20日被叫停前已完成超13万例的接种。奥斯陆大学医院在NEJM报道了5例接种该疫苗后的血栓并发症,这些患者在32-54岁之间,以脑静脉/静脉窦血栓为主及其他少见部位静脉血栓(腹腔脏器静脉),合并显著的血小板减少,其中4例患者出现颅内大出血。2例患者在文献发表时已死亡,2例患者在丙种球蛋白及糖皮质激素治疗后好转。这5例患者均检测出高水平血小板4-聚阴离子复合物(PF4-polyanion complexes)。研究者就此提出该疫苗接种后血栓形成的病理机制可能类似于HIT的病理机制。
Andreas Greinacher领导的Greifswald工作组阐明了这一个重要的病理机制。该研究团队在NEJM报道了11例接种该疫苗后的血栓并发症(1例为不能排除为脑静脉血栓),患者的临床特征及实验室检查见表格,患者年龄在22-49岁之间,在疫苗接种后5-16天开始出现1次甚至多次的血栓事件,其中9例脑静脉血栓,3例脾静脉血栓,3例肺栓塞及其他,6例患者死亡。该研究团队揭示疫苗导致的炎症反应和免疫刺激可能会诱导针对血小板抗原的抗体生成。通过HIT病理机制类推,依赖或不依赖于肝素,这些抗体会通过血小板表面的Fc受体导致大量的血小板活化。Andreas Greinacher实验室与其他GTH成员合作,在接种该疫苗后静脉窦/脑静脉血栓形成的患者中验证了这个机制,即HIT样机制。目前不能明确的是,为什么这种免疫性血栓形成优先集中体现在脑血管中。
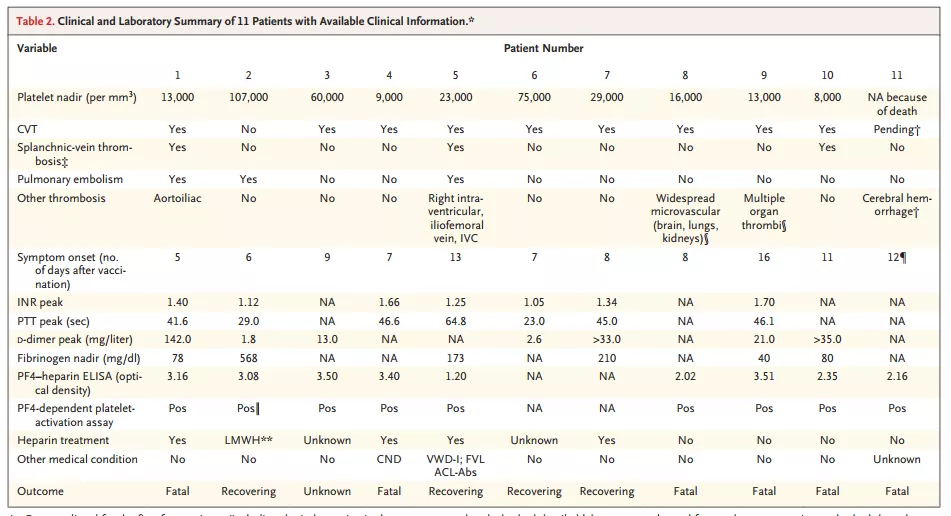
与HIT类似,这些抗体在疫苗接种后4-16天出现。这个病理机制并没有排除其他可能导致血栓形成的原因。
二、内容
根据现有的理论机制,GTH提出了下列声明及指导意见:
(一) 人群
- 对于普遍人群,阿斯利康COVID-19疫苗的积极作用大于消极作用,因此在德国重新使用该疫苗是可行的。
- 对于同年龄层人群,目前没有证据表明接种该疫苗后,典型部位(如下肢静脉血栓、肺栓塞)的血栓事件增加。
- 对于有血栓病史和/或已知易栓症的患者,接种阿斯利康COVID-19疫苗后,颅内静脉或其他少见部位的血栓并发症风险并没有增加,原因与这些特殊部位的免疫成因有关。
(二)不良反应
- 如关节、肌肉疼痛和头痛这样的类流感症状可能在疫苗接种后会持续1-2天,无需特殊关注。
- 如果不良反应在接种后持续或复发超过3天,例如头晕、头痛、视觉障碍、恶心/呕吐、气短、急性胸痛、腹痛或四肢痛,需进一步进行医学检查明确有无血栓性疾病。
(三)辅助检查
- 重要的检查包括血常规及血小板计数、血涂片、D-二聚体,必要时进一步行影像学检查,例如颅脑核磁共振、超声、胸/腹CT检查。
- 如果发现血小板减少或血栓形成,需进行抗体相关的检测,而无需提前应用肝素(图1)。诊断流程中的第一步是筛查HIT,是基于对血小板因子4(PF4)/肝素复合物抗体的免疫学检测。
具体说明:
1)筛查阴性患者可以排除HIT样免疫性血栓形成/血小板减少症。重要的是,不是所有用于HIT检测的商业试剂盒都适用于检测阿斯利康COVID-19疫苗接种后病理性血栓形成相关的抗体。基于既往的观察,HYPHEN BioMed ZYMUTEST 和Immucor GTI Diagnostics酶免疫测定对所有病理生理相关的抗体都有较好的敏感性。
2)对PF4/肝素复合物抗体检测阳性的患者,需进行经典的功能验证试验,肝素诱导的血小板活化试验(Heparin-induced platelet activation, HIPA)或5-羟色胺释放试验(Serotonin-release assay, SRA)。这两个试验检测依赖(典型HIT)或不依赖(自身免疫性HIT)于外源性肝素的血小板活化病理生理相关抗体。在不应用肝素情况下,检测阳性提示自身免疫性HIT。
3)经典的HIPA或SRA没有检测到自身免疫性HIT时,需进行改良的HIPA检测。位于格赖夫斯瓦尔德的Andreas Greinacher实验室目前已建立这项检测手段,可以检测到与(自身免疫性)HIT中抗体反应模式不同的病理生理相关抗体。因此,阳性的检测结果提示存在VIPIT。

HIT/VIPIT
- 当急性血小板减少/血栓形成的原因不能排除(自身免疫性)HIT时,如果临床情况和经验允许,应避免使用肝素抗凝,并使用适用于HIT的抗凝药物。这些抗凝药物包括达肝素钠、阿加曲班、直接口服抗凝药物(DOACs)以及可能包括磺达肝癸钠。磺达肝癸钠的使用应更细化,分为疫苗接种4天以上的急性血栓治疗及疫苗接种后的早期药物预防,后者存在炎症活化,免疫刺激信号通路,应用磺达肝癸钠理论上可能会加速血小板活化抗体的产生。
- 患者确诊(自身免疫性)HIT或VIPIT和严重血栓形成(静脉窦/脑静脉或内脏静脉血栓形成)后,病理性的血栓前状态很可能可以通过静脉注射高剂量的免疫球蛋白(丙种球蛋白)被中断,例如每日输注1克/公斤体重,连续2天。抗凝对于治疗血栓仍是必要的。虽然肝素对于(自身免疫性)HIT是禁忌,但确诊的VIPIT应用肝素抗凝可能是可行的。
- 对HIT/VIPIT的确诊试验需要在输注免疫球蛋白前完成,因为大剂量的免疫球蛋白输注可能会导致假阴性结果。
(四)抗凝治疗
- 不推荐为预防阿斯利康COVID-19疫苗接种后免疫反应导致的(非典型部位)血栓常规进行药物抗凝或抗血小板治疗。
具体说明:
1)对于因房颤或静脉血栓栓塞症(Venous thromboembolism, VTE)口服抗凝药的患者,在疫苗接种期间及之后需继续口服抗凝。
2)对于没有口服抗凝药指征的患者,应根据个体化的危险因素评估。有显著VTE风险的患者,例如在严重流感样症状伴发热、制动的情况下,维持几天的药物预防可以作为个体化的预防方案。
3)由于已发现病理生理相关的HIT样抗体与阿斯利康COVID-19疫苗接种后的特异性免疫应答有关,本指导声明的作者建议不要使用低分子肝素或磺达肝癸钠用于药物预防。根据目前所知,不能排除这些胃肠外抗凝会加速血小板-活化抗体的生成。
4)除了常规的预防措施,如锻炼、补液、弹力袜外,预防剂量的新型口服抗凝药,如10mg利伐沙班每日1次或2.5mg阿哌沙班每日2次,也许可以作为超适应证使用。
(五)合并症
- 无论(自身免疫性)HIT和VIPIT检测结果如何,必须进一步明确血小板减少和/或血栓形成的其他原因,包括血栓性微血管疾病如免疫性血小板减少性紫癜或非典型溶血性尿毒综合征、抗磷脂综合征、阵发性夜间血红蛋白尿以及潜在的恶性(血液系统)疾病。
* 在获得进一步证据后,这份指导声明会持续更新,关于VIPIT的GTH指南将定期更新在https://gth-online.org上。
翟振国教授点评要点
1、新型冠状病毒疾病(COVID-19)可导致全身多系统的并发症,尤其观察到患者动静脉血栓的风险均增加。
2、目前有几种疫苗已经在欧盟获得许可和使用。由于阿斯利康COVID-19疫苗接种后出现的少见部位血栓形成情况,国际血栓领域专家开始关注这一并发症的识别、诊断和临床处理策略。
3、COVID-19疫苗接种相关血栓形成与肝素诱导的血小板减少症(Heparin-induced thrombocytopenia, HIT)有共同的病理生理特征,被称为疫苗诱导的促血栓形成免疫性血小板减少症(Vaccine-induced prothrombotic immune thrombocytopenia,VIPIT),被认为与疫苗接种后免疫反应导致的血小板抗体生成相关。
4、如果患者确诊(自身免疫性)HIT或VIPIT和严重血栓形成(静脉窦/脑静脉或内脏静脉血栓形成),病理性的血栓前状态很可能可以通过静脉注射高剂量的免疫球蛋白(丙种球蛋白)被中断:例如每日输注1克/公斤体重,连续2天。抗凝治疗对于血栓仍是必要的。如果不能明确血小板减少的原因,建议首选非肝素类抗凝药物,如阿加曲班等。
5、由于HIT与阿斯利康COVID-19疫苗接种后的特异性免疫应答有关,建议不要使用低分子肝素或磺达肝癸钠用于药物预防。根据目前所知,不能排除这些胃肠外抗凝会加速血小板-活化抗体的生成。除了常规的预防措施,预防剂量的新型口服抗凝药,如10mg利伐沙班每日1次或2.5mg阿哌沙班每日2次,或许可以作为超适应证使用。
6、在挪威13万多名接种疫苗者中,有5例发生血栓形成,这些患者代表了一种罕见的疫苗诱导的免疫性血小板减少症。相关研究结果近期在线发表在NEJM期刊上。
7、疫苗的有效性毋庸置疑,但其潜在的风险和并发症也应该值得关注。科学在进步,人们对疾病的认知和认识也在不断深入,科学家们也逐渐找到了新冠疫苗导致血栓形成的原因,这些研究的系列成果将有助于该疫苗在全球推广和开发,并有效控制和治疗不良反应的发生。
参考文献
指南原文:
Oldenburg J, Klamroth R, Langer F, et al. Diagnosis and Management of Vaccine-Related Thrombosis following AstraZeneca COVID-19 Vaccination: Guidance Statement from the GTH. Hamostaseologie. 2021 Apr 1. doi: 10.1055/a-1469-7481. Epub ahead of print. PMID: 33822348.
NEJM:
Schultz NH, Sørvoll IH, Michelsen AE, Munthe LA, Lund-Johansen F, Ahlen MT,Wiedmann M, Aamodt AH, Skattør TH, Tjønnfjord GE, Holme PA. Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. N Engl J Med. 2021 Apr 9.doi: 10.1056/NEJMoa2104882. Epub ahead of print. PMID: 33835768.
Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S.Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med.2021 Apr 9. doi: 10.1056/NEJMoa2104840. Epub ahead of print. PMID: 33835769.
点评专家

翟振国
医学博士,主任医师,教授,博士生导师,中日医院呼吸中心、肺栓塞与肺血管病学组学术带头人,中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会主任委员,中华医学会呼吸病学分会肺栓塞与肺血管病学组副组长,国际肺血管病研究院(PVRI)委员兼秘书,美国胸科医师学会(ACCP)资深委员,中国呼吸医学教育学院学术委员会常务委员、肺血管疾病分委会主任,海峡两岸医药卫生交流协会呼吸病学专业委员会常务委员,Clinical Respiratory Journal副主编,中华老年心脑血管病杂志编委,第十四届中国优秀呼吸医师,入选卫生部有突出贡献的中青年专家。擅长呼吸系统常见、疑难与危重症、肺血管病的诊断与治疗。尤其对肺栓塞、慢性血栓栓塞性肺动脉高压、其他肺动脉高压有系统研究。
编译

张云霞
医学博士,PCCM专培医师,就职于中日友好医院呼吸与危重症医学科。长期致力于肺栓塞及肺血管病的基础及转化医学研究。作为主要参与者,参与完成多项国家级及省部级课题。以第一作者身份在ERJ、AJP-Lung等杂志发表SCI文章5篇,中文核心期刊杂志文章多篇。

张宇
首都医科大学2018级专业型硕士研究生在读,研究方向为肺栓塞及易栓症。

李研
首都医科大学临床专业硕士在读,主要研究方向为呼吸系统疾病。
本文完
排版:Jerry


