患者是一位29岁女性,因「反复干咳气喘10年,间断胸痛4月,加重12天」于2021年7月12日入院。10年前无明显诱因出现反复干咳,伴气喘,当地医院诊断为支气管哮喘,长期规律吸入沙美特罗替卡松粉吸入剂(50ug/250ug)1吸/次 2次/日治疗,但上述症状每年仍有1-2次急性发作需住院治疗。4月前出现左侧胸闷痛,呈持续性,咳嗽及深呼吸时加重,外院胸部CT示右肺中叶不张,肋骨骨折(具体不详),未予特殊治疗,2月后自行好转。
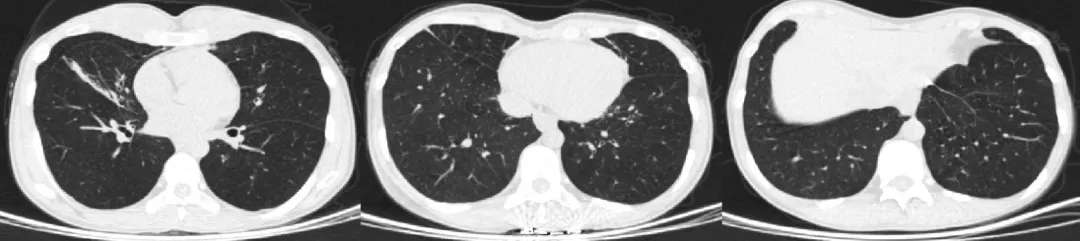
12天前再发左侧胸闷痛,呈持续性,伴咳嗽、咳痰,为白痰,不易咳出,伴喘息,无痰中带血,我院门诊胸部CT(2021.7.9)示右肺中叶及左肺下叶异常,考虑炎性病变合并膨胀不良,双肺局限性肺气肿,双肺慢性炎症(图1)。以「肺部阴影」收治入院。
既往史、个人史无特殊。 入院查体: T36.4℃,R23次/分,BP101/83mmHg,神清语明,喘息貌,口唇发绀,全身皮肤黏膜无皮疹及出血点,双肺可闻及散在哮鸣音,律齐,余未见明显异常。
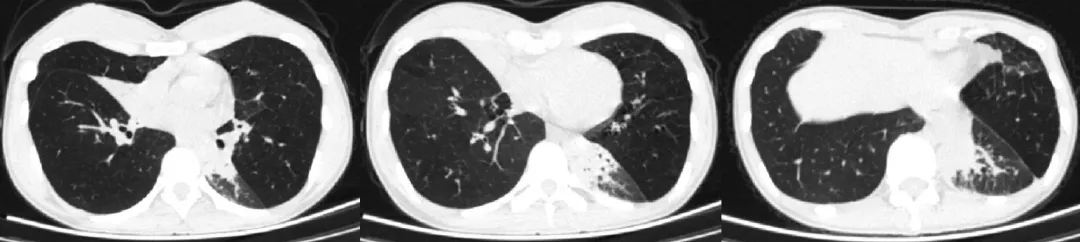
图1:我院门诊胸部CT(2021.7.9)
入院后,考虑患者为支气管哮喘急性发作期合并肺部阴影,感染可能,完善相关化验检查如下:血气分析:pH 7.421,PaCO2 33.8mmHg,PaO2 57.8mmHg↓。血常规:白细胞7.82×109/L,中性粒细胞百分比49.5%,嗜酸粒细胞(Eosinophil,EOS) 1.85×109/L↑,EOS百分比23.7%↑。血清免疫球蛋白:IgE:186IU/ml↑,IgG正常。过敏原特异性IgE抗体:虾/蟹1.1IU/ml,桃苹果芒果荔枝草莓0.72IU/ml。余查尿常规、肝肾功、电解质、CRP、血沉、降钙素原、BNP、心肌损伤标志物、肺肿瘤标志物均未见异常。支气管舒张试验阴性。
呼出气一氧化氮(FeNO):37ppb,提示混合性气道炎症。
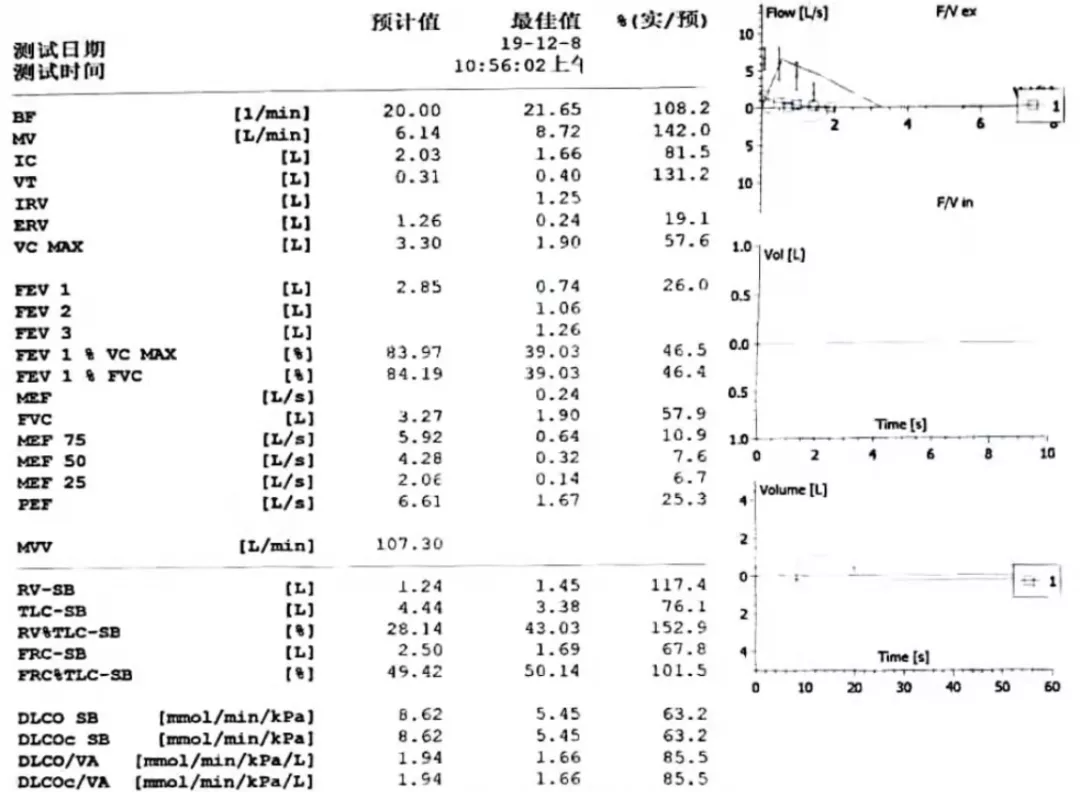
肺功能(图2):1.极重度混合性通气功能障碍;2.残气占肺总量明显增高;3.弥散功能轻度减低。
图2:肺功能检查
依据上述检验检查判断患者肺部感染依据不足,血EOS明显升高合并肺部阴影,进一步完善支气管镜:镜下双侧支气管系统可见少量白色稀薄分泌物,抽吸后见粘膜充血潮红,以左下叶基底支为著,右中叶外侧段、右下叶背段及左下叶基底支粘膜肿胀增厚致管腔狭窄,在左下叶收集灌洗液送检,左下叶基底支活检(图3)。支气管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)常规示:无色微浑,中性粒细胞百分比8%,EOS百分比70%↑。
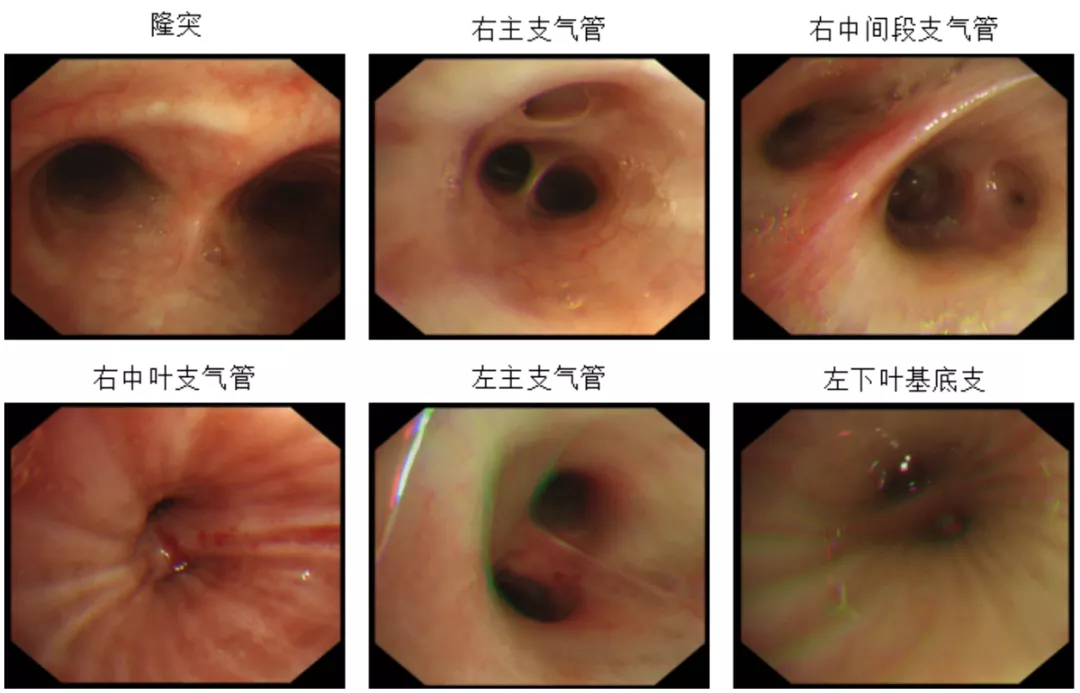
图3:支气管镜检查结果
患者血和BALF中EOS均明显升高为诊断提供重要线索,首先可考虑嗜酸性粒细胞肺病 (Eosinophilic lung diseases,ELD),ELD是以气道、肺泡或肺间质EOS增多伴或不伴血EOS增多为特征的一组临床疾病 [1,2] 。满足以下任一条即可诊断:①肺部EOS浸润伴有外周EOS增多;②开胸肺活检或经支气管镜肺活检证实组织EOS增加;③BALF中EOS增加。
ELD一般分为不明原因和有特定原因的ELD两类。不明原因的有: 单纯性肺嗜酸性粒细胞增多症(SPE),急性嗜酸性粒细胞性肺炎(AEP),特发性高嗜酸性粒细胞综合征(IHS),慢性嗜酸性粒细胞性肺炎(CEP);特定原因的有: 变应性支气管肺曲霉病(Allergic bronchopulmonary aspergillosis,ABPA),真菌感染,寄生虫感染,药物反应,嗜酸性肉芽肿性多血管炎(Eosinophilic granulomatous polyvasculitis,EGPA)、结缔组织疾病、过敏性肺炎、肿瘤等引起的肺EOS增多 [3] 。
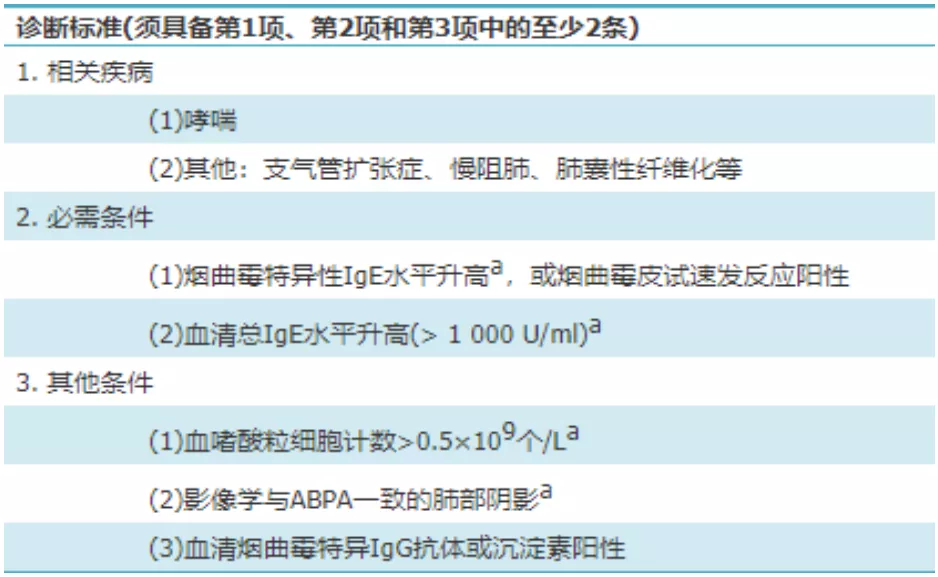
此患者具有咳嗽、胸闷、喘息等「哮喘样症状」,故主要需鉴别的疾病是ABPA和EGPA。 ABPA的诊断不需要病理活检,2017年中华医学会结合我国的疾病分布特点和临床实际情况,提出ABPA诊断标准如下 [4] (表1)。
EGPA诊断「金标准」为受累组织活检病理,典型的病理特点为EOS浸润、坏死性的血管炎和血管外肉芽肿形成
[5,6] 。2018年我国EGPA专家共识中诊断标准主要参考1990年美国风湿病协会制定的6条诊断标准 [7] :
①哮喘样症状;
②外周血EOS增多(百分比>10%或绝对值>1.5*10 9 /L);
③单 发或多发性神经病变;
④副鼻窦病变;
⑤肺内游走性浸润影;
⑥组织活检证实EOS血管外浸润。
满足以上6条标准中的至少4条者可诊断为EGPA。
本共识还特别提出[8],该标准中的第1条「哮喘」的真正含义是指哮喘样表现,包括喘息、咳嗽、胸闷及呼吸困难等。95%以上的EGPA患者有喘息、咳嗽等病史,75%的患者出现变应性鼻炎,是EGPA的典型初始症状,患者也可出现反复发作的鼻炎或鼻息肉[9,10]。
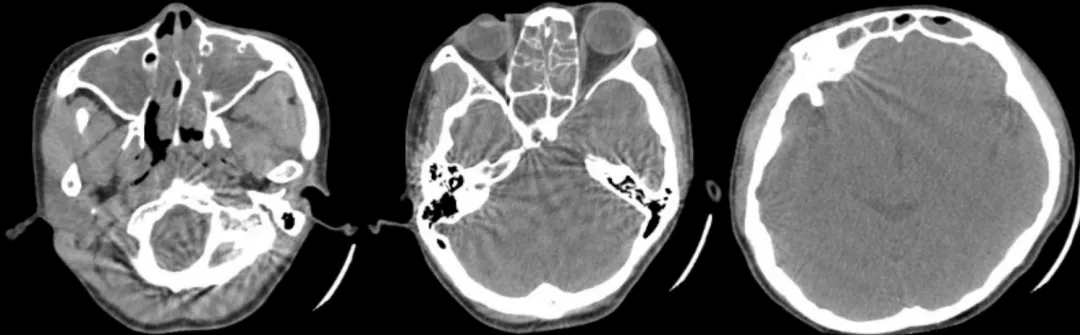
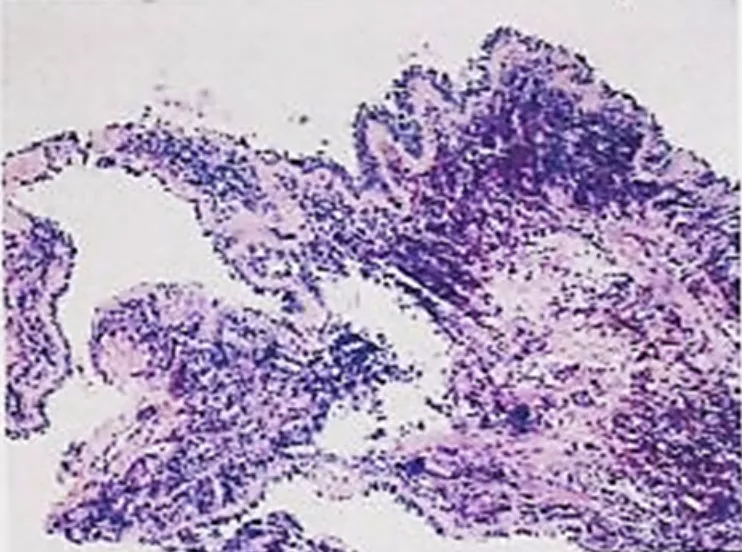
EGPA一旦确诊,需详细评估呼吸系统、肾、心脏、胃肠道和(或)外周神经等多器官受累情况。故再次完善相关化验检查:烟曲霉(m 3 )、曲霉菌IgM及IgG抗体、抗中性粒细胞抗体均阴性。鼻窦CT:全副鼻窦炎症;双侧鼻道息肉不除外;鼻中隔向左偏曲(图4)。肌电图、心脏、肝胆胰脾、双肾、输尿管、膀胱彩超未见异常。支气管镜下左下叶基底支活检病理示(病理号:21-20715):支气管粘膜慢性炎伴嗜酸性粒细胞浸润伴坏死性小血管炎 (图5)。
最终,本患者不符合ABPA诊断标准中 2条必需条件,而符合EGPA中的①、②、④、⑤、⑥共4条标准,且病理有血管炎表现,故明确诊断为EGPA。
表1:ABPA诊断标准
图4:鼻窦CT:全副鼻窦炎症;鼻中隔偏曲
图5:支气管粘膜嗜酸性粒细胞浸润伴坏死性小血管炎(HE染色×200)
EGPA分为局限型及全身型,仅有肺部和呼吸系统受累(包括耳鼻喉)称为局限型EGPA,有至少2个及以上脏器受累则称为全身型EGPA,局限型可转化为全身型EGPA[11]。活动期局限型EGPA定义为喘息、咳嗽、胸闷等症状加重,并伴有呼气峰流速下降和(或)外周血EOS升高[8,12]。本例患者处于活动期局限型。
EGPA的治疗关键在于早期识别,早期使用糖皮质激素及免疫抑制剂,预后与最初治疗方案相关,制定治疗方案前要先进行5因子评分评估预后,分数越高,预后越差,0分可单独使用糖皮质激素控制症状;≥1分建议使用糖皮质激素和免疫抑制剂联合治疗[13]。总体治疗方案分为诱导缓解和维持治疗2个阶段。此患者5因子评分为0分,活动期局限型EGPA,共识建议诱导治疗阶段激素起始剂量为1mg/kg/d,4-6周后逐渐减量,推荐的治疗时间为疾病达到缓解后至少24个月[8]。
我们结合患者身体质量指数(Body mass index,BMI)16.65kg/m 2 (40kg,1.55m),体型消瘦,予泼尼松30mg/d口服; 此外,因EGPA具有和哮喘相似的呼吸道表现和病理生理学特点,继续予沙美特罗替卡松规律吸入; 其他: 吸氧,布地奈德加乙酰半胱氨酸雾化,氟替卡松及氮卓斯汀喷鼻,溴己新及桉柠蒎祛痰,碳酸钙D3、奥美拉唑预防激素副作用。
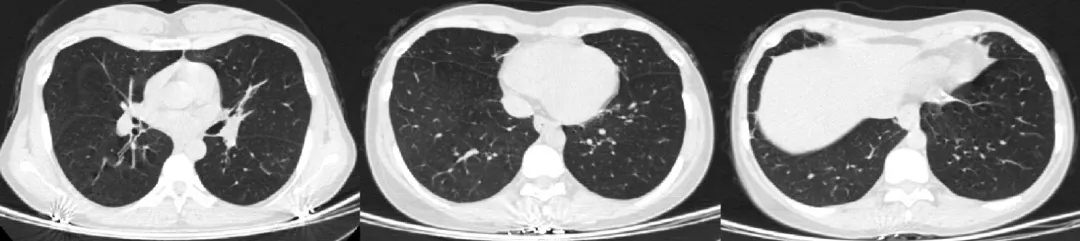
治疗后患者咳嗽、喘息症状明显缓解 ,1个月后随访胸部CT(2021.8.9)右肺中叶肺不张较前片部分复张,左肺下叶实变影完全吸收,纵膈淋巴结增大较前缩小(图6)。3个月后随访时 ,血EOS降至正常水平,复查胸部CT(2021.10.11)示右肺中叶复张,纵隔链板机增大较前进一步缩小,胸膜肥厚减轻(图7)。提示目前激素治疗的有效性。现泼尼松片10mg/d维持治疗中。
图6:胸部CT(2021.8.9)
图7:胸部CT(2021.10.11)
总结:EGPA是一种罕见病,可累及全身多个脏器,临床表现复杂多样[14]。大多数患者早期仅表现为发作性喘息、咳嗽、胸闷等,极易误诊为单纯性哮喘,导致病情延误,影响预后。广大临床医生需提高对该病的系统认识和诊疗水平,对反复喘息发作按哮喘治疗效果差的患者需考虑到此类疾病。EGPA主要依靠临床症状、实验室检查、影像学检查、血或BALF中EOS升高、组织病理检查进行诊断。激素和免疫抑制剂治疗是基础。
参考文献
[1] Fernandez P E, Olson A L, Frankel S K. Eosinophilic lung diseases. Med Clin North Am. 2011, 95(6): 1163-1187.
[2] Bernheim A, Mcloud T. A Review of Clinical and Imaging Findings in Eosinophilic Lung Diseases. AJR Am J Roentgenol. 2017, 208(5): 1002-1010.
[3] Rose D M, Hrncir D E. Primary eosinophilic lung diseases. Allergy Asthma Proc. 2013, 34(1): 19-25.
[4] 沈华浩,孙永昌,林江涛,等. 变应性支气管肺曲霉病诊治专家共识. 中华医学杂志. 2017, 97(34): 2650-2656.
[5] Churg J, Strauss L. Allergic granulomatosis, allergic angiitis, and periarteritis nodosa. The American journal of pathology. 1951, 27(2).
[6] Cottin V. Eosinophilic Lung Diseases. Clin Chest Med. 2016, 37(3): 535-556.
[7]Masi A T, Hunder G G, et al. The American College of Rheumatology 1990 criteria for the classification of Churg-Strauss syndrome (allergic granulomatosis and angiitis). Arthritis Rheum. 1990, 33(8): 1094-1100.
[8] 张清玲. 嗜酸性肉芽肿性多血管炎诊治规范多学科专家共识. 中华结核和呼吸杂志. 2018, 41(07): 514-521.
[9] 吉连梅. 嗜酸性肉芽肿性多血管炎23例临床分析[J]. 中华风湿病学杂志,2015, 19(2):102-105.
[10] LanhamJG, ElkonKB,et al. Systemic vasculitis with asthma and eosinophilia: a clinical approach to the Churg-Strauss syndrome[J]. Medicine (Baltimore),1984,63(2):65-81.
[11] Mahr A, Moosig F, Neumann T, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss): evolutions in classification, etiopathogenesis, assessment and management. Curr Opin Rheumatol. 2014, 26(1): 16-23.
[12]沈华浩. 支气管哮喘防治指南(2016年版). 中华结核和呼吸杂志. 2016, 39(09): 675-697.
[13]GuillevinL, PagnouxC, et al. The Five-Factor Score revisited assessment of prognoses of systemic necrotizing vasculitides based oil the French Vasculitis Study Group(FVSG) cohort[J]. Medicine(Baltimore),2011,90(1):19-27.
[14]Vaglio A, Buzio C, Zwerina J. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss): state of the art. Allergy. 2013, 68(3): 261-273.
作者简介

刘昀
西安交通大学第二附属医院呼吸与危重症医学科副主任;主任医师,博士生导师;中华医学会变态反应学分会常委;中国医师协会变态反应医师分会常委;中华医学会呼吸病学分会哮喘学组委员;中国医疗保健国际交流促进会过敏科学分会委员;中华预防医学会过敏病预防与控制专业委员会委员;中国研究型医院过敏医学专委会委员;中国生理学会呼吸生理专业委员会委员;陕西省保健协会呼吸专业委员会副主任委员;陕西省中西医结合学会呼吸病专业委员会常委;陕西省保健学会心肺预防康复专业委员会常委;陕西省医学会变态反应分会委员兼秘书;西安市结核呼吸学会常委;陕西省中医药专家委员会副主任委员;中华医药学会络病学分会委员;JACI中文版编委。主要科研方向是支气管哮喘的防治,在此方面承担国家自然科学基金3项,省公关2项,校骨干项目等多项科研项目,发表论文多篇。

赵凯凯
西安交通大学第二附属医院住院医师;发表中华医学会呼吸病学年会论文发言一篇,发表综述一篇;第一参与者参与西安交通大学第二附属医院院级科研项目1项;熟悉呼吸系统常见疾病诊疗技术。