通气功能是由通气肌作功能力、中枢通气驱动和通气负荷三者决定
通气系统的三个关键要素包括中枢控制器、通气感受器和效应器。中枢控制器,主要是脑干(延髓、脑桥)的神经元,产生呼吸驱动,主要两组神经元组成,即背侧呼吸组神经元(DRG)和腹侧呼吸组神经元(VRG)。DRG主要位于孤束核,是心肺感受器传入的神经冲动在中枢整合的重要部位;VRG主要包括包钦格复合体、前包钦格复合体、疑核和后疑核等神经核团,其中前包钦格复合体是重要的呼吸发生器。通气的效应器,即呼吸肌,包括上气道肌群、膈肌及肋间肌等辅助呼吸肌;通气的感受器,包括中枢及外周化学性感受器、机械性、温度、痛觉等感受器。呼吸系统由高效的前反馈和后反馈(正/负反馈)调控,清醒状态下,多种调控机制参与通气的调控,即使在外环境明显改变(如高原)或重要通气部件受损情况下,仍可代偿维持通气功能和血气的稳定。机体在睡眠状态下,通气调控能力降低,呼吸系统处于潜在的「脆弱」阶段,轻度的通气功能受损即可出现夜间低通气。因此,睡眠呼吸监测是早期通气功能不全及「不明原因」呼吸衰竭的重要的临床诊断工具。
化学性调控是睡眠状态下主要的呼吸调控方式,CO2是关键调控因子
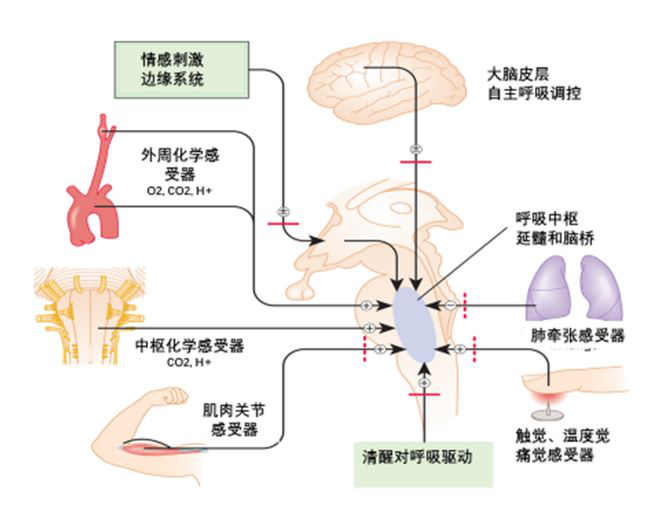
清醒状态下的呼吸调控主要包括高位呼吸中枢,即大脑皮层对呼吸的自主调控和中枢及外周化学感受器的代谢性调控。此外,四肢肌肉及关节周围的机械性感受器可感受运动而引起呼吸频率和潮气量增加;触觉、痛觉、温度觉感受器受刺激可引起通气量的变化;肺的过度充气或牵张可通过Hering-Breuer反射抑制呼吸;情感应激可引起通气量的增加,见于高通气综合征的患者;此外,清醒状态本身可作为独立的通气刺激因子。
化学性调控是机体在清醒安静状态下和睡眠状态下主要的通气调控方式。机体在睡眠状态下,除代谢性调控的其他通气调控机制明显减弱或消失,而对通气的化学性(代谢性)调控成为最主要的通气调控方式。外周化学感受器位于颈动脉体和主动脉体,感受氧、二氧化碳和氢离子浓度的变化,是即时调控的快反应感受器。延髓斜方体后核是重要的中枢性化学感受器,通过感受脑脊液中pH的变化,感受PaCO2的变化。CO2是睡眠状态下的关键通气调控因子,当PaCO2水平低于导致呼吸暂停的窒息阈值时,即发生中枢性呼吸暂停。与外周快反应化学感受器不同,中枢感受器需要1分钟的时间对化学性刺激作出反应,这种反应的延迟与心力衰竭等病理情况下周期性呼吸(Cheyne-Stokes呼吸)的发生密切相关。
不同清醒-睡眠阶段低氧及高二氧化碳通气反应性的变化
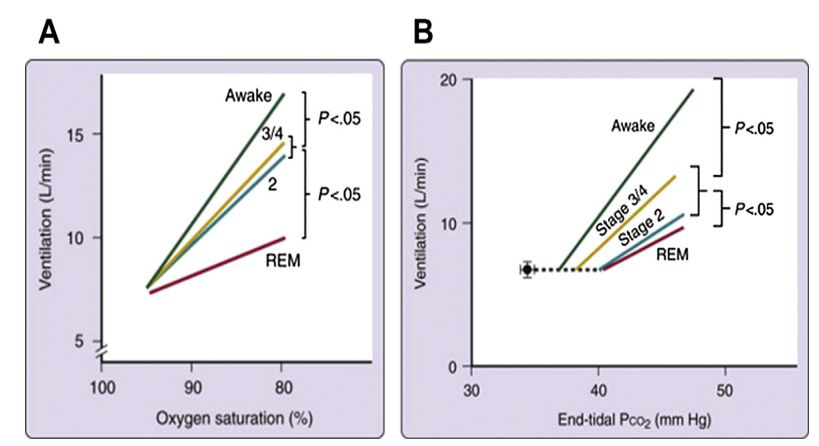
从清醒状态到非快动眼睡眠(NREM)到快动眼睡眠(REM),机体对低氧和高碳酸血症的反应性是逐步降低的。通气调定点,即导致通气量增加的PaCO2的截点,由清醒到稳定睡眠到REM睡眠是增高的,即在REM睡眠状态下需较高的PaCO2水平,才能启动通气量的增加。这是临床上很多睡眠呼吸障碍性疾病,包括阻塞性睡眠呼吸暂停及大多数睡眠低通气疾病,其低氧血症和高碳酸血症在REM睡眠期最为突出的原因之一。此外,低氧和高二氧化碳通气反应性与机体的行为状态密切相关,随清醒、睡眠、运动等行为状态的变化而改变。并且,低氧和高二氧化碳的通气反应具有可塑性,如机体反复暴露于低氧环境中,可导致低氧通气反应的敏感性降低,进而导致睡眠状态下通气不稳定的病理状态;同样睡眠呼吸疾病经无创通气治疗后,其通气反应性的降低可随通气的改善而恢复,这就可解释部分肺泡低通气疾病患者,随着治疗时间的延长,其无创通气压力需求可能会降低。
睡眠微觉醒是个双刃剑
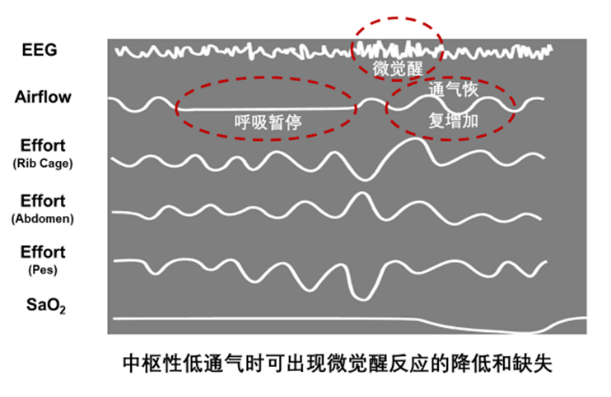
睡眠呼吸暂停事件终止时,通常伴随微觉醒的发生,微觉醒一方面导致了睡眠稳态的破坏和碎片化的睡眠,但同时微觉醒导致通气量的恢复和增加是对睡眠低通气的重要保护机制,在某些中枢性低通气疾病的患者,可出现继发于呼吸暂停或低通气事件的微觉醒的明显降低,进而进一步加重了睡眠低通气。
不同睡眠清醒时相呼吸神经元电活动及呼吸肌功能的变化

呼吸运动神经元除接收节律性,即与呼吸运动相关的神经冲动(驱动电位)外,还接收紧张性神经冲动,这种紧张性的神经冲动可理解为背景频率。机体从清醒到NREM到REM睡眠期,紧张性神经冲动的动作电位降低,可导致呼吸肌肌电活动降低,表现为潮气量和分钟通气量的降低。但是在REM睡眠期,存在内源性、不规律的,与呼吸运动无关的,并且不依赖于PaCO2水平(化学性调控)的紧张性神经冲动的动作电位的增加,导致REM期中枢性呼吸事件与NREM相比,相对减轻,因此中枢性呼吸暂停及中枢性肺泡低通气在NREM期通常较REM期更常见、程度更为严重。
呼吸肌,包括上气道肌群、肋间肌和腹肌等辅助呼吸肌的肌电活动从清醒到NREM到REM睡眠期,是逐渐降低的,尤其是在REM睡眠期,除膈肌之外的呼吸肌均处于类似「瘫痪」的状态;而膈肌作为维持机体呼吸运动的重要肌肉,在清醒及不同睡眠时相,其肌电活动无明显变化,是维持机体在睡眠状态下通气稳态的重要动力源。神经肌肉疾病,如果出现膈肌受累,患者在睡眠状态下,尤其是REM睡眠期会出现明显的低通气;因此REM期低通气通常是神经肌肉疾病呼吸肌受累的最早和最突出的临床表现,具有重要提示及鉴别诊断意义。
病例1
38岁,女性,反复呼吸困难伴双下肢水肿5年,近5年四肢肌力进行性减退,近2年出现咳嗽无力、声音改变、进食水呛咳。既往30年前罹患脊髓灰质炎。血气分析(FiO2 0.21):PH 7.44,PO2 50mmHg, PCO2 63mmHg,HCO3- 42.8mmol/L,SO2 86%。胸部CT未见异常。心脏超声提示右心增大,肺动脉高压,估测SPAP 50mmHg。肺功能提示限制性通气功能障碍,无法配合P0.1及最大吸气压检测。多导睡眠监测提示:以低通气事件为主,明显的低氧血症,在快动眼睡眠期(R期),低氧尤为明显。

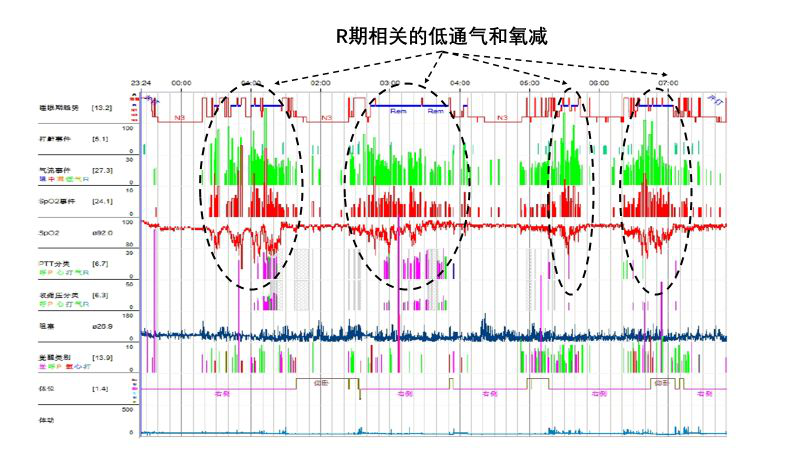
诊治经过
病房夜班值班医生给予患者吸氧后,发现血氧基线改善,但睡眠期,尤其是R期出现持续时间更长、更深的氧降。患者于次夜于睡眠室进行无创通气手工压力滴定,通气模式:BPAP (S/T) IPAP14cmH2O, EPAP 6chH2O,备用频率12次/分钟,在未吸氧情况下,其夜间低氧血症基本纠正。此患者给予无创通气治疗,但一年后因吸入性肺炎去世。


病例评析
> 此患者以肺动脉高压收入院,病史及血气分析提示为低氧或肺部疾病相关性肺动脉高压,肺功能检查提示限制性通气功能障碍,因无法配合卧位肺功能和最大吸气压检查,未能获得呼吸肌受累证据。但多导睡眠监测表现为REM睡眠期相关的显著的低氧血症和低通气,为呼吸肌受累的特征性表现,提示存在神经肌肉疾病导致肺泡低通气和肺动脉高压。
> 此患者夜间常规氧疗,为何低氧事件加重?据血气公式PAO2=FiO2 (760−47)–1.25╳PaCO2=0.21713–1.25╳PaCO2=150–1.25╳PaCO2,对于无换气功能异常的单纯肺泡低通气疾病患者,其动脉氧分压的降低是由于肺泡低通气造成的肺泡中CO2分压增高,挤占了氧气的空间所致,因此对于此类患者首要的问题是改善通气,如单纯吸氧,化学感受器的反应性降低,可导致睡眠期尤其是R期更为严重的低氧。
> 对于神经肌肉疾病导致肺泡低通气的患者,无创通气需采用BPAP(S/T)模式,而不是无备用频率的S模式,需设置较高的吸气触发灵敏度,降低因呼吸肌无力造成的无效触发。此类患者通常不需要较高水平的压力支持,并且对高水平的压力支持耐受性较差,可因压力滴定过程中的快速升压导致觉醒,因此此类患者无创通气需在保证氧合的基础上,合理设置呼吸机参数,维持睡眠连续性。
> 神经肌肉疾病患者,除注意膈肌等呼吸肌受累之外,还需关注上气道肌群,尤其是对于病变较重,受累层面较高的患者,如出现颅神经受累可出现吞咽困难,需注意气道廓清,降低吸入性肺炎的风险。
病例2
患者男性,15岁,间断呼吸困难、因呼吸衰竭,4次气管插管病史。患者从3岁开始,即在呼吸道感染,发热及局麻后出现呼吸困难、口唇发绀,神志不清,于当地医院先后4次入住ICU,行气管插管,曾诊断为「重症肺炎,呼吸衰竭,急性心力衰竭、中毒性脑病、症状性癫痫」等,给予机械通气、抗感染、解痉、脱水、降颅压等治疗。自诉平素体力活动不受限,喜欢打篮球,BMI: 20.7kg/㎡。以下为患者第四次发作时气管插管初及治疗5天后胸部CT。
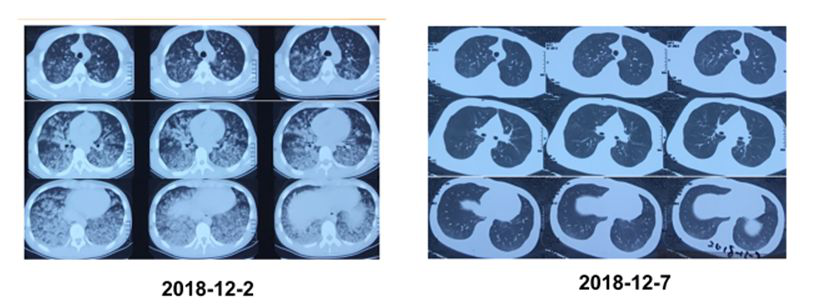
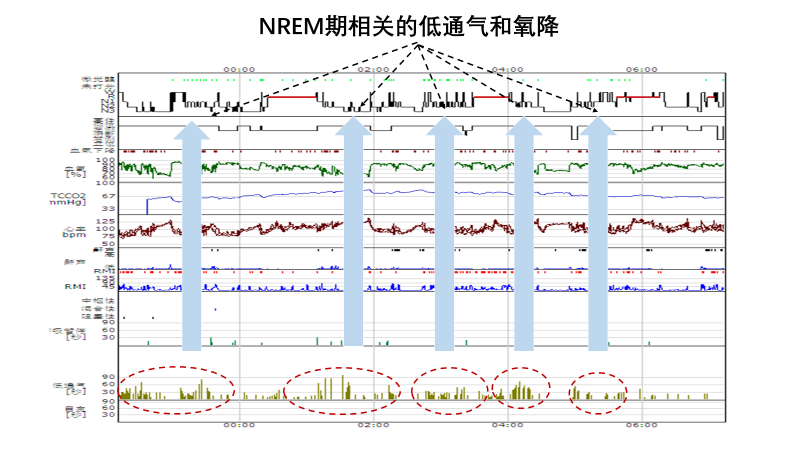
肺功能检查提示立卧位肺通气、肺容量及弥散功能未见异常。清醒状态未吸氧血气:pH 7.40,PCO2 61cmH2O, PO2 80cmH2O。肌电图、肌肉活检、头颅核磁、脑电图、心脏彩超均未见异常。简易精神状态评价量表(MMSE)提示轻度认知功能障碍。多导睡眠监测提示睡眠呼吸事件以低通气为主,NREM期更为明显,微觉醒减少。全基因组检测:PHOX2B基因突变阳性。患者于睡眠室进行无创通气压力滴定,通气模式:BPAP (S/T) IPAP15cmH2O, EPAP 6chH2O,备用频率12次/分钟,在未吸氧情况下,其夜间低氧血症基本纠正。随访两年病情稳定。
诊断评析
> 此患者先后四次于呼吸道感染,发热或应用局麻药等导致通气需求、氧耗增加或呼吸中枢兴奋性降低的情况下出现呼吸衰竭,辅助检查及病程转归无法用肺实质、气道、肺血管及呼吸肌病变解释。睡眠监测提示主要为NREM期的低通气和低氧血症,同时伴微觉醒的减少,提示存在中枢性肺泡低通气,全基因组检查证实为先天性肺泡低通气综合征(CCHS)。
> 延髓腹外侧区的斜方体后核(RTN)是中枢化学感受器CO2/H+依赖信号传输到呼吸中枢控制器的关键位置。CO2/H+水平升高引起含有PHOX2B的RTN神经元在呼吸中枢控制器前包钦格复合体的轴突终末分泌兴奋性神经递质谷氨酸。而CCHS的患者由于相关基因突变导致中枢化学感受器向呼吸中枢控制器神经递质传递障碍。
> 需注意的是不同于REM期存在的内源性兴奋性冲动,NREM期通气几乎完全依赖于化学性调控,因此中枢性低通气患者的PaCO2水平的增高以NREM期更明显,和神经肌肉疾病导致低通气相鉴别。
结语
睡眠呼吸生理是呼吸与危重症医学科医生完整知识体系的重要组成部分,了解掌握睡眠呼吸调控的基础知识有助于理清诊断思路,减少临床诊疗的盲点。多导睡眠检测是睡眠状态下睡眠和呼吸最准确和全面的评估方法,是临床上早期发现以及对「unexplained」低通气疾病的重要诊断工具。
专家介绍

张晓雷
医学博士,中日医院主任医师,副教授,硕士研究生导师。中华医学会呼吸病学分会睡眠呼吸障碍学组委员,中华医学会医学装备委员会睡眠呼吸装备学组副主任委员,中国医师协会呼吸医师分会肺功能与临床呼吸生理工作委员会副主任委员、曾先后于美国达特茅斯-希丁科克医疗中心和梅奥医疗中心呼吸与危重症医学科进修学习。临床及科研方向:睡眠呼吸障碍性疾病、慢性气道疾病和弥漫性实质性肺疾病。

韩腾
北京大学医学博士,中日医院呼吸与危重症医学科主治医师,曾于美国梅奥睡眠医学中心进修学习,参与国家级课题两项。主要专业方向为睡眠呼吸障碍疾病与临床呼吸生理。作为国家医疗队第一批成员在武汉同济医院新法院区和方舱医院参加新冠肺炎患者的救治。

王彦
香港大学博士。中日医院呼吸与危重症医学科住院医师,主要研究方向为阻塞性睡眠呼吸暂停相关代谢功能紊乱。国家自然科学基金青年项目负责人。中国睡眠研究会睡眠医学教育委员会青年委员。


