前言
近年来,随着激素及免疫抑制剂的广泛应用,免疫功能低下宿主(Immunocompromised Host,ICH)的感染发生率呈现增长趋势,肺部是最常见感染部位,病原体涵盖细菌,真菌、病毒、寄生虫及其他新兴病原体等,如未得到及时准确地诊治,致死率极高[1, 2]。本文分享一例ICH的肺部感染,且看实验室如何运用各种检测手段,拨开层层云雾,揭开谜底。
病原学诊断部分
某日,呼吸科送来一份肺泡灌洗液(BALF)标本和纤支镜刷片,BALF外观清亮,仅见少量絮状物(见图一)。若是细菌感染导致的急性炎症,主要以中性粒细胞渗出为主,样本往往为脓性或浑浊,这样的样本,会是感染吗?

图一
BALF标本接种后离心制片,纤支镜刷片进行抗酸染色,主管医生告知:该患者长期使用激素(图二、图三)。思考:免疫功能低下人群,罹患感染性疾病的几率较高,且需关注少见病原体。
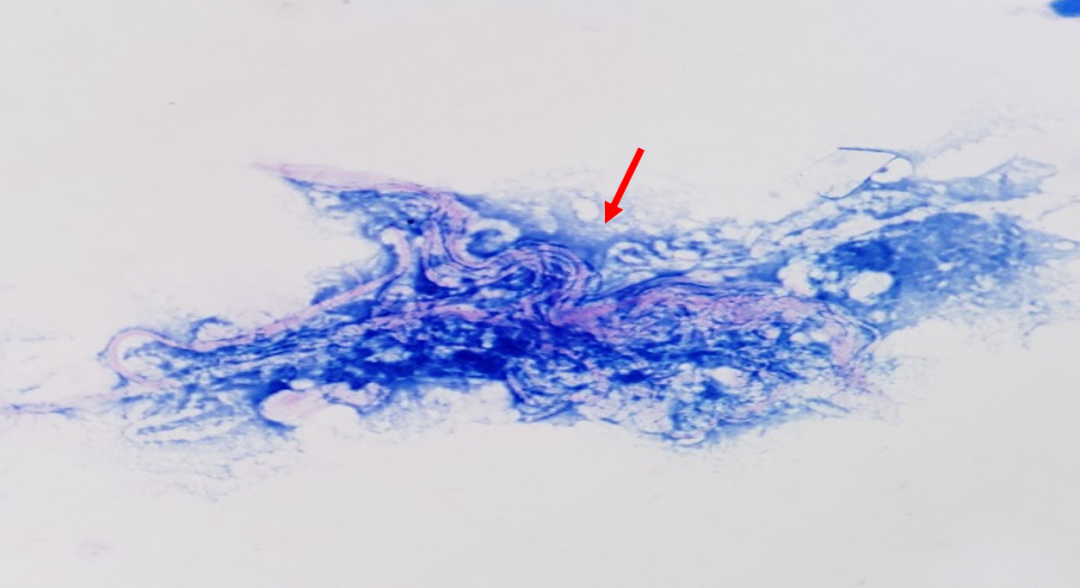
图四:弹力纤维(纤支镜刷片抗酸染色)
纤支镜刷片抗酸染色镜检:可见弹力纤维(见图四),提示组织破坏严重。在肺部,肺癌、肺结核、肺部真菌感染、肺脓肿、金葡菌肺炎等疾病中常见。临床诊断:社区获得性肺炎(CAP),非重症。38岁年轻女性,免疫功能低下,需排除肺结核,但镜检显示抗酸阴性。经仔细寻找,可见双凹圆盘状物,形似红细胞(见图五,六),但红细胞抗酸染色时很难保留原始状态,易破坏(见图七,八)。那这会是什么呢?
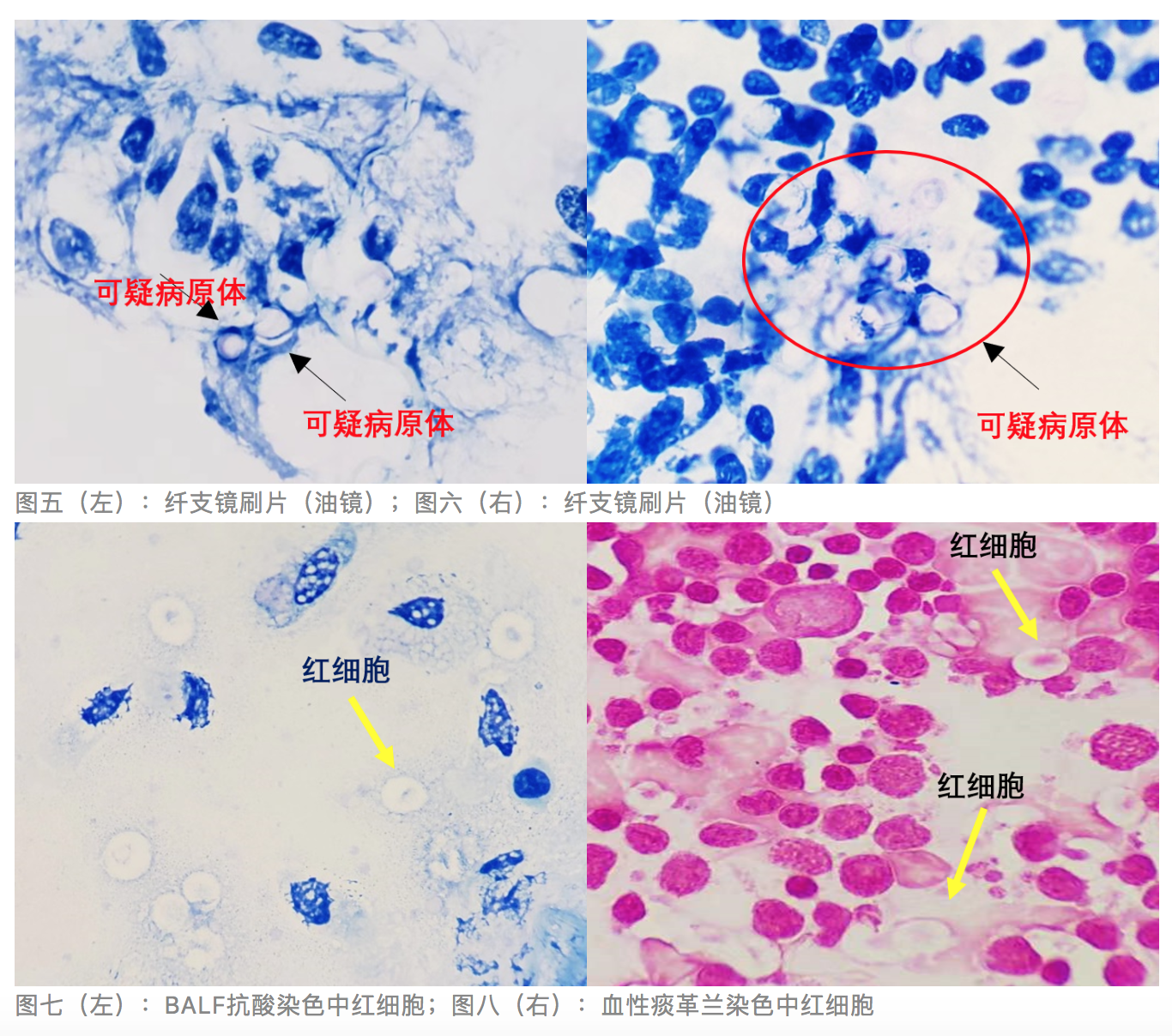
抗酸染色对于抗酸杆菌的识别特异性高,但对其他病原分辨率低,于是,将刷片脱色后革兰染色镜检:可见卵圆形酵母菌样真菌孢子,不易着色或着色斑驳不均,单极出芽,体积相差较大,可见巨大的酵母细胞,似泰坦细胞,菌体外隐约可见荚膜。

图九:纤支镜刷片:革兰染色(油镜)
注:泰坦细胞(Titan Cell):隐球菌在感染过程中可形成异常增大的细胞,胞体直径大于15 µm或总尺寸(包括荚膜)超过 30 µm,被称为泰坦细胞。因体积巨大,很难被吞噬,可在机体内长期存活,泰坦细胞是其适应宿主,逃避人体免疫反应的机制之一[3]。
BALF革兰染色涂片镜检:合格标本,以巨噬细胞为主,中性粒细胞少见,未见细菌及真菌菌丝,但可见少量卵圆形酵母样真菌孢子,有颗粒感,菌体外一圈淡粉色粘液层,细胞壁塌陷,似方向盘 ©(见图十、图十一)。
BALF涂片:革兰染色(油镜)
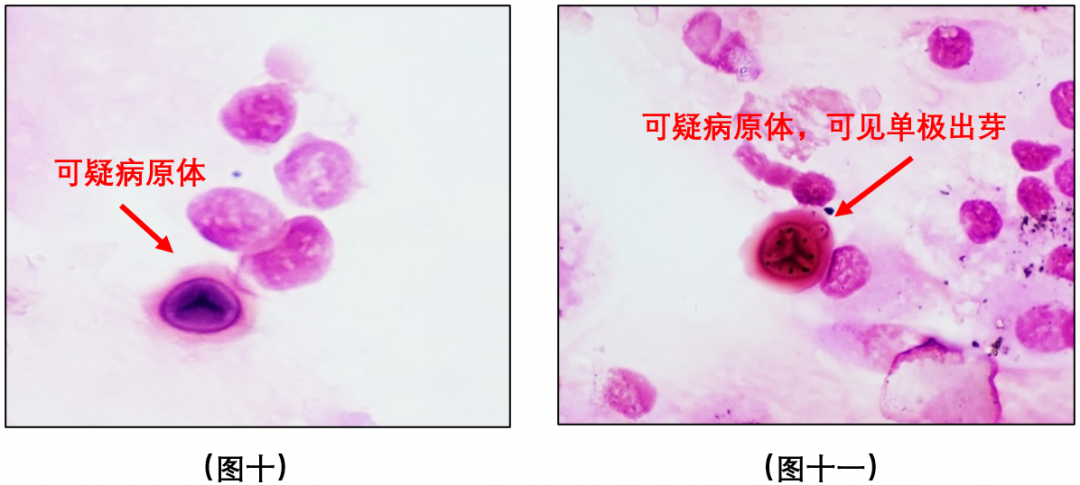
根据以上形态学特征,初步考虑隐球菌感染可能性大,但完整的病原学诊断还需结合临床。
病情介绍
现病史:患者女,38岁,因「咳嗽1月,头痛半月,发热1天」门诊以肺部感染收治入院。
入院前两月,患者无明显诱因反复出现上呼吸道症状,1月前,患者反复出现咳嗽、咳痰,外院间断口服药物及输液治疗3天(具体用药不详),咳嗽症状稍缓解,入院前半月,患者出现头痛,起病初期呈全头部胀痛,后逐渐呈阵发性跳痛,院外曾行颅脑MRI,未予特殊处理。4月28日于我院门诊就诊,胸片提示右下肺感染,给予左氧氟沙星等药物口服治疗后无明显好转,后出现发热入院,最高体温37.5℃。
既往史:7月前外院明确诊断溶血性贫血,治疗后好转出院。院外长期服用「甲泼尼龙」片治疗。否认结核、糖尿病、脑血管疾病及精神疾病史。
个人史:公司职员,自述办公环境及居住环境清洁状况较好,住所周围环境较脏。否认饲养及接触宠物、禽类,鸟类者。
辅助检查:2022-05-01我院血常规:WBC:6.26×10^9/L,RBC:4.04×10^12/L,HGB:103g/L↓,N:81.6% ↑L:8.9%↓,CRP:10.780mg/L↑,PCT:0.052ng/ml↑。甲型流感病毒IgM抗体、呼吸道合胞病毒IgM抗体、腺病毒IgM抗体:阳性,感染三项正常,GM试验:阴性。血培养:培养五天无细菌生长。痰涂片:WBC:少许 /LP,SCE:>10/LP,查见正常菌群细菌。痰培养:普通培养无致病细菌生长,培养无真菌生长。
05-02影像学(肺部CT)提示:右下肺片状密度增高影(右肺下叶可见条片及结节状实变影)(见图十二:肺窗),纵隔内多发淋巴结显示,部分增大(见图十三:纵隔窗)。
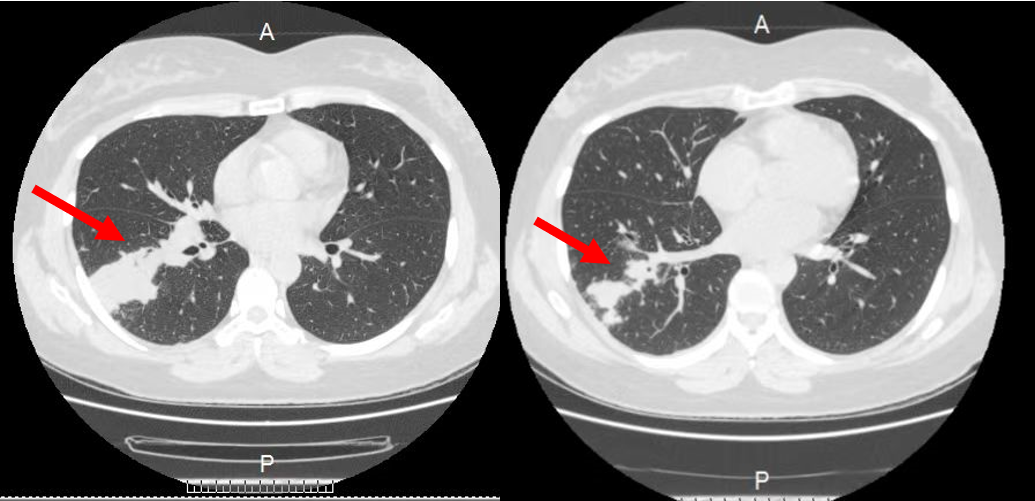
图十二:肺窗
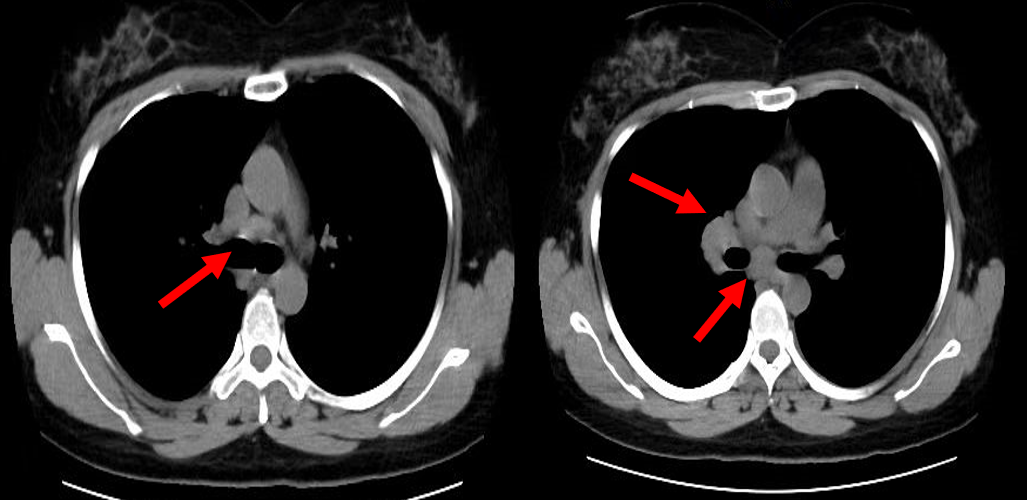
图十三:纵隔窗
初步诊断
1、社区获得性肺炎,非重症;2、急性上呼吸道感染;3、血管神经头痛?4、溶血性贫血。
抗生素使用情况:入院后给予阿莫西林克拉维酸1.2g,q8h,5d,左氧氟沙星0.5g,qd,5d。治疗效果欠佳,于05-08再次行肺部增强CT,并行纤维支气管镜检查。
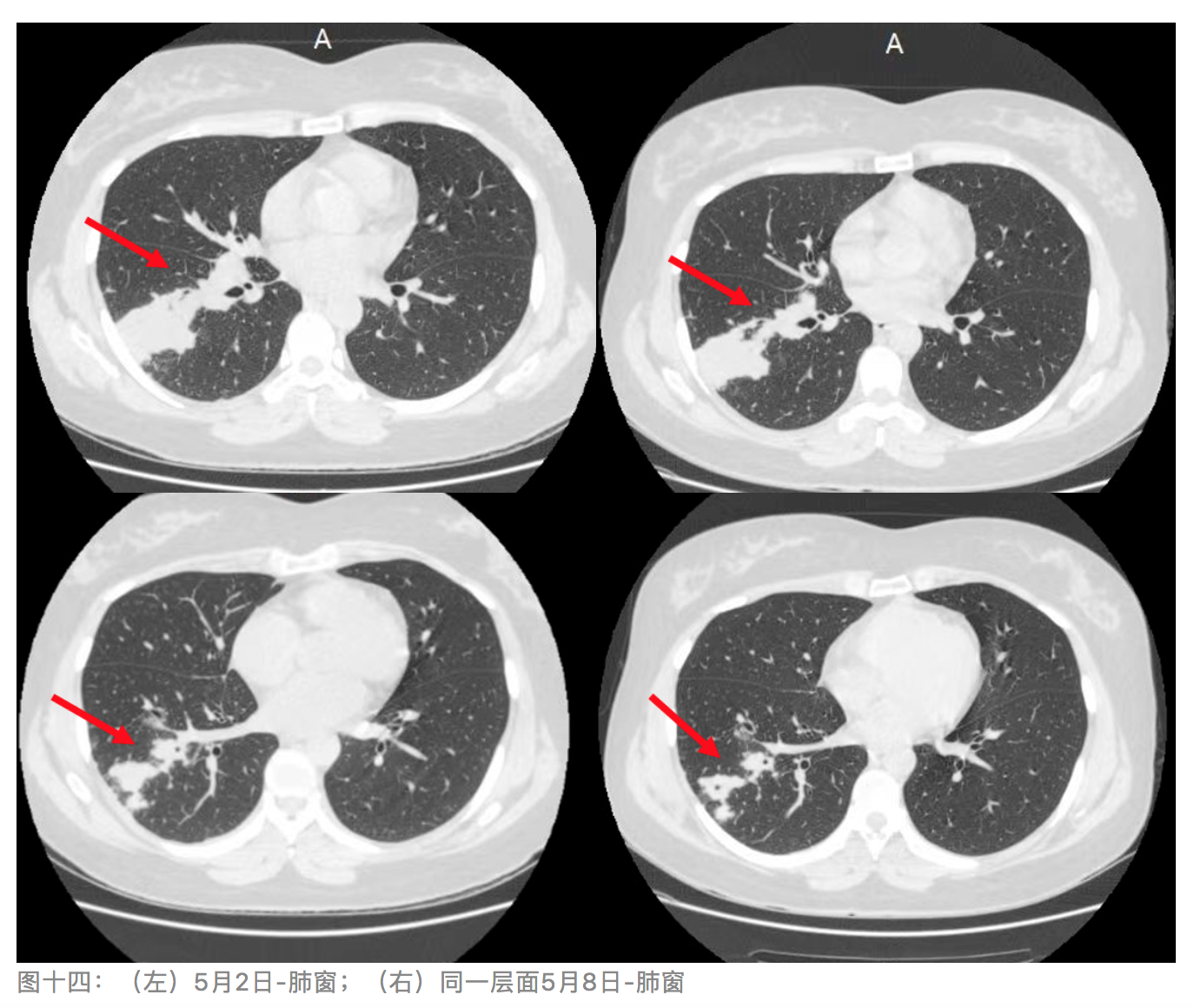
5-08复查肺部CT提示:右肺下叶炎症较05-02略有吸收减少但出现空洞,内壁光滑,未见明显气液平,纵隔窗无变化。(见下图十四)
气管镜提示:右肺下叶前基底段急性炎症(见下图十五)粘膜肿胀不光滑,易出血。刷检部位:右肺下叶前基底段外侧支。刷片及BALF送检脱落细胞检查:未见癌细胞。

病原学诊断思维
1、患者有咳嗽,咳痰等临床症状,支持肺部感染。
2、患者长期口服激素,免疫功能低下,具备真菌感染的易感因素。
3、影像学提示右肺下叶炎症,可见条片及结节状实变影,支持感染。
4、抗生素使用时间较长,且院外及我院两联广谱抗生素治疗效果不佳,而左氧氟沙星和阿莫西林/克拉维酸可覆盖常见社区获得性细菌感染病原体及军团菌,亦能覆盖衣原体、肺炎支原体等非典型病原体,但不能覆盖真菌,影像学提示病灶在抗生素使用后仍较前进展,存在真菌感染可能。
5、气管镜提示急性炎症,虽未能活检明确,但病灶处刷片可见酵母样真菌孢子,形态学特征疑似隐球菌,支持真菌感染。
6、BALF涂片可见酵母样真菌孢子,形态学特征疑似隐球菌。
病原学初步诊断结论
综上所述,考虑隐球菌感染可能性较大!立即联系临床(见图十六)并建议:
1、免疫功能低下患者,多项呼吸道病毒抗体阳性,存在混合感染可能,建议送检T淋巴细胞亚群检测,评估患者免疫功能。
2、隐球菌可导致慢性脑膜炎[4],症状可不典型,IDSA隐球菌病治疗临床实践指南(2010年版)[5]、隐球菌性脑膜炎诊治专家共识2018年版等建议对于任何伴有发热、头痛以及CNS相关体征或症状的免疫功能受损患者 [6],肺部有病灶时,应常规腰穿排除颅内感染,建议患者完善腰穿。
3、患者有发热,初次血培养阴性,或因隐球菌生长较慢,常规培养时间不足,建议再次采集血培养送检。
4、建议外送血清及BALF隐球菌荚膜抗原检测。

图十六
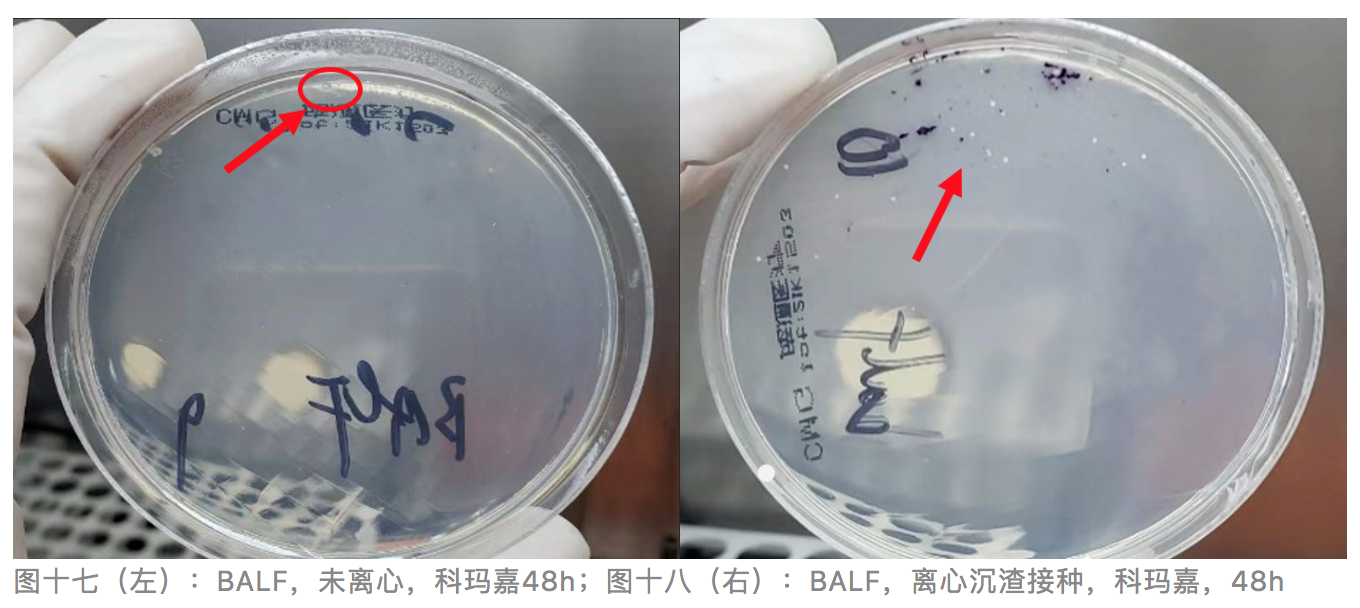
后续培养情况:因菌量极少,将BALF离心沉渣再次接种,48h后,离心后接种较未离心生长更多菌落(见图十七、十八),挑取该菌落涂片镜检:可见卵圆形酵母样真菌孢子,单极出芽,在母体和子细胞之间有缩窄的颈(见图十九),体外培养可见泰坦细胞(见图二十),形态学特征符合隐球菌,经鉴定为新型隐球菌。

最终诊断
新型隐球菌肺炎
T淋巴细胞亚群检测结果回报:总T淋巴细胞亚群比率CD3+:79.51%,辅助性T淋巴细胞比率CD3+CD4+:14.38%↓,抑制性T淋巴细胞比率CD3+CD8+:54.54%↓CD4/CD8:0.26%。提示患者免疫功能低下:患者有溶血性贫血,如病情允许可考虑减量或停用激素,并随访复查T淋巴细胞亚群检测。
治疗情况:确诊后,停用左氧氟沙星和阿莫西林克拉维酸,改为氟康唑0.4g,qd。
结局:5月15日好转出院,出院带药氟康唑0.4g,qd序贯治疗。
随访:6月1日复查肺部CT:右下肺病灶较5-02减少,纵隔未见肿大淋巴结影。目前仍在治疗随访中,每月复查CT。
后续治疗情况:下图为出院后复查CT与入院时对比,可见病灶明显吸收。


流行病学、致病性及临床表现
隐球菌可引起人类隐球菌病,肺部是最常见的感染部位 [7]。常因吸入空气中漂浮的隐球菌孢子而感染(见图二十三),由于孢子很小(1-2µm),吸入后可沉积在呼吸道深处,到达肺泡后,在胸膜下形成炎性肉芽肿[8, 9],故典型的CT表现为胸膜下2cm内的结节,常沿气道分布[9]。这可能是肺隐球菌病灶多位于肺外周带,且靠近胸膜的原因。
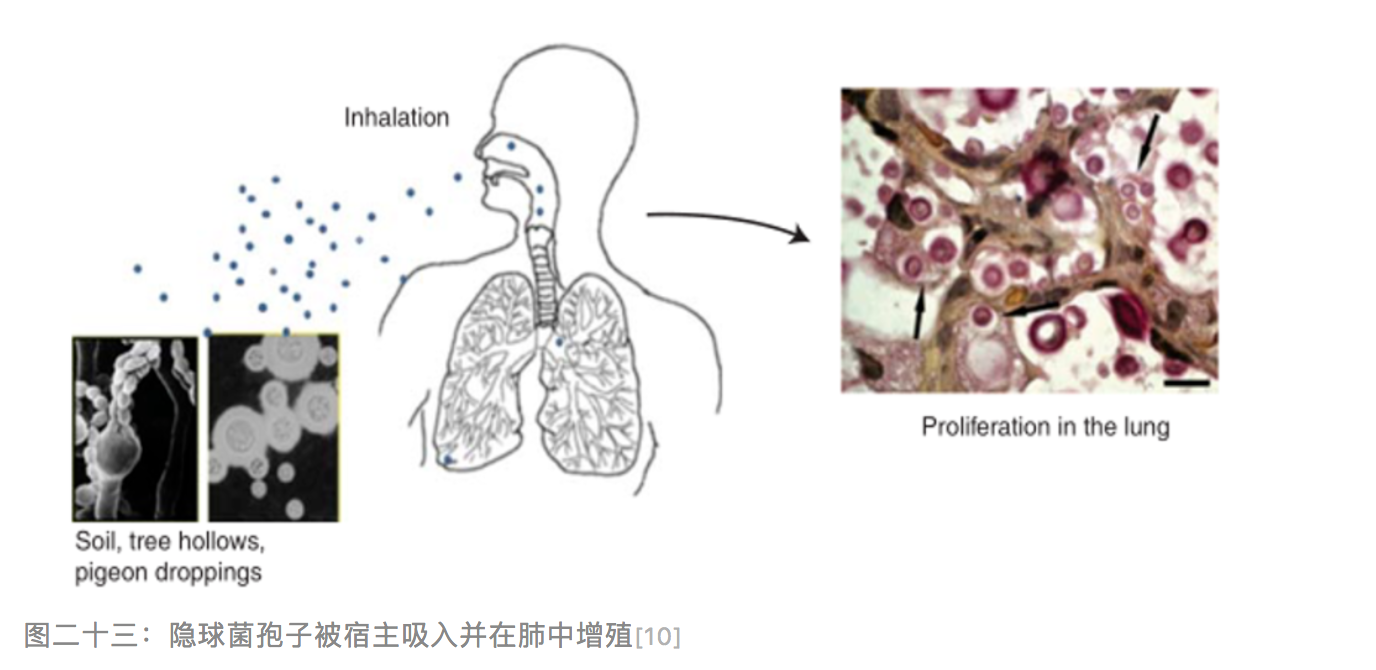
隐球菌的影像学表现主要有:1、结节肿块型;2、实变影和磨玻璃为主;3、弥漫混合型;4、弥漫粟粒型。CT表现与患者的免疫状态相关,免疫健全患者病灶多局限,呈结节或肿块影,免疫功能低下患者影像学特征较为多变,可为结节肿块影、实变影、磨玻璃密度影单独或混合出现。而胸膜凹陷征、血管集束征、胸腔积液、淋巴结肿大、空洞等亦更多地出现在此类患者中[11, 12]。
肺隐球菌病在免疫健全及免疫低下人群中均可发病,免疫健全患者的感染多局限,可为一过性感染,而免疫功能低下患者常为进行性,少数患者可播散至全身。常见症状为咳嗽、咳痰、伴或不伴发热、头痛、胸痛、咯血、乏力、盗汗等[7, 13, 14]。据文献报道,在撒哈拉以南非洲、亚洲和南美洲等地区,新型隐球菌在HIV+ 患者中分离率较高[3],而在我国,情况却截然不同,87.75%的肺隐球菌感染患者没有明显的免疫缺陷[15],肺部病灶多为偶然发现。此外,长期应用糖皮质激素、器官移植、晚期恶性肿瘤、糖尿病、结节病和特发性CD4淋巴细胞减少症等为隐球菌感染的高危因素,并且在这类人群中,发生播散性感染的概率较一般人高[10],如未得到及时有效治疗,严重者可危及生命,所以,早发现,及时干预,对症治疗尤为重要。而我们微生物人的责任就是要当好临床的眼睛,刻苦钻研,练就火眼金睛,为临床指明方向,使患者获益。
讨论部分
本文从实验室视角,逐层剖析,自形态学诊断入手,结合影像,临床,运用病原学诊断思维,优化培养流程等手段,最终分离到病原体,为临床确诊及针对性地治疗提供了依据,充分体现了形态学诊断技术在病原学诊断中的重要作用。
1、目前隐球菌病的诊断方法主要有:培养方法、分子检测、免疫学方法、组织病理学方法等,其中隐球菌荚膜抗原检测仅需采集血液标本,创伤小,对于隐球菌感染的诊断特异性敏感性高[16],但受某些地区无收费标准、试剂成本等因素限制,未能广泛开展,如何在现有条件下利用现有检测手段,提高检出率值得我们关注和思考。
2、患者首次痰培养未能获取病原菌,或因标本采集不合格所致,由此可见,标本规范采集非常重要。
3、近年来,我室隐球菌检出率逐渐增高,这与肺泡灌洗液、纤支镜刷片等高质量标本送检率增高有关,经摸索总结出以下经验:
(1)临床与微生物需及时沟通:在该病例中,标本涂片镜检以巨噬细胞为主,中性粒细胞少,菌量少,如临床未告知患者长期使用激素,很少会考虑到感染或关注到此类病原体,容易漏检。
(2)肺组织培养为确诊肺隐球菌病的金标准,但因肺穿刺对患者有损伤,接受程度较低。而BALF、支气管毛刷等样本创伤程度小,是较好的选择。
(3)BALF受生理盐水稀释影响,往往菌量较少,离心沉渣接种或使用专用离心管富集后接种可提高检出率。
(4)我院分离的多个病例均发现纤支镜刷片中菌量较BALF中菌量大,直接刷检自病灶的支气管毛刷样本分离率或可更高。
(5)隐球菌科在科玛嘉培养基上多为淡粉色菌落,更易识别,故可同时加种,提高检出率。
4、病原微生物诊断实验室应搭建多学科,多种诊断方法,信息化诊断平台,为临床实现精准诊断提供帮助。
* 本文经鲁炳怀主任、陈杏春、徐和平教授指导审阅,在此表示感谢!
参考文献 (可上下滑动浏览)
[1] Ramirez J A, Musher D M, Evans S E, et al. Treatment of Community-Acquired Pneumonia in Immunocompromised Adults: A Consensus Statement Regarding Initial Strategies [J]. Chest, 2020, 158(5): 1896-1911.
[2] 周海霞, 冯玉麟. 免疫抑制患者的肺部感染[J]. 中国呼吸与危重监护杂志 2014, 13(04): 423-426.
[3] Trevijano-Contador N, De Oliveira H C, García-Rodas R, et al. Cryptococcus neoformans can form titan-like cells in vitro in response to multiple signals [J]. PLoS pathogens, 2018, 14(5): e1007007.
[4] 朱利平, 石尧忠, 翁心华,等. 慢性脑膜炎140例临床分析 [J]. 中华传染病杂志 1997, 15(3): 57-58.
[5] Perfect J R, Dismukes W E, Dromer F, et al. Clinical practice guidelines for the management of cryptococcal disease: 2010 update by the infectious diseases society of america [J]. Clin Infect Dis, 2010, 50(3): 291-322.
[6] 刘正印, 王贵强, 朱利平, 等. 隐球菌性脑膜炎诊治专家共识[J]. 中华内科杂志 2018, 57(5): 317-323.
[7] 斯崇文,贾辅忠,李家泰. 感染病学 [M]. 北京: 人民卫生出版社, 2004.
[8] Sabiiti W, May R C. Mechanisms of infection by the human fungal pathogen Cryptococcus neoformans [J]. Future microbiology, 2012, 7(11): 1297-1313.
[9] Wang D, Wu C, Gao J, et al. Comparative study of primary pulmonary cryptococcosis with multiple nodules or masses by CT and pathology [J]. Experimental and therapeutic medicine, 2018, 16(6): 4437-4444.
[10] Kwon-Chung K J, Fraser J A, Doering T L, et al. Cryptococcus neoformans and Cryptococcus gattii, the etiologic agents of cryptococcosis [J]. Cold Spring Harbor perspectives in medicine, 2014, 4(7): 1-27.
[11] 黄耀, 隋昕, 宋兰, 等. 肺隐球菌病影像学表现[J]. 中国医学科学院学报 2019, 41(6): 832-836.
[12] Lindell R M, Hartman T E, Nadrous H F, et al. Pulmonary cryptococcosis: CT findings in immunocompetent patients [J]. Radiology, 2005, 236(1): 326-331.
[13] 温海. 隐球菌感染诊治专家共识[J]. 中国真菌学杂志 2010, 5(2): 65-68.
[14] 王超宇, 隗明, 刘永哲, 等. 肺内外隐球菌感染病例的临床特征分析[J]. 首都医科大学学报 2021, 42(2): 328-333.
[15] Mo Z, Li C, Liang Z, et al. Clinical analysis of non-AIDS patients with pulmonary cryptococcosis and the change in their clinical features over 30 years in a tertiary hospital in Beijing, China [J]. Jpn J Infect Dis, 2022.
[16] 陈栎江, 吴庆, 徐春泉, 等. 血清隐球菌荚膜多糖抗原检测在肺隐球菌病中的早期诊断价值[J]. 中国抗生素杂志 2018, 43: 1248-1251.
作者简介

向丽丽
主管检验师,重庆沙坪坝区陈家桥医院(重庆医药高等专科学校附属医院)微生物组组长,从事临床微生物检验工作11年,擅长微生物形态学检验及病原学诊断,有着丰富的微生物形态学诊断经验,对少见菌、疑难菌分离鉴定有独特心得。积累了大量临床病例及丰富的病原学诊断经验,参编临床微生物《形态学检验图谱与案例》一书,以第一作者发表SCI论文一篇,影响因子2.62。
作者:向丽丽 - 重庆沙坪坝区陈家桥医院;审校:赵鸿(北京大学第一医院)、黄金伟(丽水市人民医院)
本文转载自订阅号「京港感染论坛」(ID:PIDMIC)
原链接戳:【病例讨论】拨云见日——形态学诊断显神通


