
摘要
本文报道1例65岁男性患者,因滤泡性淋巴瘤接受奥妥珠单抗治疗联合化疗,于第2程化疗后感染新型冠状病毒,主要表现为发热、咳嗽,影像学示双肺多发磨玻璃影,抗病毒治疗后鼻咽拭子新型冠状病毒核酸可暂时转阴,但此后反复阳性。第4次新型冠状病毒核酸阳性后出现活动后气短,伴低氧血症,乳酸脱氢酶及1,3-β-D葡聚糖试验升高,痰肺孢子菌核酸阳性。诊断新型冠状病毒持续感染、新型冠状病毒肺炎(重型),合并肺孢子菌肺炎,给予康复期血浆输注、磺胺、糖皮质激素治疗后病情好转,出院后随访患者病情稳定。
患者男,65岁。因“反复发热、咳嗽4个月,气短8 d”于2023年4月21日就诊于北京协和医院。
患者2022年12月15日因滤泡性淋巴瘤接受第2程G-CHOP方案治疗(奥妥珠单抗1 g静脉滴注d0,环磷酰胺1.5 g静脉滴注d1,表柔比星140 mg静脉滴注d1,长春地辛4 mg静脉滴注d1,泼尼松120 mg口服d1~d5),化疗前外周血白细胞计数7.57×10^9/L,中性粒细胞5.64×10^9/L,淋巴细胞0.93×10^9/L,免疫球蛋白G为7.37 g/L。
2022年12月21日出现发热,体温高峰39.3 ℃,伴咳嗽、咳少量白黏痰,无气短,自测新型冠状病毒抗原阳性。
2022年12月26日就诊当地医院,测脉氧饱和度96%(未吸氧状态),血常规示白细胞0.48×10^9/L,中性粒细胞0.07×10^9/L,淋巴细胞0.29×10^9/L,血红蛋白、血小板计数在正常范围;超敏C反应蛋白55 mg/L;胸部CT可见双肺多发斑片状磨玻璃影,沿支气管血管束及胸膜下分布;给予人粒细胞刺激因子150 μg皮下注射,转诊至我院发热门诊,考虑新型冠状病毒肺炎、粒细胞缺乏症伴发热,给予奈玛特韦300 mg/利托那韦100 mg口服、1次/12 h、共5 d,厄他培南1 g静脉滴注1次/d、共7 d治疗,患者症状好转,2023年1月4日测新型冠状病毒抗原阴性。
2月1日复查血常规、超敏C反应蛋白、肝肾功能正常范围,开始行第3程G-CHOP方案治疗(具体用药同前)。患者2月5日再次出现发热、咳嗽、咳白黏痰,逐渐加重,2月10日就诊当地医院,测脉氧饱和度93%(未吸氧状态),新型冠状病毒核酸阳性,血常规示白细胞2.01×10^9/L,中性粒细胞1.77×10^9/L,淋巴细胞0.12×10^9/L;C反应蛋白64 mg/L;胸部CT:双肺磨玻璃影较前增多,伴网格影(图1~3);当地医院给予奈玛特韦/利托那韦口服5 d、甲泼尼龙40 mg静脉滴注7 d、哌拉西林舒巴坦静脉滴注14 d,患者症状好转,2月16日复查新型冠状病毒核酸阴性,胸部CT较前部分吸收(图4~6)。

图1~3 胸部CT(2023年2月10日)可见双肺沿支气管血管束及胸膜下分布的多发斑片影
图4~6 胸部CT(2023年2月16日)可见双肺病变较前部分吸收
2月21日出现低热,复查新型冠状病毒核酸阳性,再次口服奈玛特韦/利托那韦5 d后复查核酸阴性。3月20日患者出现发热,体温高峰39 ℃,伴咳嗽、咳白黏痰。
3月29日就诊当地医院,测新型冠状病毒核酸阳性,查白细胞7.02×10^9/L,淋巴细胞0.9×10^9/L;C反应蛋白70 mg/L;胸部CT示原有病灶较前新收,双肺新发支气管血管束周围磨玻璃影(图7~9);给予阿兹夫定5 mg口服2周,泼尼松30 mg口服2周,体温高峰降至37.5 ℃,仍有间断咳嗽。
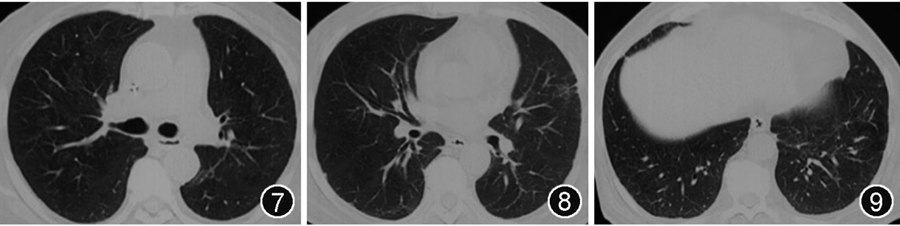
图7~9 胸部CT(2023年3月29日)可见双肺原有病变进一步吸收,新发双肺弥漫性支气管血管束周围磨玻璃影
4月13日患者出现活动后气短,自测脉氧饱和度最低降至87%(未吸氧状态),就诊当地医院,测动脉血气氧分压56 mmHg(1 mmHg=0.133 kPa),血白细胞6.27×10^9/L,淋巴细胞0.87×10^9/L;C反应蛋白60 mg/L;新型冠状病毒核酸阳性,CT值17.78;给予奈玛特韦/利托那韦口服,继续泼尼松30 mg口服,患者体温恢复正常,仍有活动后气短,为进一步诊治收入我院。
起病以来,精神、食欲、睡眠欠佳,嗅觉、味觉减退,大小便正常,体重下降18 kg(100 kg减至82 kg)。
既往史:患者2022年11月因胸闷、喘憋发现多浆膜腔积液、全身多发肿大淋巴结、腹膜增厚,行锁骨上淋巴结活检,病理示非霍奇金淋巴瘤(滤泡性淋巴瘤,低级别,Ann Arbor IVB期,高危)。2022年11月17日、2022年12月15日、2023年2月1日于我院分别行第1~3程G-CHOP方案化疗(方案同前),2023年3月22日评估疗效完全缓解,血液科会诊建议暂停化疗。否认既往反复感染病史。高血压、糖尿病病史多年,药物控制可。新型冠状病毒疫苗曾接种三剂(2021年5月、2021年6月、2021年11月)。个人史:年轻时曾做电焊工3年;吸烟指数40包年,戒烟5个月。家族史:父亲因肺癌去世。
体格检查:体温36.2 ℃,血压123/80 mmHg,脉搏86 次/min,呼吸频率22次/min,脉氧饱和度93%(未吸氧状态),体重指数25.0 kg/m2。全身未见皮疹,浅表淋巴结未触及肿大。胸骨无压痛,双侧呼吸运动对称,听诊双肺呼吸音清,未闻及明显干湿性啰音及胸膜摩擦音。心腹体检未见明显异常。双下肢无水肿。
入院后血常规:白细胞6.62×10^9/L(正常参考值:3.5~9.5×10^9/L),中性粒细胞 6.01×10^9/L(正常参考值:2.00~7.50×10^9/L),淋巴细胞 0.47×10^9/L(正常参考值:0.80~4.00×10^9/L),血红蛋白 106 g/L(正常参考值:120~160 g/L),平均红细胞体积、血小板计数正常范围。外周血淋巴细胞亚群:B细胞0个/μl(正常参考值:180~324个/L),T细胞297个/μl(正常参考值:1 185~1 901个/μl),CD4+T细胞130个/μl(正常参考值:561~1 137个/μl),CD8+T细胞153个/μl(正常参考值:404~754个/μl),自然杀伤(NK)细胞216个/μl(正常参考值:175~567个/μl)。免疫球蛋白:IgG 3.36 g/L(正常参考值:7.00~17.00 g/L),IgA 0.50 g/L(正常参考值:0.70~4.00),IgM 0.09 g/L(正常参考值:0.40~2.30 g/L)。超敏C反应蛋白 67.87 mg/L(正常参考值:<8 mg/L),ESR为34 mm/1 h,IL-6为51.1 ng/L(正常参考值:<5.9 ng/L)。乳酸脱氢酶545 U/L(正常参考值:0~250 U/L),余肝肾功能正常范围。1,3-β-D葡聚糖试验500.6 ng/L(正常参考值:<100 ng/L)。凝血功能、降钙素原、巨细胞病毒核酸、曲霉半乳甘露聚糖均阴性。痰肺孢子菌核酸阳性,痰细菌培养、真菌培养、抗酸染色阴性。鼻咽拭子新型冠状病毒核酸CT值36.57;血新型冠状病毒抗体(IgM、IgG)阴性。胸部CT见双肺弥漫性磨玻璃影,范围较前增大(图10~12)。
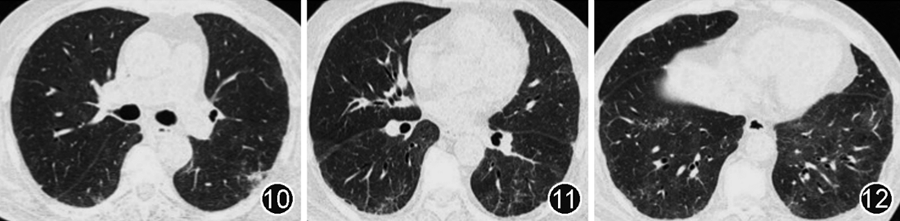
图10~12 胸部CT(2023年4月21日)可见双肺弥漫性磨玻璃影,范围较前增大
综合病史及检查结果,诊断为持续新型冠状病毒感染合并肺孢子菌肺炎。针对肺孢子菌肺炎,加用磺胺甲噁唑/甲氧苄啶1.44 g口服、4次/d、共21 d,激素调整为甲泼尼龙40 mg静脉滴注、1次/12 h治疗5 d后改为1次/d治疗5 d、之后改为泼尼松30 mg口服11 d。新型冠状病毒感染方面,本次抗病毒治疗10 d后复查患者鼻咽拭子核酸已转阴,因存在体液免疫缺陷状态、病毒清除困难,给予输注康复期血浆400 ml/d共5 d,复查新型冠状病毒IgG升至32.01 S/CO,总IgG升至7.12 g/L。治疗后患者呼吸道症状明显改善,脉氧饱和度97%(未吸氧状态),超敏C反应蛋白、1,3-β-D葡聚糖试验降至正常,乳酸脱氢酶降至318 U/L。
出院随访(末次随访日期2023年9月11日):患者口服预防量磺胺甲噁唑与甲氧苄啶片,体温、脉氧饱和度正常,无明显不适主诉,外周血淋巴细胞逐渐升至1.69×10^9/L,6月7日胸部CT示双肺磨玻璃影明显吸收。6月7日复查血IgG降至3.63 g/L,补充人免疫球蛋白后7月7日复查血IgG为6.19 g/L。8月10日复查血常规:白细胞7.38×10^9/L,中性粒细胞4.85×10^9/L,淋巴细胞1.69×10^9/L;外周血淋巴细胞亚群:B细胞0个/μl,T细胞641个/μl,CD4+T细胞392个/μl,CD8+T细胞225个/μl;免疫球蛋白:IgG为4.73 g/L,IgA为0.45 g/L,IgM为0.13 g/L,再次给予补充人免疫球蛋白治疗;8月29日PET/CT提示淋巴瘤病情维持完全缓解状态。
讨论
陈茹萱(呼吸与危重症医学科):本例患者为老年男性,基础因高危滤泡性淋巴瘤接受奥妥珠单抗治疗联合化疗,既往淋巴细胞计数及免疫球蛋白水平正常。于新型冠状病毒流行期间出现发热、肺部阴影,新型冠状病毒检测阳性,合并化疗相关粒细胞缺乏状态,给予抗病毒、人粒细胞刺激因子及对症支持治疗后病情一度好转,抗原转阴。但之后反复出现发热伴新型冠状病毒核酸检测阳性,肺内阴影加重,多次接受抗病毒治疗及糖皮质激素治疗可短期好转。本次就诊前患者出现活动后气短伴低氧血症,新型冠状病毒检测阳性,伴痰肺孢子菌核酸阳性,考虑为持续新型冠状病毒感染合并肺孢子菌肺炎。
杨燕丽(呼吸与危重症医学科):患者为免疫抑制人群,在接受抗CD20单抗治疗及化疗后存在B淋巴细胞清除及粒细胞缺乏状态下感染新型冠状病毒并出现病毒性肺炎(中型),初期经标准抗病毒治疗后病情好转,间隔1个月再次接受化疗后患者再出现新型冠状病毒肺炎(重型),接受抗病毒治疗及糖皮质激素治疗后一度好转,但停药后病情反复,鼻咽拭子核酸多次复阳。虽然患者病程中未接受病毒株型鉴定,结合患者病史,考虑为病毒持续感染可能性大。据文献报道,接受抗CD20单抗治疗的患者(主要包括淋巴瘤、自身免疫性疾病)新型冠状病毒核酸持续阳性的中位时间为22 d(最长65 d)[1],且抗CD20单抗治疗是血液系统恶性疾病患者感染新冠后再入院的重要危险因素[2]。此类患者病毒清除能力受损,在上呼吸道标本新冠检测转阴时,下呼吸道标本(如痰、支气管肺泡灌洗液)可依然呈阳性[1,3, 4],可能需要延长抗病毒药物疗程[5],并考虑联合恢复期血浆[6]、病毒单克隆抗体[5]辅助病毒清除。
麦毓麟(感染内科):该患者抗CD20单抗联合细胞毒化疗后出现新冠感染迁延不愈,根据纪念凯特琳癌症中心(Memorial Sloan-Kettering Cancer Center,MSKCC)定义[7],新冠核酸首次阳性后≥30 d后检测仍为阳性者为新冠持续感染,多见于免疫缺陷人群,表现为病毒持续阳性、持续呼吸道症状和宿主内病毒演变。MSKCC目前最大规模的血液肿瘤合并新冠感染的队列研究[2]结果显示,外周血淋巴细胞<500个/μl和1年内抗CD20单抗或细胞治疗(含造血干细胞移植)和新冠持续感染相关,CD4+T细胞<100个/μl者60 d病死率是>100个/μl者的2.62倍,CD8+T细胞<50个/μl者是>50个/μl的3.50倍,多因素分析发现心血管病基础、当前接受抗淋巴瘤治疗和1年内CAR-T治疗与病死率独立相关。有研究提示,B细胞功能缺陷患者,新冠病毒延迟清除;仅有CD8+T细胞反应不足以清除病毒;B细胞功能缺陷患者中,CD4+T细胞功能正常者可以清除病毒[8]。在新冠感染流行期间可定期(如每3个月)检测外周血淋巴细胞亚群,包括B细胞、T细胞、CD4+T细胞和CD8+T细胞计数,若当地实验室条件允许,可进一步完善上述各个细胞的激活亚群、功能亚群的检测。
沈恺妮(血液内科):接受抗CD20单抗治疗的B细胞非霍奇金淋巴瘤患者,B淋巴细胞的清除状态可长达6~9个月。在病毒感染的急性期,尽管这些患者体液免疫受损,但CD8+T淋巴细胞可以发挥重要的抗病毒作用,这解释了为什么现有文献报道提示接受抗CD20单抗治疗并不增加急性期死亡风险[9]。然而,B淋巴细胞在后期的病毒清除中至关重要,致使这些患者容易核酸持续阳性,呼吸系统症状及肺部病灶迁延[10]。近1年内接受抗CD20单抗治疗是因新冠感染住院的淋巴瘤患者住院时间延长(超过30 d)和死亡的危险因素[4]。基于目前的循证医学证据,对于重症、危重症患者,抗肿瘤治疗需暂缓至少20 d,且症状已缓解。轻型、普通型患者因存在新冠进展风险,需要暂缓CD20单抗10 d,CD20单抗联合细胞毒药物的患者,暂缓治疗至少14 d[11]。对于那些抗肿瘤治疗十分急迫的患者,需在充分评估的情况下谨慎提前恢复治疗,并密切监测病情。
施举红(呼吸与危重症医学科):本例患者新冠持续感染诊断明确,曾多次单用奈玛特韦/利托那韦或阿兹夫定,疗程为5~14 d,仍出现病情反复、核酸复阳。目前奈玛特韦/利托那韦等抗病毒药物的推荐用药时机(起病后5 d内)及疗程(5 d)是基于此前临床研究的方案[12],并不适用于所有患者,尤其对于免疫抑制人群可能需要延长抗病毒疗程。2023年一项对19例血液肿瘤合并慢性或复发性新冠感染患者的研究(15例接受抗CD20治疗,均为奥密克戎毒株),接受标准奈玛特韦/利托那韦联合瑞德西韦和抗病毒单抗(绝大部分为Tixagevimab/cilgavimab)治疗,14 d的核酸阴转率可高达75%[5],期间出现4例患者感染复发,再次使用三联治疗但延长奈玛特韦/利托那韦疗程至10 d后迅速获得核酸阴转。对于持续性或复发性新冠感染患者,可尝试不同作用靶点的两种抗病毒药物联用,可同时联合抗病毒单抗或含流行株高滴度抗体的康复期血浆治疗,或在充分考虑药物不良反应及相互作用情况、且无其他可及药物时,延长相同抗病毒药物疗程可促进血液肿瘤患者病毒的清除。目前,美国国立卫生研究院已针对长新冠开展了RECOVER研究(ClinicalTrials.gov ID:NCT05965726)[13],探索长疗程(15或25 d)奈玛特韦/利托那韦治疗长新冠的疗效。
杨燕丽(呼吸与危重症医学科):普遍认为免疫人群中新冠感染后因为体内固有及适应性免疫缺陷,无法快速清除病毒,会促进体内毒株变异。对持续或反复新冠感染的淋巴瘤患者的毒株分析未发现新毒株再感染或共感染,但存在宿主内毒株缓慢进化的证据,在CD8+T细胞计数较低的患者中更为明显[2],这也侧面证实了CD8+T细胞对于病毒体内早期清除的重要作用。
陈茹萱(呼吸与危重症医学科):患者病程后期出现1,3-β-D葡聚糖试验升高,难以用新型冠状病毒感染解释全貌,进一步查痰肺孢子菌核酸阳性,提示合并肺孢子菌肺炎。患者外周血淋巴细胞亚群中B淋巴细胞为清零状态,CD4+T淋巴细胞、CD8+T淋巴细胞计数明显降低,属于机会性感染的易感人群。新冠病毒感染患者存在免疫功能紊乱[14],尤其是重症患者,可出现外周血淋巴细胞计数明显降低。糖皮质激素等免疫抑制治疗的应用作为一把双刃剑,在控制炎症风暴的同时,也可能增加机会性感染的风险,尤其重症患者通常需要力度更强、疗程更久的免疫抑制治疗。新冠病毒感染常见合并或继发感染的病原体包括细菌、真菌、非典型病原体、耶氏肺孢子菌、巨细胞病毒等。如果患者接受新冠肺炎相关治疗后病情无明显改善、甚至恶化,或出现痰液性状明显变化,或胸部影像学显示难以用新冠肺炎解释的病变(如空洞性病变)时,需注意排查有无合并其他病原体感染,可完善呼吸道标本病原学检查(包括真菌涂片及培养、肺孢子菌核酸等)及相关血液化验检查(如降钙素原、1,3-β-D葡聚糖试验、曲霉半乳甘露聚糖、巨细胞病毒核酸等)。新冠病毒感染患者合并肺孢子菌肺炎的危险因素包括低淋巴细胞计数和应用糖皮质激素[15]。由于新冠肺炎与肺孢子菌肺炎的临床表现、实验室检查及影像学表现存在一定的相似性,临床医师需要注意结合患者病情仔细鉴别,血1,3-β-D葡聚糖试验及下呼吸道标本肺孢子菌核酸检测有助于诊断肺孢子菌肺炎。
张婷(呼吸与危重症医学科):对于血液肿瘤合并重症新冠患者中控制炎症药物使用,如糖皮质激素、托珠单抗、巴瑞替尼等,目前尚无高质量研究提供证据,2023年欧洲白血病感染会议(European conference on infections in Leukaemia,ECIL9)更新共识,对于重症、危重症新冠患者仍推荐激素和第二种免疫抑制剂应用,和普通人群无异[16]。对于非HIV感染的血液肿瘤人群,肺孢子菌肺炎发生风险与CD4+T细胞计数(<200个/μl)、大剂量长疗程激素(≥20 mg泼尼松当量,≥1个月)、基础病(急性淋巴细胞白血病)、异基因造血干细胞移植等相关[17]。建议在高危人群中早期启动磺胺甲噁唑/甲氧苄啶一级预防治疗[18]。
施举红(呼吸与危重症医学科):免疫抑制人群在感染各种病原体时,由于存在免疫功能缺陷,病原体不易清除,这类患者的治疗策略值得关注。通过本次临床病例多学科讨论,我们认识到:(1)接受抗CD20单抗治疗的淋巴瘤患者感染新冠病毒后容易出现持续新冠感染,即新冠核酸首次阳性后≥30 d后检测仍为阳性,可表现为持续呼吸道症状和宿主内病毒演变,注意留取下呼吸道标本的新冠病毒核酸以提高检测敏感性。(2)此类患者需要多科室协作共同管理,为患者制定个体化的治疗方案,适当延长抗病毒治疗疗程,考虑联合恢复期血浆、病毒单克隆抗体辅助病毒清除,炎症状态明显时辅以糖皮质激素、托珠单抗等抗炎药物,动态监测患者免疫功能状态。对于原发病尚未缓解的淋巴瘤患者,需要谨慎平衡原发病治疗与新冠病毒治疗之间的关系。(3)在病情反复时需注意仔细鉴别诊断,警惕合并机会性感染,尤其是肺孢子菌肺炎、巨细胞病毒性肺炎等影像学表现与新冠肺炎存在一定相似性的病原体,积极完善相关病原学筛查。希望通过本病例的诊治经验分享,提高临床医师对免疫抑制人群新冠感染的治疗水平,以期改善此类患者的预后。
参考文献(略)
作者:陈茹萱 麦毓麟 沈恺妮 张婷 施举红 杨燕丽;单位:中国医学科学院北京协和医学院北京协和医院呼吸与危重症医学科;中国医学科学院北京协和医学院北京协和医院感染内科
引用本文: 陈茹萱, 麦毓麟, 沈恺妮, 等. 滤泡性淋巴瘤-反复发热-肺部阴影 [J] . 中华结核和呼吸杂志, 2024, 47(3) : 222-227. DOI: 10.3760/cma.j.cn112147-20230829-00112.
本文转载自订阅号「中华结核和呼吸杂志」
原链接戳:【临床病例(理)讨论】滤泡性淋巴瘤-反复发热-肺部阴影
* 文章仅供医疗卫生相关从业者阅读参考
本文完
责编:Jerry



