推荐语
在重症肺炎的救治中,我们重视抗生素的临床应用,但往往会忽视患者的免疫状态,这是重症肺炎治疗中面临的问题之一。解立新教授结合亲历的临床实例深刻为大家讲述了重症肺炎的发病机制,并分析了感染与免疫失衡、免疫耗竭与感染耐受的关系。
以下是《呼吸界》小编整理的解立新教授的精彩演讲,在此分享给大家!
一、临床病例
案例1
患者为ICU住院的急性呼吸窘迫综合征(ARDS)患者,肺部已经出现了纤维化改变,病毒性肺炎的发展迅速,且该患者已经出现了严重的免疫功能紊乱(图1)。
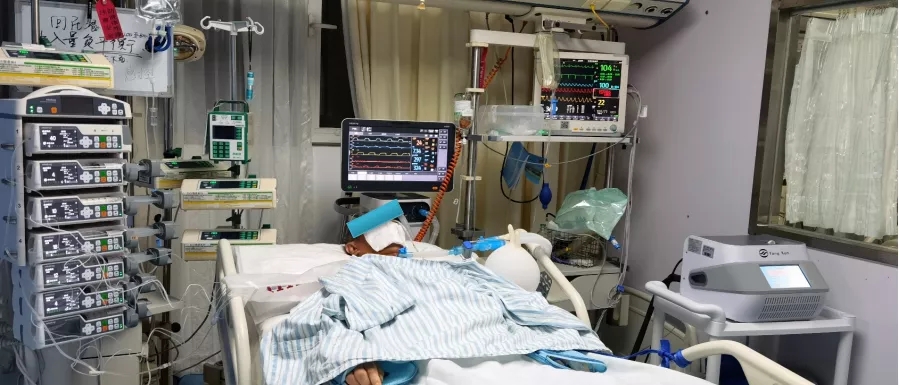
图 1
8月16日:患者住进ICU,患者的CD4和CD8的值低于正常值,有明显的免疫抑制,同时,也出现了炎症高反应性的表现。
8月19日:CD4、CD8指标低于正常值的1/2。注射日达仙,剂量1.6mg/日。
8月26日:CD4、CD8指标基本达到正常值。日达仙作为免疫调节药物,确实能够促进细胞免疫的恢复。结果非常理想,日达仙并没有把患者的炎症反应激活,免疫反应蛋白的指标逐渐下降,患者免疫逐渐增强,感染得到了有效的控制,而且没有出现二次炎症风暴的打击。
8月26日之后,日达仙剂量改成1.6mg/隔日,CD4、CD8指标迅速下降,至8月31日时,达到历史最低。
8月29日-8月31日:复查患者胸部CT,出现了严重的纵膈气肿(图2)。

8月16日 患者胸部CT

8月31日 患者胸部CT
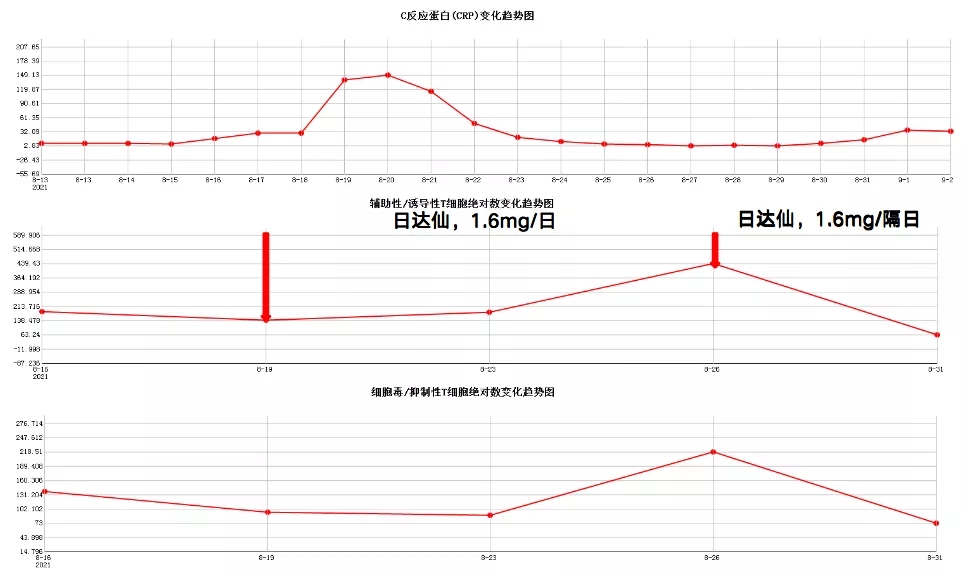
CD4正常值范围:410-1590;CD8正常值范围:190-1140;CRP正常值范围:0-10
图 2:患者1的胸部CT和CD4、CD8、CRP绝对数变化趋势
免疫增强是否只是假象?例如,使用粒细胞集落刺激因子(GCSF)来治疗顽固性粒细胞的缺乏,一旦GCSF停止,白细胞明显下降,是不是骨髓造血的枯竭。那么,细胞免疫增强剂是否也存在类似的作用?这一结果提示我们该患者是否出现了免疫耗竭,单一的免疫增强是不是涸泽而渔?
案例2
患者为重症甲型H1N1流感(甲流)患者。
马XX,男性,61岁,重症病毒性肺炎,急性呼吸窘迫综合征(ARDS)。
2018年1月11日发病,1月24日气管插管有创机械通气,1月27日连续肾脏替代疗法(CRRT),1月29日体外膜肺氧合(ECMO)(图3)。

图 3
2月3日,患者出现了严重的细胞免疫抑制,CD4、CD8指标都非常低。皮下注射胸腺法新,剂量1.6mg 2次/日。
2月7日,CD8指标逐渐上升,CD4指标也在明显改善,但是随后白介素6明显上升,患者肺顺应性明显下降,肺实变进一步加重。
2月8日,患者也出现了严重的气胸(图4)。因此我们要反思是不是免疫增强导致的炎症风暴。

(左)2018-2-5;(右)2018-2-8

图 4:患者2的胸部CT和IL-6、CD4、CD8、活化CD4+细胞的变化趋势
如何确定免疫增强剂给药的时间点?免疫增强剂如何个体化给药需要我们进行深入研究。
目前,糖皮质激素已经有4项大样本的研究结果都支持糖皮质激素对ARDS有效,但是糖皮质激素和胸腺法新面临共同的问题是:如何建立免疫量化评估体系,根据相关指标来指导免疫调节药物的应用时机?这是最棘手的问题。
二、Sepsis数据分析
1、Sepsis-中国数据
2020年邱海波教授在《Crit Care Med》发表了一项中国重症监护(ICU)脓毒症的横断面调查研究(图5)[1]。邱教授在研究中对中国综合ICU患者的病因做了数据分析,其中,在ICU中呼吸系统疾病达到了37.6%(大于1/3),Sepsis病因中呼吸系统感染达68.1%(大于2/3)。这一研究结果表明,呼吸系统感染性疾病是ICU最常见的器官系统疾病,需要我们提高认识。
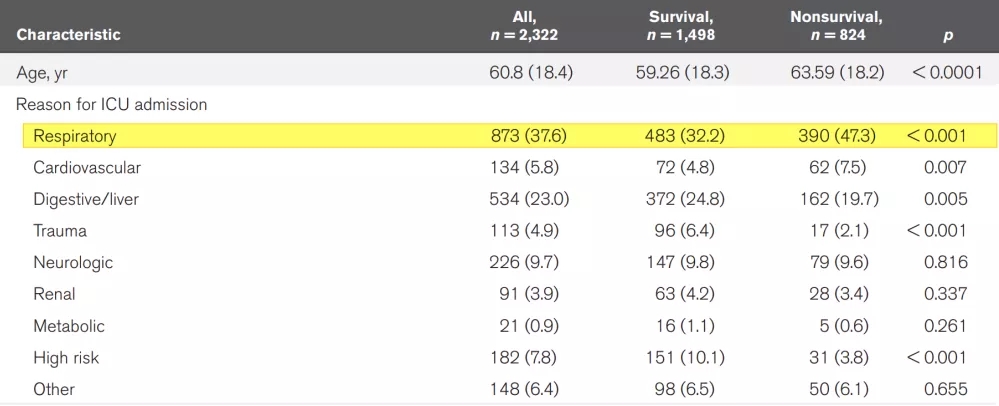
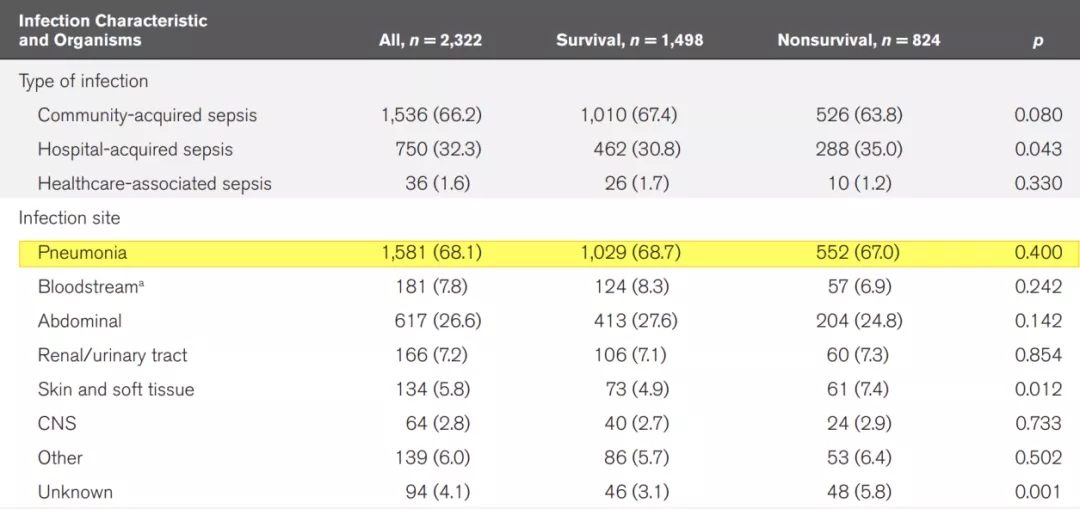
图 5:中国ICU脓毒症流行病学:一项全国横断面调查
2、Sepsis——全球负担
2020年《Lancet》对全球的Sepsis患者做了回顾性的总结:
2017年,全球Sepsis患者大约有4890万人,死亡人数约1100万人,病死率可达19.7%,病死率较高(图6)[2]。

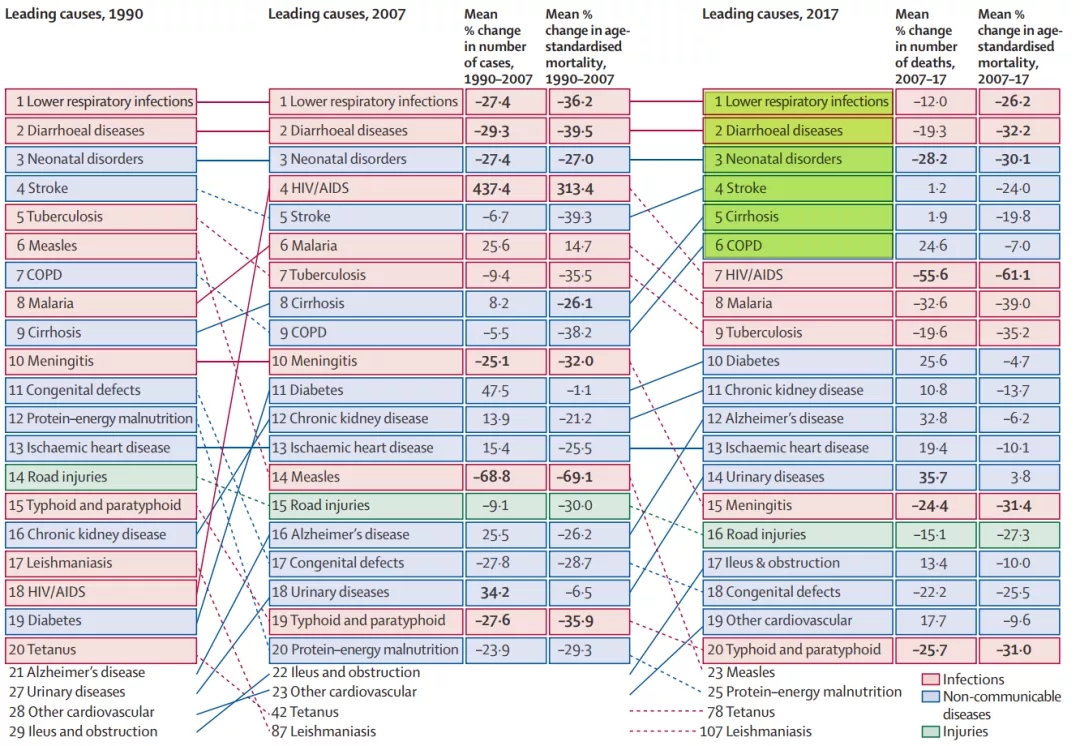
图 6:全球疾病负担研究分析
在Sepsis患者的感染疾病中排名第1位的是下呼吸道感染,因此,无论国内还是国外,下呼吸道感染都是Sepsis感染最主要的疾病之一[2]。
3、Sepsis——医院负担
2020年《Intensive Care Med》发表一篇文章,每1000名伴有脏器功能障碍的Sepsis患者,在医院发病率为9.3(95% CI 7.3-11.9),在ICU中发病率为56.5(95% CI 35-90.2)。伴有脏器功能障碍脓毒症ICU患者的死亡率为52.3%(95%可信区间43.4-61.1%,范围30.1-64.6%)(图7)[3]。ICU的高负担,迫切需要全球及地方感染预防和管理方面的改进,以减轻住院患者的高负担。

图 7:医院和ICU中Sepsis的病死率
4、Sepsis——经济负担
重症肺炎作为最常见的感染性疾病,如何去治疗,如何查找病因,如何研究其发病机制,如何早期诊断,如何选择更好的治疗方案,甚至如何用好ECMO等一系列的问题,都非常重要。
2020年《Crit Care Med》上发表的一组数据显示,从2012-2018年,美国医院Sepsis患者的经济成本和医疗费用呈逐年上升趋势(图8)[4],中国亦然,全球亦然。随着Sepsis发病率不断上升,经济负担也不断增加。
最简单最关键的办法就是:早期诊断,早期治疗,早康复,早出ICU。
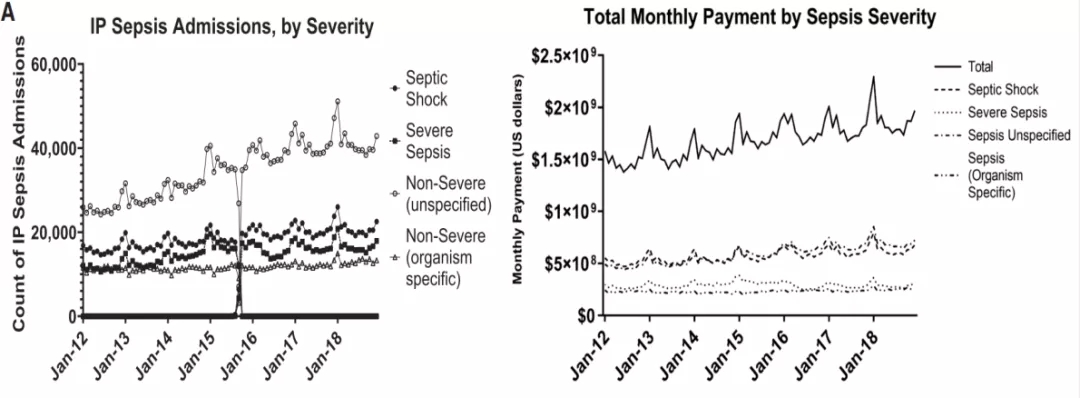
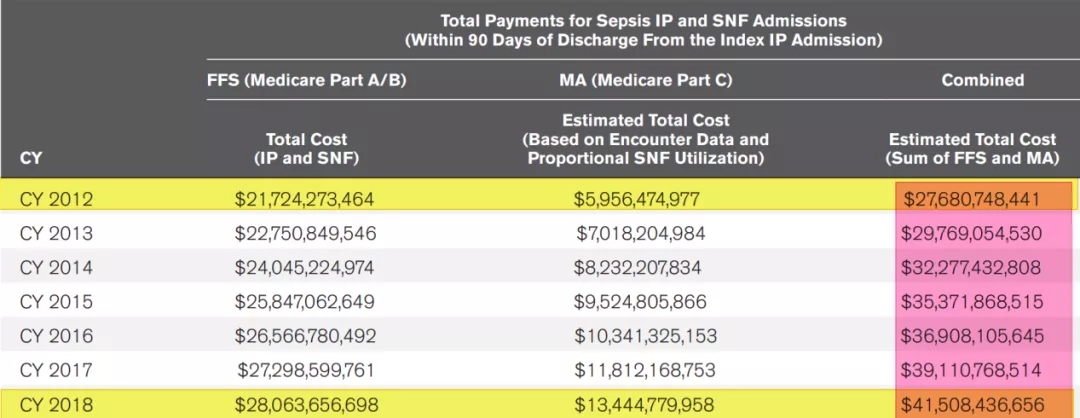
图 8:医院Sepsis方面的经济成本
二、发病机制-感染与免疫失衡
1、如何看待感染与免疫失衡?
很多专家认为感染和炎症反应紊乱不是免疫紊乱。炎症反应紊乱是免疫紊乱的表象,免疫紊乱是炎症反应紊乱的内型。从去年的新冠的疫情中,已经体会到了感染和免疫紊乱的直接关系。免疫功能紊乱是感染的根本原因之一。
自2016年重症感染和免疫紊乱提出以来,炎症风暴、炎症过度、免疫抑制、免疫耗竭和免疫失衡先后提出,但是相关研究尚处于起步阶段(图9)。目前还没有标志性指标来区分它们。
2019年我们曾提出白介素6(IL-6)可能是炎症风暴的重要指标,但在临床往往可以见到IL-6往往会高的一塌糊涂的,同时CD4低的一塌糊涂。那么,这种情况到底是免疫过度还是免疫抑制?

图 9
2、新冠感染中的免疫失衡
2020年中国总共做了至少12例新冠肺炎患者的尸检,我参加了其中8例的讨论。尸检新冠患者结果发现,所有脏器中,除了巨噬细胞,所有炎症细胞,包括中性粒细胞、NK细胞、淋巴细胞,基本都消耗殆尽,但是巨噬细胞大量存在。
2020年《Signal Transduct Target Ther》上发表了关于尸检的文章,新冠导致免疫病理改变,淋巴细胞下降是感染最常见的,淋巴细胞下降主要原因是免疫细胞消耗性所致,炎症反应往往是几种现象同时存在,过度的炎症反应伴随着CD4、CD8等淋巴细胞水平下降(图10)[6]。这导致临床上出现奇葩的现象,一边打糖皮质激素,另一边打胸腺法新,「自己矛打自己盾」。所以说我们要深入探究这些问题。
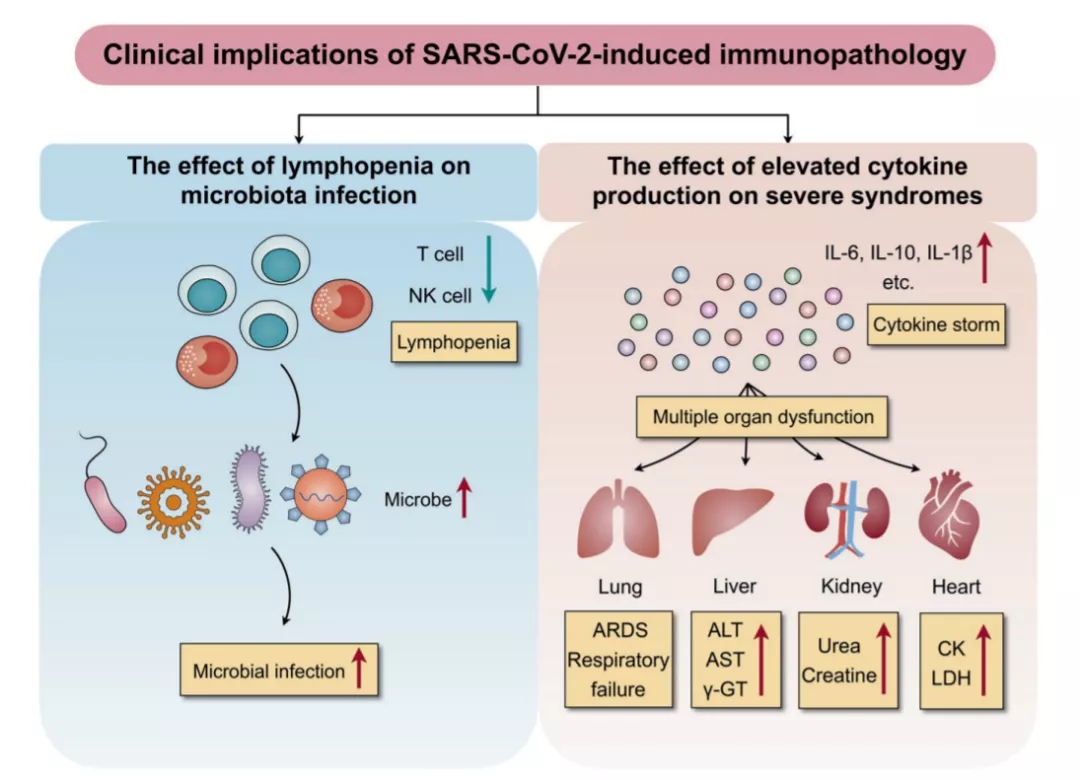
图 10
巨噬细胞分为组织源性细胞和外周血骨髓源性细胞。肺组织源性细胞又分为间质来源细胞和肺泡组织细胞。
外周血骨髓源性细胞(PBMC)分化产生的巨噬细胞,PBMC来源的巨噬细胞在重症新冠肺炎死亡患者体内大量存在。研究也发现,新冠感染中髓系细胞的过度激活加重炎症反应及组织损伤(图11)[7]。
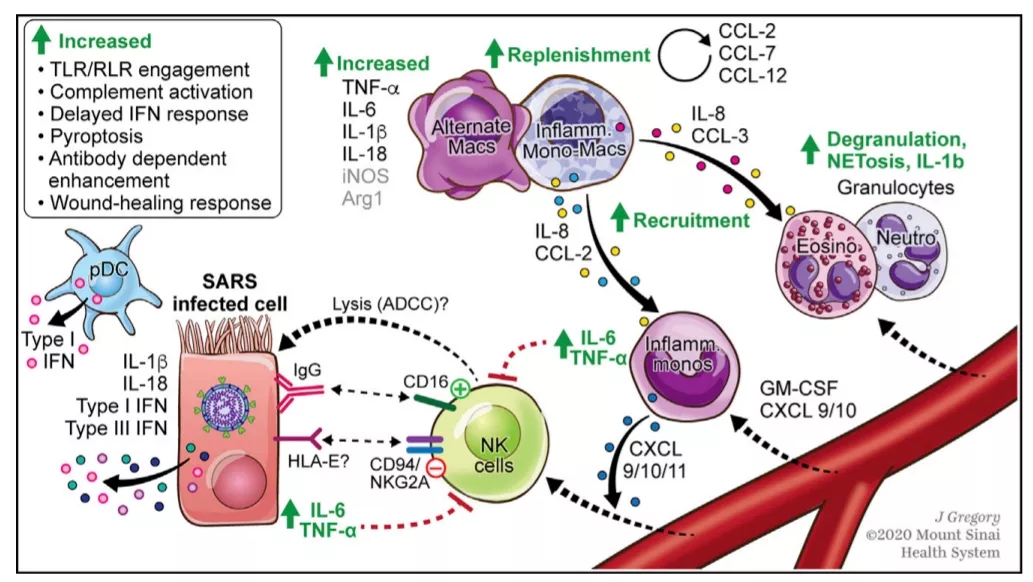
图 11
3、外周单核/巨噬细胞的过度激活
肺部感染时,肺组织细胞和外周血单核细胞源性巨噬细胞平衡可能是炎症平衡的一个重要标志。炎性的外周单核/巨噬细胞的过度激活在免疫过度及炎症因子风暴中起到核心作用,多种机制可诱导外周单核/巨噬细胞的过度激活(图12)[8]。新的问题是,当肺部感染把肺组织的巨噬细胞消耗殆尽时,外周血单核细胞被过度激活,是不是一味的只产生炎症反应?这只是目前发现的表象,真正的反应机制尚不清楚,有待进一步进行研究。
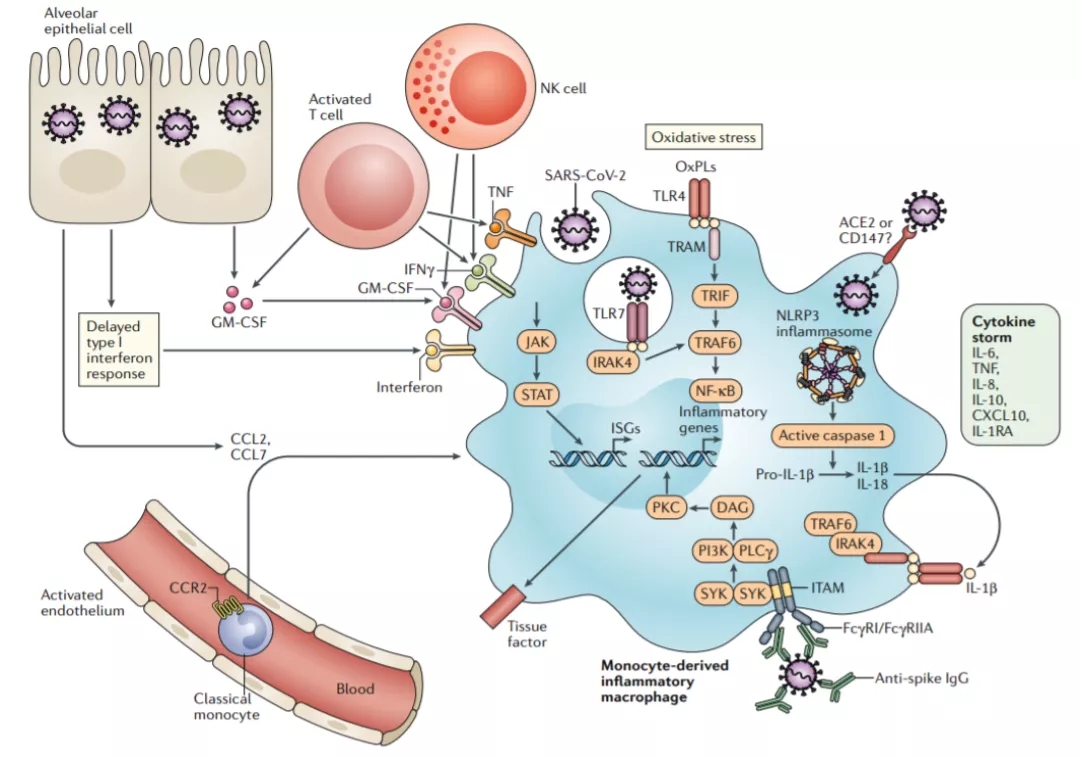
图 12
2020年《Nature Medicine》中关于新冠肺炎的研究提到,重症新冠感染患者中出现外周单核/巨噬细胞显著增多而肺泡巨噬细胞明显减少的现象,外周单核/巨噬细胞及肺泡巨噬细胞的数量异常是免疫失衡的重要原因(图13)[9]。

图 13
继而引发的思考:能否将体外培养肺泡巨噬细胞作为调节炎症反应的治疗方案之一,如同体外培养NK细胞再回输体内一样?
4、肺泡巨噬细胞的免疫调节作用
我的学生曾经做过一个肺损伤的模型,在15~17min时间里,肺泡巨噬细胞开始大量募集,速度比中性粒细胞还要快。作为对抗病原体的第一道防线,肺泡巨噬细胞早期迅速激活对抗感染,后期促进炎症消退(图14)[10]。

图 14
肺泡巨噬细胞与外周单核/巨噬细胞有明显的差异,在急性炎症期促炎性更低[11]。也就是,肺泡巨噬细胞高,外周单核/巨噬细胞低,炎症反应往往就要降低;反之,外周单核/巨噬细胞增高,肺泡巨噬细胞降低,炎症反应就会加强。
肺泡巨噬细胞通过释放多种抑炎及促修复因子促进炎症消退与损伤修复(图15)[12]。也就是,先导致炎症风暴的产生,同时调节炎症,而外周血单核巨噬细胞的调节能力尚不成熟。因此,对肺部感染的考虑需要更深入。
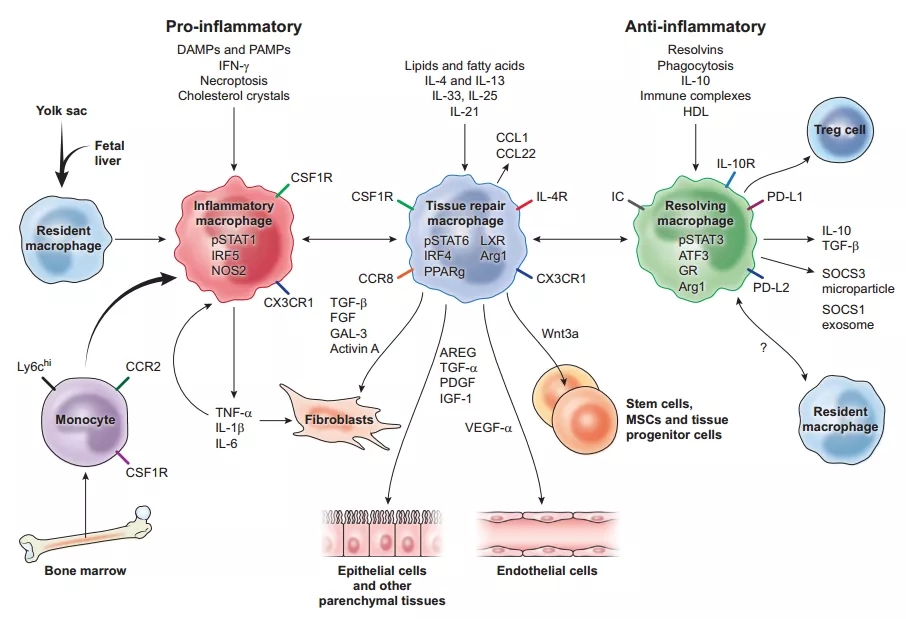
图 15
肺泡巨噬细胞的免疫调节作用:
①肺泡巨噬细胞早期对病原体可迅速应答;
②在病原体诱导下发生死亡[13];
③依靠自我增殖恢复数量[14];
④释放负性调控因子抑制过强炎症;
⑤从而促进炎症消退与损伤修复[12]。
5、肺泡巨噬细胞减少与免疫失衡的发生
我们的团队的研究发现,缺失肺泡巨噬细胞延缓炎症及损伤的修复;缺失外周单核/巨噬细胞大幅降低损伤程度(图16)。
免疫细胞缺失可能会导致免疫耗竭或免疫失衡,如今的研究如同管中窥豹难求真谛,随着研究的深入,一旦看清全貌,肺部感染的治疗将会发生翻天覆地的变化。
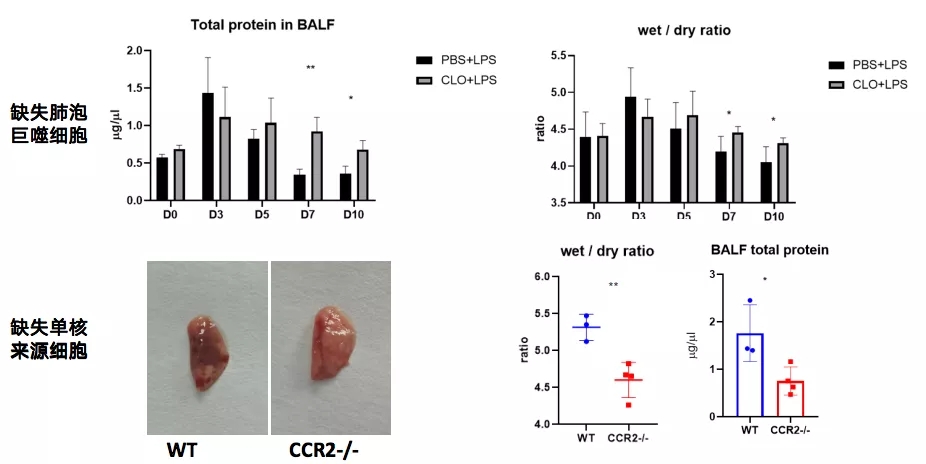
图 16
我们的研究发现,肺泡巨噬细胞的缺失会造成外周单核/巨噬细胞的大量增加(图17)。
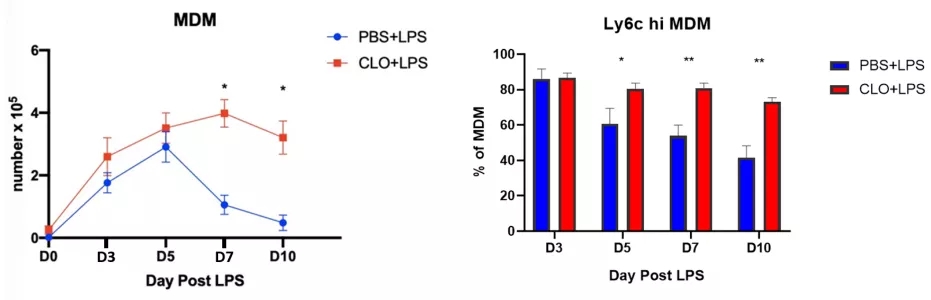
图 17
如何促进肺泡巨噬细胞的再生和功能恢复?是否可能体外培养肺泡巨噬细胞来恢复肺部免疫的平衡?值得思考。
进一步研究发现,增多的外周单核/巨噬细胞具有明显的促炎特性,介导免疫失衡的发生(图18)。
研究过程中,不仅要做巨噬细胞的检测,还要对肺泡来源,肺组织来源和外周血来源的巨噬细胞进行标记,观察比例变化,并将炎症反应作为新指标进行评估,这个是非常有价值的。
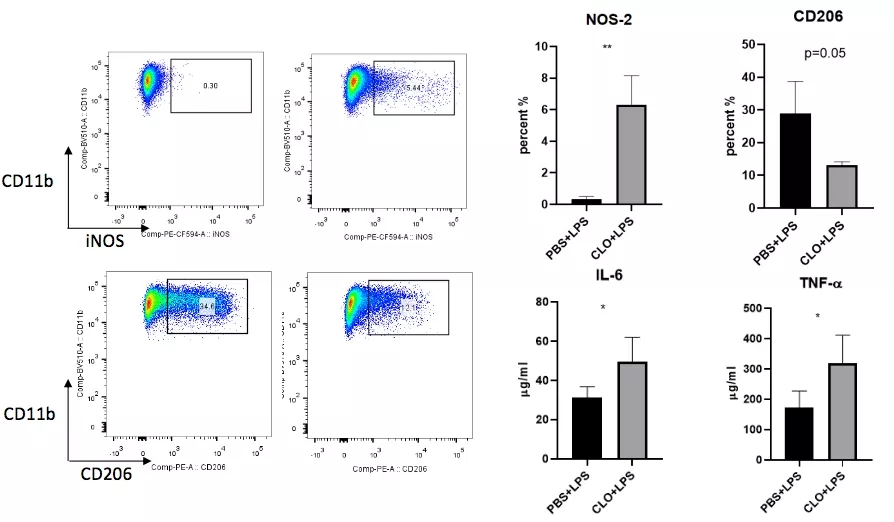
图 18
恢复期肺泡巨噬细胞表现出明显的抑炎表型,起到免疫调节作用;缺失了肺泡巨噬细胞之后外周单核/巨噬细胞数量增加并上调促炎基因的表达 。
6、新冠感染中的免疫失衡-免疫抑制
免疫抑制是新冠及其他重症感染的另一重要特点,表现为淋巴细胞数量减少及功能异常(图19)[6]。
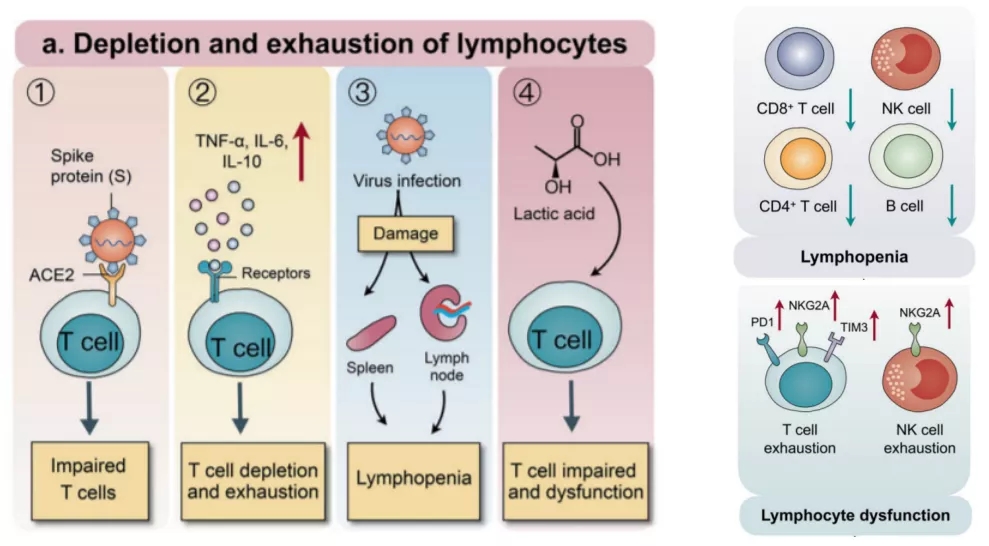
图 19
7、急性及反复感染引起的免疫抑制
我们团队曾做过多次感染脓毒症模型,急性脓毒症和多次感染脓毒症模型CD4+T细胞的比例、数量均下降,多次感染脓毒症模型下降更为明显,表明多次感染小鼠处于更严重的免疫失衡状态(图20)。
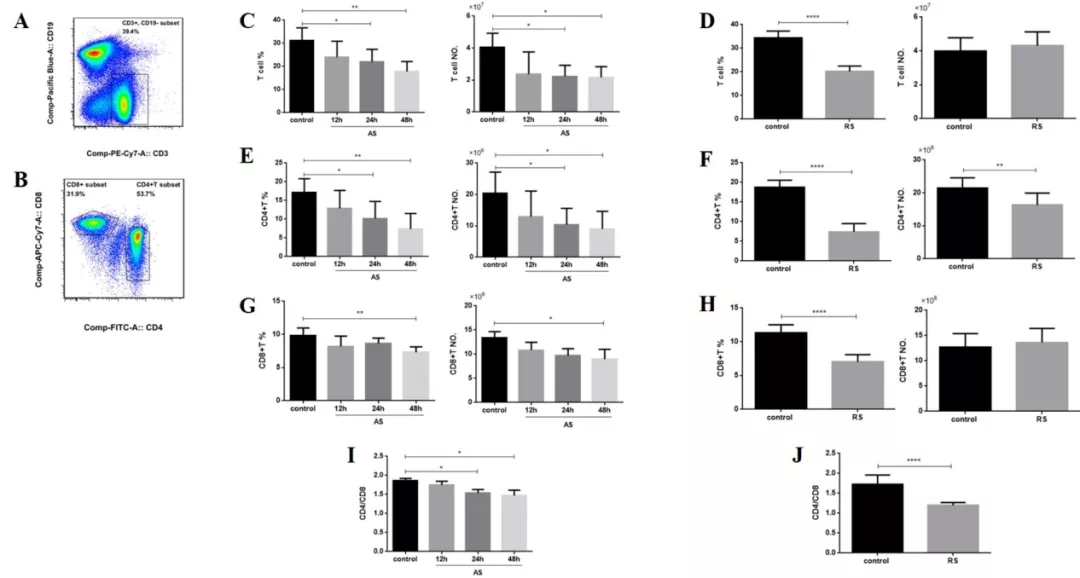
图 20
初次急性感染和重复感染有明显不同的免疫表现。临床中呼吸科的老年患者往往反复感染,二次感染时要注意免疫耗竭和免疫低表达现象。
多次感染脓毒症模型中,CD4+T和CD8+T细胞活化水平明显下降,CD4+T细胞表面抑制性受体PD-1、Tim-3表达明显上调,提示多次感染脓毒症小鼠脾脏CD4+T功能受严重抑制(图21)。
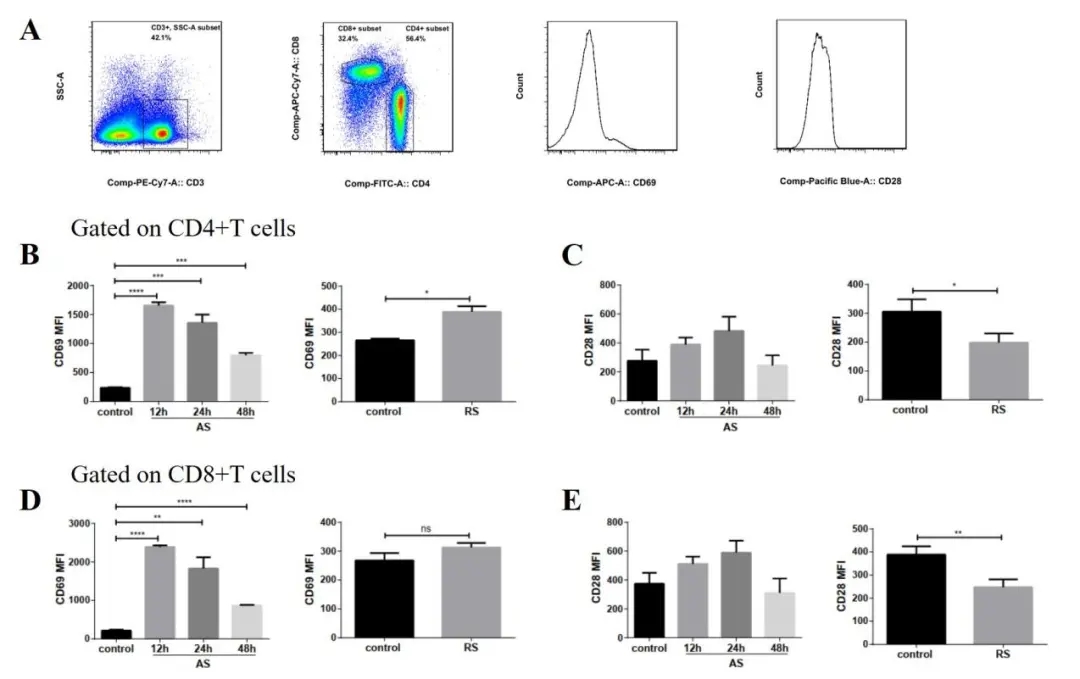
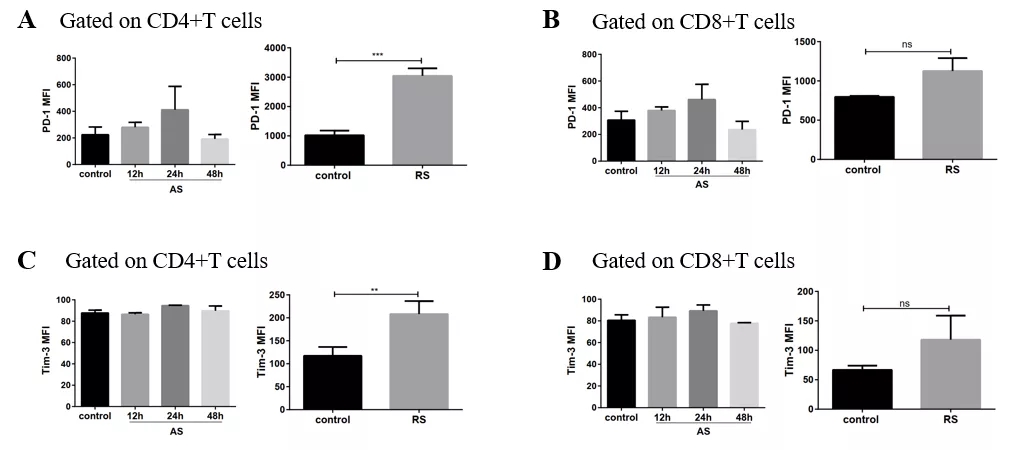
图 21
未来,PD-1可能成为重症感染的治疗手段之一,主要目的是再次激活CD4+T的功能。
在多次感染脓毒症模型中,小鼠Tregs比例、数量均显著增加;CD4+T细胞表面抑制性受体PD-1、Tim-3表达的上调和Tregs数量的增加,共同提示复发性脓毒症中CD4+T细胞呈明显的耗竭表型(图22)。尤其在老年患者中较为常见。
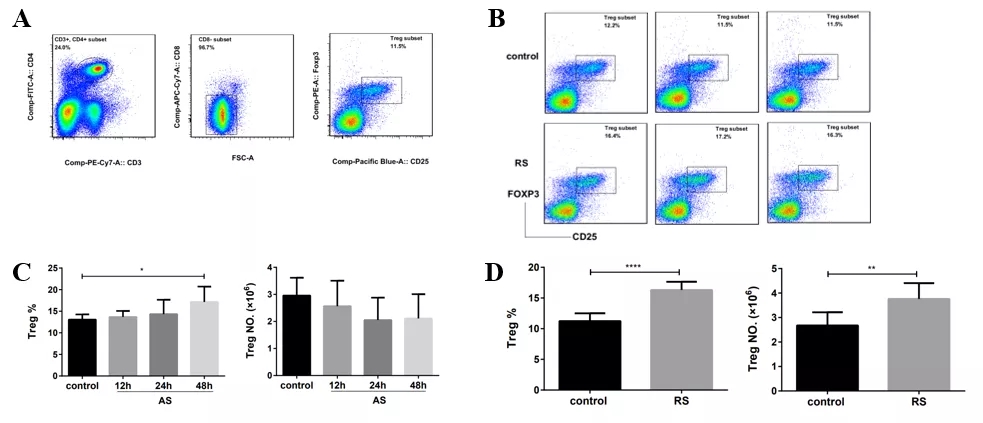
图 22
急性感染会发展为T细胞耗竭(T cell exhaustion),表现为反复严重感染导致T淋巴细胞尤其是CD4+T淋巴细胞数量减少,CD4+T细胞表面PD-1表达明显增加,Treg数量增加,因此T淋巴细胞数量减少,有可能导致功能受严重抑制(图23)。
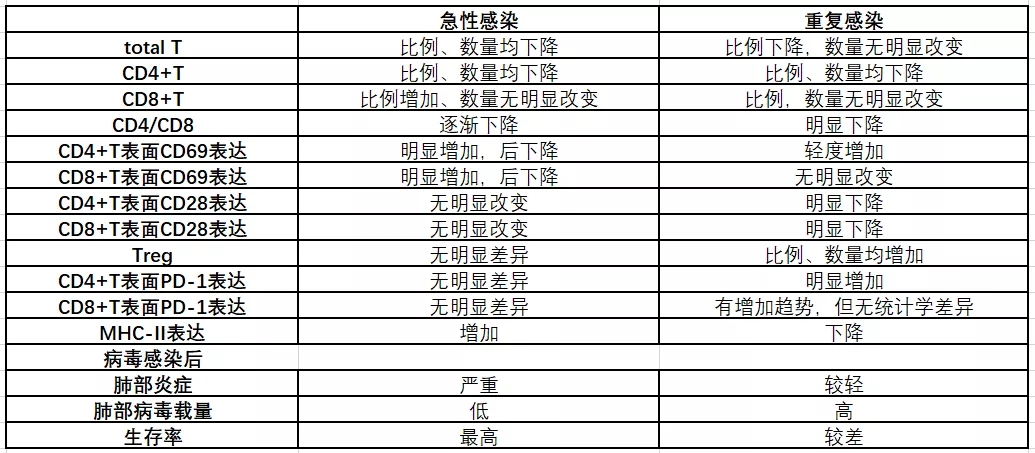
图 23
四、发病机制-免疫耗竭与感染免疫耐受
免疫耐受是指对抗原特异性应答的T细胞与B细胞,在抗原刺激下,不能被激活,不能产生特异性免疫效应细胞及特异性抗体,从而不能执行正常免疫应答的现象。免疫耐受的成因有两种,固有性免疫耐受和适应性免疫耐受。
适应性免疫耐受是可能体内产生了综合抗体,通常考虑病毒,细菌感染和真菌感染会不会产生综合抗体?
2014年《Nature》发表的文章中表明,反复细菌/真菌感染出现了耐受反应,如内毒素耐受[16] 。
免疫耗尽和感染耐受的相关性如下表[17~20] 。这对两者区分具有前提的意义。
表:免疫耗尽和感染耐受的相关性
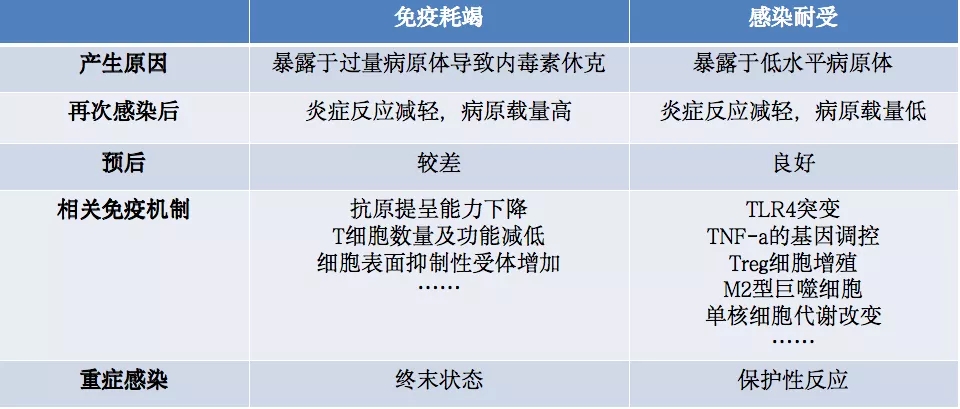
五、Sepsis——临床研究
2020年《CELL》发表一篇文章,研究65岁以上的老年人单剂量接种卡介苗后,统计一年左右继发感染的情况。有趣的是,老年人接种卡介苗后,在未来一年内,其呼吸道感染率明显降低。胸腹腔感染、泌尿道感染和血流感染没有明显变化,只是呼吸道感染和下呼吸道感染的比例明显降低(图24)[21]。因此,无论社会获得性肺炎还是医院获得性肺炎,接种卡介苗可以有效减少下呼吸道感染的风险。

图 24
该研究设计巧妙的是,对入组老年患者免疫机制的研究,方法是将患者的血液中的外周血单核细胞(PBMCs)分离出来,在体外直接用各种条件进行刺激来看炎症因子的表达情况。结果:当老年患者接种了卡介苗以后,体外试验的PBMCs对不同感染刺激下的炎症反应能力明显提高。结论:接种卡介苗对老年患者的继发性呼吸道感染有明显的炎性反应能力,因此,提高了患者自身的免疫力(图25)[21]。
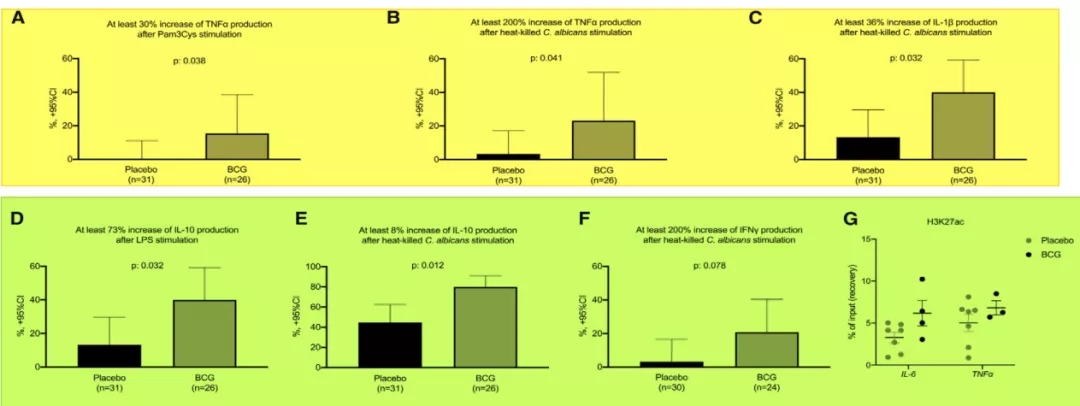
图 25
这一研究证明了非特异性免疫增强对老年患者是有效的。但反过来,这也是一个炎症反应,炎症反应到底是好还是坏?绕回最初的问题,免疫需要量化的指标和评估。
参考文献 (可上下滑动浏览)
[1] Crit Care Med. 2020 Mar;48(3):e209-e218.
[2] Lancet 2020; 395: 200-11.
[3] Intensive Care Med. 2020 Jun 22. doi: 10.1007/s00134-020-06106-2.
[4] Crit Care Med 2020; 48:276-288.
[5] Lancet Respir Med. 2020;S2213-2600(20)30217-4.
[6] Signal Transduct Target Ther. 2020 Jul 25;5(1):128.
[7] Immunity. 2020 Jun 16;52(6):910-941.
[8] Nat Rev Immunol. 2020 Jun;20(6):355-362.
[9] Nat Med. 2020 Jun;26(6):842-844.
[10] Nat Rev Immunol. 2014 Feb;14(2):81-93.
[11] Am J Respir Cell Mol Biol. 2017 Sep;57(3):294-306.
[12] Immunity. 2016 Mar 15;44(3):450-462.
[13] Eur Respir J. 2020 Dec 10;2003764.
[14] Immunity. 2021 Apr 28;S1074-7613(21)00138-2.
[15] Current Opinion in Immunology 2018, 50:88–93 Annu. Rev. Immunol. 2012. 30:271–94.
[16] Nature. 2014 Jul 10;511(7508):184-90.
[17] Front Immunol. 2020 Sep 23;11:2150.
[18] J Leukoc Biol. 2019 Jul;106(1):11-25.
[19] Front Immunol. 2020 Oct 5;11:550769.
[20] Annu. Rev. Immunol. 2012. 30:271–94.
[21] Cell. 2020 Oct 15;183(2):315-323.e9.
专家介绍

解立新
中国人民解放军总医院 主任医师、教授,博士研究生导师,呼吸与危重症医学部主任,中国医师协会呼吸医师分会危重症专业委员会副主任委员;中华医学会呼吸病分会全国委员、呼吸治疗学组组长、危重症学组顾问,中国康复协会呼吸康复专委会副主委,中国医师协会急救复苏和灾难医学专业委员会副主委。
本文由《呼吸界》编辑 Asiya 整理,感谢解立新教授的审阅修改!
本文完,排版:Jerry
未经许可,请勿转载