重症肌无力(myasthenia gravis, MG)是累及神经肌肉接头(neuromuscular junction, NMJ)的自身免疫疾病,临床表现为病态疲劳性和每日波动性,运动后肌肉无力加重,严重时可累及呼吸肌,出现呼吸衰竭,又称作重症肌无力危象(myasthenia crisis, MC)。其发展快,病情凶险,及时机械通气改善患者的通气功能是抢救成功的关键。目前对重症肌无力后呼吸衰竭的治疗多在神经科进行,对肺部感染致呼吸衰竭的诱发作用研究和重视较少,极易误诊及漏诊。由于MG患者肌无力症状的波动性以及并存的呼吸系统并发症,约有一半的患者机械通气时间超过14天[1],机械通气时间过长可增加呼吸机相关并发症及引发呼吸机依赖,造成撤机困难。现报道1例如下,并结合文献对该病例进行讨论。
临床资料
患者,女,78岁。主因「反复咳嗽、咳痰20余年,加重伴意识障碍50天」,于2015年5月7日收入呼吸科重症监护室(RICU)。患者近20年来,每于冬春季节交替受凉后,均有咳嗽咳痰反复发作,无胸闷、气短及双下肢浮肿,日常生活不受影响,未予系统诊治。2015年3月18日受凉感冒后咳嗽、咳痰再次加重,伴活动后气短、发热,体温最高38℃,以「发热待查」于2015年3月21日收入当地保健院。既往高血压病史20余年,冠心病史10年,规范治疗。发现甲状腺功能减退10年,近期甲状腺素片口服治疗。无烟酒嗜好,无家族遗传病史。当地医院查血白细胞 10.46×10^9/L,中性粒细胞86.7%,血小板 233×10^9/L,血红蛋白 113g/L;血气分析 pH 7.34,PaCO2 47.8mmHg,PaO2 72mmHg;白蛋白37.14g/L,前白蛋白 13.09mg/dl;血钾3.43mmol/L,血钠134mmol/L,血氯92.9mmol/L;血沉33mm/h;N末端B型利钠肽原(NT-proBNP)160.2pg/ml。胸部CT示:右肺上叶前段微结节,右肺下叶炎症,双肺下叶条索影,左肺下叶肺不张,双侧少量胸腔积液,甲状腺左右叶体积增大,伴钙化(图1)。
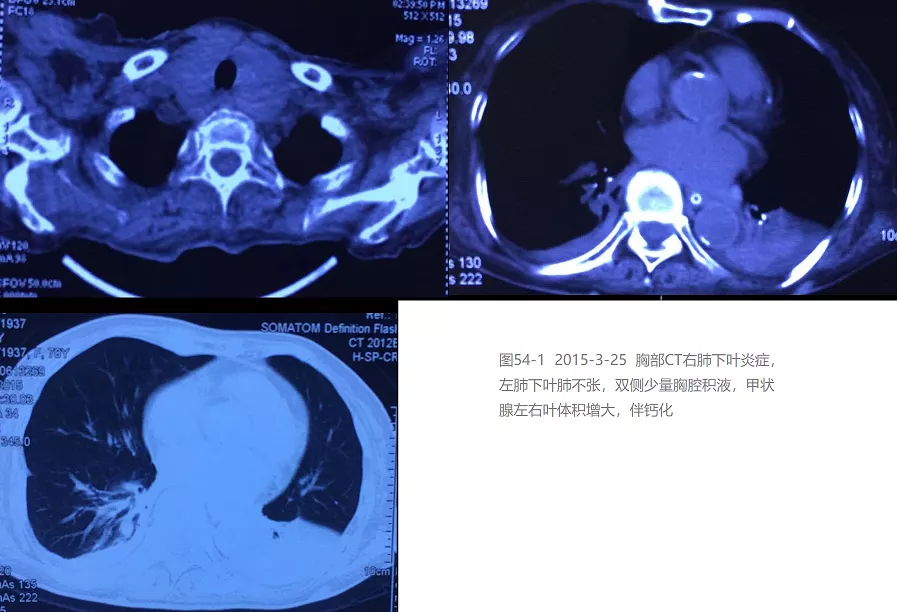
住院后经过抗炎、平喘、祛痰治疗热退,但仍痰多不易咯出。2015年4月1日因前夜睡眠障碍服用佐匹克隆1片,清晨出现意识障碍,血压及血氧饱和度下降,急查血白细胞6.34×10^9/L,中性粒细胞90.6%,血小板 341×10^9/L,血红蛋白 115g/L;血钾2.85mmol/L,血钠125mmol/L,血氯79.2mmol/L;血气分析 pH 7.29,PaCO2 88.1mmHg,PaO2 90mmHg,BE 11.9mmol/L;降钙素原0.442ng/ml;D-二聚体6.90ug/ml;胸片示左下叶片状高密度阴影(图2);头部CT示双侧基底节区腔隙性脑梗死,脑白质缺血脱髓鞘性改变,除外脑出血及新发脑梗死。诊断「慢性支气管炎合并肺部感染,Ⅱ型呼吸衰竭,肺性脑病,呼吸性酸中毒合并代谢性碱中毒失代偿,低钾、低钠、低氯血症,冠心病,心功能2级,高血压3级(极高危组),甲状腺功能减退。」转入RICU无创呼吸机辅助呼吸,加强抗炎排痰、营养支持、纠正电解质紊乱及改善酸碱失衡等治疗,复查血气分析 PH 7.38,PaCO2 53.5mmHg,PaO2 90mmHg,BE 5mmol/L;胸片显示左下叶阴影有所吸收(图3)。
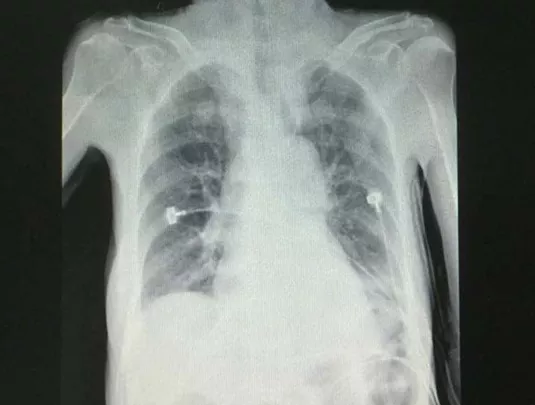
【图2】2015-4-1 胸片左下叶片状高密度阴影
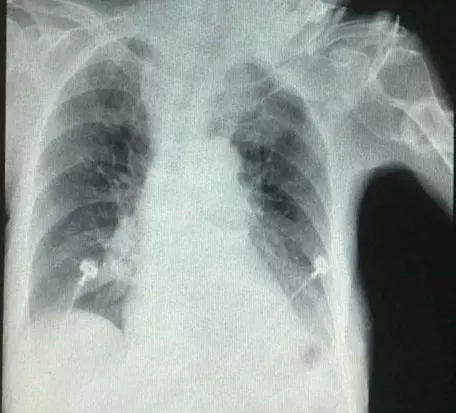
【图3】2015-4-8 胸片左下叶阴影有所吸收
病情一度好转,转回保健院,之后患者仍无力咳痰,心率增快,并拒绝使用无创呼吸机,加用美托洛尔减慢心率。2015年4月20日清晨患者再次出现意识障碍,呼之不应,查血白细胞 14.08×10^9/L,中性粒细胞93.2%,血小板 303×10^9/L,血红蛋白 97g/L;血钾4.32mmol/L,血钠139.4mmol/L,血氯101.3mmol/L;血气分析 pH 7.13,PaCO2 100.2mmHg,PaO2 100mmHg,BE 1.2mmol/L;复查胸片双下肺渗出影较前增多(图4),紧急气管插管呼吸机辅助呼吸并在此转入RICU。体温升高最高39℃,痰培养为耐甲氧西林的金黄色葡萄球菌,提示感染加重,亚胺培南联合利奈唑胺抗炎治疗,两天后热退。行床旁气管镜检查显示:镜下气管及左侧舌支支气管腔内见较多脓性分泌物,粘稠,阻塞气管镜工作通道,负压吸净痰液,见管腔粘膜轻度水肿,各支气管开口无狭窄变形,未及新生物。于左肺舌支行支气管肺泡灌洗,之后回报灌洗液细菌培养阴性。2015年4月27日,复查血白细胞9.38×10^9/L,中性粒细胞82.6%,血小板 303×10^9/L,血红蛋白 97g/L;血气分析 pH 7.44,PaCO2 38.4mmHg,PaO2 102mmHg,BE 2.1mmol/L;病情稳定顺利拔管撤机,无创呼吸机序贯治疗。2015年5月1日因肺性脑病,血气分析:pH 7.20,PaCO2 95.1mmHg,PaO2 76mmHg,BE 4.8mmol/L;再次气管插管。后因脱机困难于5月7日转入我科RICU进一步治疗。
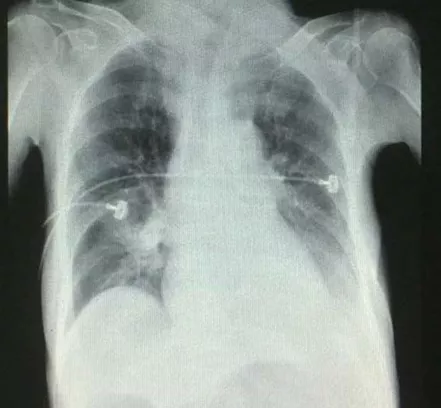
【图4】2015-4-20 胸片双下肺渗出影较前增多
入院查体
体温 37.8℃,心率 110 次/分,呼吸 20 次/分,血 压 150/70 mmHg。发育正常,营养不良,意识清楚,皮肤粘膜无皮疹、黄染。浅表淋巴结未触及肿大。经口气管插管,头部检查未见异常,颈部饱满,甲状腺肿大,气管居中。双肺叩诊清音,呼吸音粗,未闻及干湿性啰音及胸膜摩擦音。叩诊心界不大,心率110 次/min,律齐,各瓣膜听诊区未闻及病理性杂音及心包摩擦音。腹部及神经系统无阳性体征,双下肢轻度水肿。
入院时实验室检查
血常规白细胞5.16×10^9/L,中性粒细胞 68.6%,淋巴细胞26.7%,血红蛋白82g/l,血小板69×10^9/L;降钙素原 0.50ng/ml;B型利钠肽原(NT-proBNP)216pg/ml;甲功七项总T3 0.3nmol/L,总T4 28.87nmol/L,人促甲状腺激素受体(hTSHR) 0.32mIU/L,游离T3 1.94pmol/L,游离T4 8.26pmol/L,甲状腺微粒体抗体 453.7IU/ml,甲状腺球蛋白抗体 0.3IU/ml;总蛋白 51.7g/l,白蛋白35.5g/l;痰涂片结果为革兰阴性杆菌和革兰阳性球菌;痰培养结果为嗜麦芽窄养单胞菌(++++);凝血功能、肝肾功能、血糖、电解质大致正常,T-spot、G试验阴性,血沉无异常。胸部CT提示:双下肺部分膨胀不全伴感染,左侧少量胸腔积液,右侧胸膜增厚,气管插管术后,余较前未见明显变化。心脏超声心动图提示左室舒张功能减退。
入院诊断考虑
慢性支气管炎并肺部感染,Ⅱ型呼吸衰竭,有创呼吸机辅助呼吸,高血压3级,极高危,冠状动脉粥样硬化性心脏病,中度贫血,营养不良,甲状腺功能减退。
给予抗炎祛痰,加强营养支持,扩血管降压,补充甲状腺素及继续有创呼吸机辅助呼吸等治疗,并逐渐减少呼吸机辅助参数,为脱机做准备。5月12日患者恢复良好,尝试脱机,1小时后以失败告终。再次追问病史,该患者从去年10月即感轻度活动不利,曾跌倒至腰椎压缩性骨折,之后活动量明显减少,未予重视。
此次因肺部感染入院,但呼吸功能进行性减退并反复呼吸衰竭,撤机失败,无法用肺内疾病及已知基础疾病解释。 请神经内科会诊,查体见双眼裂较小,睁眼无力,左上肢肌无力,怀疑MG。第2天予新斯的明1mg,阿托品0.5mg肌注后半小时试脱机,延长至6个小时,从而MG诊断明确,加用溴吡斯的明60mg q8h,并每日丙种球蛋白20g静脉输入连用5天,一周后脱机训练可长达24小时。同时完善各项检查,查找重症肌无力原因。肿瘤标志物癌胚抗原 7.8ng/ml,鳞状上皮细胞癌抗原 2.3ng/ml,铁蛋白 502.2ng/ml,胃泌素释放肽前体 134.4pg/ml,血清骨胶素CYFRA211 4.66ng/ml;余标志物正常;风湿免疫相关检查抗核抗体1:100颗粒型,干燥综合症特异抗体A 强阳性,抗重组Ro-52抗体阳性,重叠综合征特异性抗体PM-Scl 阳性;余抗体及抗中性粒细胞胞浆抗体,免疫球蛋白,补体C3和C4,血清和尿液免疫固定电泳均阴性;神经肌肉接头抗体检测提示乙酰胆碱抗体滴度明显升高,相关副癌综合征抗体均阴性;甲状旁腺激素,促肾上腺皮质激素,雌激素六项均正常;甲状腺B超:甲状腺欠均质增大,右叶3.5cm×3.5cm,左叶3.3cm×3.0cm;甲状腺CT:甲状腺弥漫肿大伴钙化,甲状腺左右叶及峡部压迫气管,最窄处气管内径约9.7mm,狭窄以远气管扩张,最宽处内径24.6mm。胸部CT:胸腺已萎缩;腹部及其盆腔B超未及占位性病变。
结合上述病史,查体及各项检查回报临床诊断
慢性支气管炎合并肺部感染,Ⅱ型呼吸衰竭并有创呼吸机治疗,MG,获得性自身免疫性疾病相关可能性大,副癌综合征不除外,桥本氏甲状腺炎,甲状腺功能减退,中度营养不良,中度贫血,陈旧脑梗塞,冠状动脉粥样硬化性心脏病,高血压3级(极高危)。
综合患者自2014年10月以来出现力弱,今年3月份因慢性支气管炎合并肺部感染住院,后呼吸衰竭插管上机至今,虽经积极规范地抗感染,营养支持,维护内环境稳定等治疗,严格地气道管理及撤机时机的掌控,仍多次发生呼吸衰竭,撤机失败,加用针对MG的治疗后,脱机时间明显延长。 说明困难脱机原因主要与MG有关,加之高龄,感染,甲减,营养不良等众多因素联合作用,能够短期平稳撤机难度极大 ,于是一方面联合胸外、普外及头颈外科,全麻下行甲状腺峡部切除+气管切开造瘘术;另一方面给予甲强龙500mg激素冲击5天,溴吡斯的明加量至90mgq8h,积极治疗MG。术后患者恢复良好,出院时白天可使用人工鼻脱机自主呼吸,夜间应用呼吸机辅助呼吸。
讨论
机械通气是重症监护室抢救各种重症疾病导致呼吸衰竭的重要措施,但在治疗的同时并发症也会随之发生,因此当导致呼吸衰竭的病因纠正以后应该尽快撤离呼吸机,以减少并发症的发生。 呼吸机撤离是指两个分开但又密切相关的过程,即脱机和撤离人工气道。这将依赖患者的原发病解除情况、精神状态、气道防御机制、咳痰能力以及气道分泌物的特征。两项多中心研究表明,能够突然撤离呼吸机的患者大约占机械通气患者的75%[2],临床上有 20% ~ 30% 的机械通气患者存在撤机困难或撤机延迟[3]。撤机失败常见的原因有呼吸做功与呼吸肌肌力之间失衡,神经问题导致的中枢呼吸驱动力下降,营养和电解质失衡,心血管功能状态,精神心理因素,以及医疗护理因素。神经肌肉疾病会导致呼吸肌肌力减低,从而影响正常撤机过程。
本例患者,慢性咳嗽咳痰病史20余年,从未影响日常生活,自2014年10月感轻度活动不利,曾跌倒至腰椎压缩性骨折,之后活动量明显减少,但一直未予重视。此次因肺部感染入院,呼吸功能进行性减退,多次发生呼吸衰竭,且反复撤机失败。
分析原因如下
首先,该患既往虽有慢性咳嗽、咳痰病史20余年,但不影响日常生活,胸部CT也无肺气肿征象,仅下肺少许渗出影并左下肺膨胀不全,所以单凭肺内疾患无法解释反复呼吸衰竭及困难脱机。
其次,虽然患者首次意识障碍后头部CT提示双侧基底节区腔隙性脑梗死,脑白质缺血脱髓鞘性改变,但此处陈旧病灶仅可定位左上肢肌力差,无法解释呼吸肌受累。随后临床上考虑存在全身系统性疾病综合作用加剧撤机困难,比如营养不良,低蛋白血症,贫血,电解质紊乱,甲状腺功能减退等,并积极处理改善,病情仍进行性恶化,试脱机仅维持1小时,遂更加仔细地寻找困难脱机的其他病因。结合该患近半年活动不利的病史,神经专科查体双眼裂较小,睁眼无力,新斯的明试验阳性,之后神经肌肉接头抗体检测乙酰胆碱抗体滴度明显升高, 确诊MG才是该患呼吸衰竭呼吸机撤离困难的主要原因。 结合同期风湿免疫自身抗体多项阳性,甲状腺功能减退也源于自身免疫性甲状腺疾病——桥本氏甲状腺炎进一步佐证重症肌无力之诊断。胸部CT提示胸腺萎缩,血清肿瘤标志物轻度升高,气管镜检查未及气管开口狭窄及新生物,腹部及其盆腔B超未及占位性病变,相关副癌综合征抗体均阴性,考虑MG,获得性自身免疫性疾病相关可能性大。
文献复 习:MG是一种主要累及神经-肌肉接头突触后膜上乙酰胆碱受体(acetylcholine receptor,AChR),并由乙酰胆碱受体抗体介导、细胞免疫依赖、补体参与的自身免疫性疾病。约2/3的患者以眼外肌麻痹为首发表现,也可表现为延髓麻痹,症状逐渐向四肢发展[4]。有3 % ~ 8 % 晚期 M G 患者会出现呼吸衰竭,可伴有MC[5]。国外也有以呼吸衰竭为首发症状的病例被报道出来,约 1 4 % ~ 1 8 % 的患者可伴有呼吸衰竭为首发症状[6]。
MC是指由于肌无力加重而引起的严重呼吸困难状态,通常需要气管插管以行机械通气支持治疗[7] 。其发展快,病情凶险,是急诊科常见急危重症之一。以往MC死亡率高,近年来随着免疫治疗以及呼吸道管理疗法的改善,其病死率已降至5%以下。MC是胆碱能递质相对不足所致。糖皮质激素、抗生素(氨基糖甙类抗生素、林可霉素和氨苄青霉素等),以及对神经肌肉接头(NMJ)传导有阻滞作用的药物(如普萘洛尔、普鲁卡因酰胺、奎尼丁、钙离子拮抗剂、镁离子和部分麻醉剂)等多种因素可以使NMJ的突触前膜乙酰胆碱释放受到影响,造成MC。MG患者自身免疫反应加重时胆碱能递质释放虽不受影响,但突触后膜的乙酰胆碱受体破坏增加,功能也会受到致病性抗体的影响。性激素水平和一些细胞因子也是重要的MG病情加重因素。MC通常在MG病情加重时出现,或在MG病情平稳时由感染、手术、应激反应、月经和药物等因素诱发。诱因中感染最常见,医源性因素其次。Thomas等[1]报告在79例次肌无力危象中感染性因素占38%,医源性因素占8%,其中胸腺切除术诱发者占10%,还有30%的危象没有明确的诱因。肌无力危象发生时间多距MG发病较近,Thomas报告发病1年内、1~2年和2年后发生首次危象者分别为53%、21%和26%。另有研究结果显示[8],医院感染 (尤其是肺部感染) 是MG患者并发呼吸衰竭的一个重要的危险因素,同时也是导致重症肌无力并发呼吸衰竭患者死亡的重要原因。
结合本例患者,起病隐匿,虽半年前即有肌无力症状,但入院血气分析尚可。反复感染加重,口服佐匹克隆,美托洛尔均可不同程度地促进肌无力危象的发生,从而导致呼吸衰竭的反复发生而使撤机困难。确诊之后加用溴吡斯的明口服,并每日丙种球蛋白20g静脉输入连用5天,甲泼尼龙500mg激素冲击治疗5天,积极治疗原发病,且避免使NMJ的突触前膜乙酰胆碱释放受到影响的药物。考虑到患者高龄,感染,甲状腺功能减退,营养不良等众多因素联合作用,短期平稳撤机难度大,联合胸外、普外及头颈外科,全麻下行甲状腺峡部切除+气管切开造瘘术,术后患者恢复良好,出院时白天可使用人工鼻脱机自主呼吸,夜间应用呼吸机辅助呼吸。
目前对重症肌无力后呼吸衰竭的治疗多在神经科进行,对肺部感染对呼吸衰竭的诱发作用研究和重视较少。有研究认为,晚期MG或者MC患者吸入性或者坠积性肺感染的发生会诱发或加重呼吸衰竭的发生,而呼吸衰竭又反过来会诱发或加重MC。 因此对于呼吸科反复出现肺内病变无法解释的呼吸衰竭,困难撤机的病人,要警惕合并MG,甚至MC的可能。
MG所致呼吸功能障碍的主要原因包括中枢呼吸动力下降、声门闭合不全、咳嗽反射减弱、上部气道阻塞、吞咽困难造成误吸、呼吸肌无力使肺活量下降和炎症造成肺顺应性下降等[9]。早期机械通气可及时改善患者呼吸困难状况,纠正低氧血症,防止继发脑缺氧损害,提高抢救成功率。双水平正压通气(BiPAP)在症状轻微的肌无力危象时可代替气管插管。Rabinstein等[10]报告11例次危象中的7例次避免气管插管,即使长时间应用其耐受也很好。只有出现高碳酸血症(PaCO2> 50 mm Hg)时才能认为BiPAP失效而进行气管插管人工通气。不能迅速明确呼吸困难的原因(特别是危象的原因)而患者的呼吸困难进展性加重和(或)出现上部呼吸道明显无力和误吸时,及时气管插管可以防止低氧血症对脏器的损害和减少肺部感染。困难脱机的因素包括肺部感染、心血管意外、感染因素不能控制导致的免疫状态持续失常和神经肌肉传导阻滞剂的应用。Thomas等[1]报告患者气管插管的时间平均在14天,没有这些因素者插管超过2周的为0,有一种者为21%,有2种者为46%,而有3种者为88%。国内也有研究显示[11]MC撤机困难危险因素分析,通过单因素分析发现年龄>60岁、感染性诱因、合并肺不张、肺部感染或菌血症为撤机困难的危险因素,而经多因素分析可知年龄、合并肺部感染与肺不张与机械通气后撤机困难有关。这与 Rabinstein等[12]的报道相符,提示高龄患者各器官功能衰退或功能不全,心肺功能耐受力较之中青年差,往往会发生撤机困难。所以在治疗MC的同时,应加强排痰、抗感染、呼吸功能锻炼等措施,积极治疗肺部并发症,不可急于求成。
参考文献
1. Thomas CE, Mayer SA, Gungor Y,et al. Myasthenic crisis: clinical features, mortality, complications, and risk factors for prolongedintubation. Neurology,1997,48(5):1253-1260.
2.Hall JB, Wood LDH.Liberation of the patient from mechanical ventilation.JAMA,1987,257:1621-1628.
3.秦英智,呼吸机的撤离.医学与哲学,2007,28(9) :12-14.
4.Conti-Fine BM , Miliani M ,Kaminski HJ.Myasthenia gravis :past, present, and future .J Clin Invest ,2006 ,116:2843-2854
5.Fregonezi GA, Resqueti VR, Guell R, et al. Effects of 8-week,interval-basedinsoira to rymuscle training gandbreathing gretraining the patient with generalized myasthenia gravis .Chest, 2005,128:1524-1530.
6.Vaidya H. Case of the month: unusual presentation of myasthenia gravis with acute respiratory failure in the emergency room. Emerg Med J,2006,23:410-413.
7.Chaudhuri A, Behan PO. Myasthenic crisis. QJM :monthly journal of the Association of Physicians.2009,102(2):97-107.
8.韩曙光,吕蕾,赵弘卿等. 重症肌无力患者并发呼吸衰竭的影响因素及其预后相关因素研究.实用心脑肺血管病杂志 2015,(10):32-35.
9.Gelinas DF. Pulmonary function screening. Semin Neurol, 2003, 23(1): 89-96.
10.Rabinstein A, Wijdicks EF . BiPAP in acute respiratory failure due to myasthenic crisis may prevent intubation. Neurology, 2002, 59(10):1647-1649.
11.郑梓煜,叶子,刘江辉.重症肌无力危象撤机困难危险因素分析. 中国急救复苏与灾害医学杂志, 2013,8(10):875-877.
12.Rabinstein AA ,Mueller-Kronast N . Risk of extubation failure in patients with myasthenic crisis. Neuro critical care ,2005,3(3):213-215.
作者:肖瑶 朱光发 张向峰 - 首都医科大学附属北京安贞医院呼吸与危重症病学科
本文转载自订阅号「重症与康复」(ID:CriticalAndRehabCare)
原链接戳:病例集锦54 | 重症肌无力致呼吸衰竭呼吸机撤离困难
本文完
排版:Jerry


