引言
胸腔积液是临床常见的胸膜疾患,患者多因胸闷气促症状而就诊,可有各类合并症,合并发热通常指向感染性病变,可通过胸腔穿刺引流明确胸腔积液性质从而进行鉴别诊断。与炎症相关的胸腔积液多为中性粒细胞或淋巴细胞比例升高为主,少部分可出现嗜酸性粒细胞升高。本例患者初发咳嗽,胸闷伴有发热,肺部影像提示感染性改变,但经抗感染治疗未好转并出现胸腔积液,同时胸腔积液、外周血、骨髓出现明显嗜酸粒细胞升高。以嗜酸性粒细胞升高为主的胸腔积液临床相对少见,原因多样。如何抽丝剥茧,需要广大医师根据临床病史、辅助检查等寻找到其诊治的关键点。
干咳、胸闷,抗感染10天却加重,胸腔积液增多……社区获得性肺炎出现肺炎旁胸腔积液?特殊感染,常规广谱抗感染未覆盖?
这是一位47岁男性患者,2020年4月主诉「咳嗽、胸闷1月余」入住我院呼吸与危重症医学科。患者入院前1月无明显诱因下出现咳嗽、胸闷,以干咳为主,无发热、盗汗、胸痛、气促等不适,至A医院住院期间曾有发热,最高37.5℃,初始血常规提示EOS% 7.8%,EOS计数 0.6*109,胸部CT示右肺多发微小结节,右侧炎性病变,给予左氧氟沙星+头孢尼西10天,复查胸部CT炎症较前进展,并出现右侧胸腔积液,胸水回报单核细胞为主的渗出液,ADA正常,调整为莫西沙星抗感染治疗4天,症状无明显好转。随后患者又至B医院住院治疗,复查胸腔积液,胸水脱落细胞未见恶性肿瘤细胞,涂片可见大量淋巴细胞以及嗜酸性粒细胞,完善骨髓穿刺,提示嗜酸粒细胞比例增多症,血常规 EOS% 20%,EOS计数1.74*109,考虑肺嗜酸粒细胞增多症,给予氯雷他定抗过敏治疗以及莫西沙星抗感染,但患者的症状仍然无好转,为了进一步治疗转至我院。患者既往有慢性乙型病毒性肝炎,恩替卡韦治疗2年。
追问其既往史、家族史及过敏史等情况: 患者既往有慢性乙型病毒性肝炎,恩替卡韦治疗2年。既往过敏性鼻炎20余年,平时曾有嗜酸性粒细胞稍有升高,未检出明确过敏原,从事药师工作,否认工作中有毒有害物质接触史。
患者入院后,首先对其进行查体:生命体征平稳,神志清楚,呼吸平稳,氧饱和度99%。皮肤无皮疹,无瘀斑,各浅表淋巴结未触及肿大。口唇无发绀。胸廓对称,右下肺语颤稍减弱,未及胸膜摩擦感,左肺叩诊清音,右下肺叩诊实音,右下肺呼吸音低,未闻及干湿啰音。心律齐,未闻及病理性杂音。心腹及神经系统查体未见明显异常,双下肢无水肿。
分析该病例特点
1、中年男性,药师工作,无明显诱因下出现咳嗽、胸闷1月,亚急性病灶,伴间歇低热。外院广谱抗感染治疗效果欠佳。
2、查体:右下肺叩诊实音,右下肺呼吸音低,提示右侧胸腔积液。
3、外周血及骨穿嗜酸粒细胞比例升高。
4、肺部CT提示右肺多发微小结节伴右侧胸腔积液,胸腔积液提示为渗出液,以单核细胞及嗜酸粒细胞为主,ADA正常。
根据以上特点,我们着重应该思考的是,在经验性抗感染治疗无效下,出现不断增多的胸腔积液,同时胸水中的嗜酸性粒细胞缘何而来?是感染还是其他原因?
患者胸腔积液嗜酸性粒细胞升高可能的原因有哪些?(多选)
- 肺结核
- 真菌感染
- 胸膜创伤
- 寄生虫感染
- 肺栓塞
- 高嗜酸粒细胞增多症
(答案见文末)
初期表现「肺炎」和胸腔积液,「肺炎」可能为肺梗死表现?……但初期外院D-二聚体无明显升高,还须完善哪些检查进行鉴别?」
对此,我们开展了科室疑难病例讨论:
我科PCCM学员虞有超认为:患者右侧胸腔积液反复抗感染对症治疗未好转,初期有发热,肺部CT提示为右侧实变,目前感染性病变不能排除,特别要考虑一些特殊感染,如寄生虫、球孢子菌感染等,均可引起外周血及胸水嗜酸性粒细胞升高,最常见的感染为寄生虫感染:包括并殖吸虫病,裂头蚴病、弓蛔虫病、淋巴丝虫等,可进一步完善胸腔积液细胞学检查、真菌及寄生虫抗体检测鉴别。但寄生虫感染通常不会引起骨髓嗜酸粒细胞增多,有待复查评估鉴别。
非感染性病变中嗜酸粒细胞异常升高,需要排除血液系统疾病及风湿免疫系统相关疾病,如高嗜酸粒细胞增多症(HE),但其诊断标准中需间隔1月以上了2次嗜酸粒细胞计数增高,目前入院复查嗜酸粒细胞比例7%,嗜酸粒细胞计数0.39×109/L,不符合该诊断,外院骨穿结果曾有明显嗜酸粒细胞浸润,可考虑复查骨穿病理明确嗜酸粒细胞升高原因,排除血液系统疾患,同时再次穿刺定位胸腔积液复查胸水性质。待胸水减少后可复查肺部CT增强评估肺内病灶性质。
我科周敏主任医师认为:该患者亚急性病程,咳嗽胸闷起病,末次胸水中发现大量嗜酸粒细胞,按照胸腔积液嗜酸粒细胞增多的诊断标准,胸腔积液中有核细胞计数的嗜酸粒细胞含量超过10%,最常见的原因为胸膜创伤,其他可能的原因还有恶性肿瘤、肺栓塞、感染、药物等。
患者第一次胸腔穿刺引流液以单核细胞为主,而第二次胸腔积液以淋巴细胞伴嗜酸粒细胞为主,不能排除胸腔穿刺创伤引起的嗜酸粒细胞升高。同时需考虑其他因素引起胸腔积液及肺实变,例如:真菌、结核感染,EGPA等,必要时可完善气管镜检查进行鉴别诊断。肺部实变影合并有嗜酸粒细胞升高可能的原因有:感染(细菌、真菌、病毒、寄生虫?)、过敏性肺泡炎、慢性嗜酸性粒细胞性肺炎、EGPA、变应性支气管肺曲霉病、肿瘤(淋巴瘤、间皮瘤、高嗜酸性粒细胞综合征、慢性嗜酸性粒细胞白血病等)、外伤等。
目前仅1次外周血嗜酸粒细胞达到大于1.5*109/L,符合嗜酸性粒细胞增多的诊断标准,但无法诊断为高嗜酸性粒细胞增多症,同时也无法诊断特发性嗜酸性粒细胞增多综合征,该患者无两次以上嗜酸性粒细胞增多,同时外院骨穿报告并无明确发现恶性肿瘤依据,患者一过性嗜酸性粒细胞升高,仍需排除寄生虫、药物、风湿免疫疾病等。有待完善寄生虫检查、风湿免疫相关血检测,同时患者胸水较前减少但胸闷未改善,入科后查D-D二聚体2.19mg/L轻度升高,外院二聚体正常,同时也完善胸部CTA排除肺栓塞可能。
我科时国朝主任认为:该患者目前突出特点表现为胸腔积液嗜酸性粒细胞增多(PFE)。胸膜刺激或创伤和恶性肿瘤是常见的原因。气胸、血胸、开胸手术、胸腔镜或反复胸膜腔穿刺这类胸膜刺激或创伤可导致PFE。
恶性胸腔积液中PFE的发生率较低,据文献报道约为2.3%-6.8%。PFE患者中胸膜恶性肿瘤的发生率为6%-40%,该患者病程以早期实变为主,不符合常见胸膜恶性肿瘤表现。肺栓塞也是PFE的重要原因, 肺栓塞患者中约30%-50%伴有胸腔积液,这些积液中18%存在嗜酸性粒细胞增多,其积液量通常较少(不到半侧胸腔的1/3),且为单侧性渗出。1/2-2/3积液由于肺梗死而呈血性。该患者发病初期表现为「肺炎」和胸腔积液。其「肺炎」可能为肺梗死表现。但患者初期外院D-二聚体无明显升高,仍有不支持点,故需进一步鉴别。
思考:患者目前诊断尚不明确,最先需要完善哪些检查?
A、气管镜检查送检GM、NGS
B、胸腔穿刺引流
C、寄生虫抗体检测
D、风湿免疫检测(ANCA、ANA、ENA等)
E、肺动脉CTA、心超、下肢多普勒
F、外周血异常细胞、骨髓穿刺活检
G、PET-CT检查
最终我团队得出的结论是:胸腔积液嗜酸性粒细胞增多(PFE),肺栓塞可能最大,完善肺动脉CTA排除,完善下肢多普勒超声、心超评估。待寄生虫、真菌、风湿免疫检查排除,同时复查骨髓穿刺及胸水超声拟行再次胸腔穿刺引流。
围绕结论,下一步又该如何进行诊断分析及鉴别诊断呢?团队认为,因以患者胸水嗜酸粒细胞升高为主要切入点进行分析,诊断思路图如下:
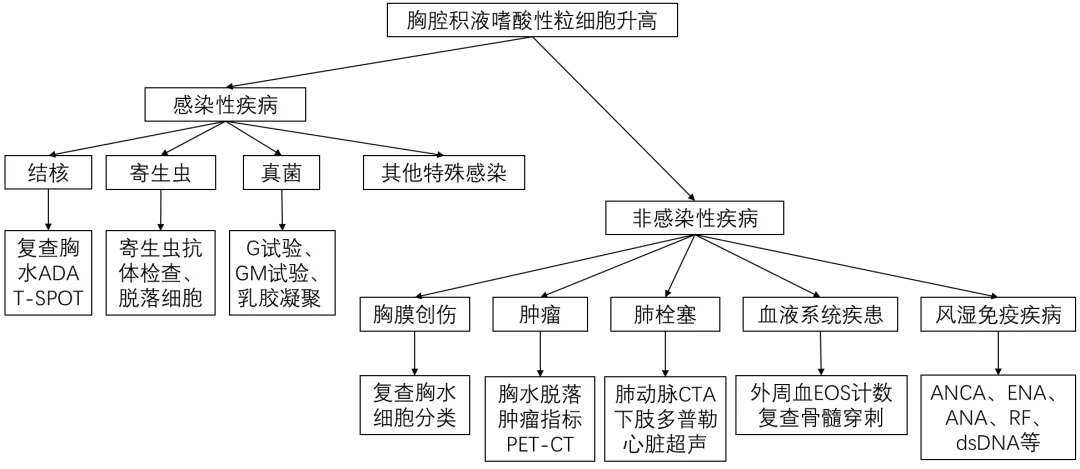
图1 思维图
层层剥茧,「肺栓塞」浮出水面……嗜酸性粒细胞升高胸腔积液原因尚不明确,是否肺栓塞相关或穿刺创伤引起的可能性较大?
按照诊断思路,首先分析是感染性疾病吗?团队认为,患者早期发热,早期肺部CT见肺部炎症改变,首先考虑感染性疾病,但外院予广谱(二代头孢类及喹诺酮类)抗感染治疗未能好转,右肺炎症较前进一步增多,提示非常见病原微生物。后复查CT出现胸腔积液,同时胸水以单核、嗜酸粒细胞为主,虽然少数肺炎旁胸腔积液也可表现为嗜酸性细胞增多,但大多数为感染后期,通常在肺炎消退后出现。最常见的感染为寄生虫感染:包括并殖吸虫病,裂头蚴病、弓蛔虫病、淋巴丝虫等,有待完善胸腔积液细胞学检查及寄生虫抗体检测鉴别。其他需考虑结核、真菌等感染,但患者外院胸水ADA无明显升高,结核性胸腔积液可能性不大,浸润性真菌感染通常全身症状更明显,有待G试验、GM试验、乳胶凝集试验等排除真菌感染。
那么,是非感染性疾病吗?首先看肺栓塞:患者胸闷不适,D-二聚体升高,早期以肺实变为表现后出现胸腔积液,符合肺栓塞的表现,肺栓塞常用和并胸腔积液,发生概率30-50%,其中有18%可存在嗜酸性粒细胞增多,其积液量通常较少(不到半侧胸腔的1/3),且为单侧性渗出。1/2-2/3由于肺梗死引起多呈血性胸水,该患者为血性胸水,嗜酸性粒细胞增高,同时单侧为主,符合肺栓塞的合并胸腔积液表现。但患者并无栓塞高危因素,同时早期外院D二聚体无明显升高,有待完善肺动脉CTA鉴别,同时完善下肢Doppler及心超等评估有无VTE及心功能受累;
其次看肿瘤性疾病:外院多次胸腔积液送检脱落细胞检查未见恶性细胞依据,同时恶性胸腔积液中PFE的发生率较低,据文献报道约为2.3%-6.8%。PFE患者中胸膜恶性肿瘤的发生率为6%-40%,其他肿瘤如:淋巴瘤、间皮瘤、高嗜酸性粒细胞综合征、慢性嗜酸性粒细胞白血病等也可发生PFE,故必要时可考虑行胸腔镜等有创检查明确是否有胸膜病变及骨髓穿刺明确是否有血液系统恶性肿瘤可能。
此外还有原发性嗜酸性粒细胞增多性疾病:外院第二次胸腔穿刺检查发现胸腔积液中大量嗜酸性粒细胞增多,外周血EOS% 20%,EOS计数1.74*109,骨髓穿刺,提示嗜酸粒细胞比例增多症,但我科入院复查血常规EOS% 7%,嗜酸粒细胞计数0.39×109/L未达到嗜酸性细胞增高增多标准,同时也不符合高嗜酸性粒细胞增多症及特发性嗜酸性粒细胞增多综合征。可再次骨髓穿刺明确一过性嗜酸性粒细胞升高原因。
还有一些罕见原因,如风湿免疫疾病:嗜酸性肉芽肿性血管炎(EGPA,也称为Churg-Strauss综合征)、类风湿性胸腔积液等也可出现嗜酸性粒细胞升高的胸腔积液,但通常有全身多系统受累表现,可完善肺功能、ANCA、RF等类风湿标志物及全身多脏器的评估。
完善以下检查:
血常规:嗜酸粒细胞百分比 7.0%,嗜酸粒细胞计数0.39×109/L,余基本正常。
DIC:APTT 29.9s,PT 12.3s,INR 1.04,纤维蛋白原3.7g/L,D-D二聚体2.19mg/L,纤维蛋白原降解产物7.6mg/L
PRO-BNP:PRO-BNP 232.7pg/ml,心肌蛋白:正常。
真菌:βD-1,3葡聚糖(真菌) <31.25pg/mL 曲霉:曲霉特异性IgE 0.01KUA/L
隐球菌:新型隐球菌乳胶凝集试验 阴性(-)
T-SPOT: T-SPOT结核感染T细胞(A抗原) 0 T-SPOT结核感染T细胞(B抗原) 0;寄生虫抗体: 外送上海寄生虫研究所 均阴性
ANCA:P-ANCA 阴性(-) PR3 10.76 MPO 0 C-ANCA 阴性(-)
免疫:免疫球蛋白IgG 13.49g/L 免疫球蛋白IgA 4.90↑g/L 免疫球蛋白IgM 0.91g/L 免疫球蛋白IgE 70.7IU/mL 补体C3 1.16g/L 补体C4 0.39g/L
抗“O”:抗链球菌溶血素“O” 37kIU/L
RF :类风湿因子 <10Ku/L
ANA/ENA:均阴性
抗心磷脂:抗心磷脂IgG抗体(ELISA) ≤9.4GPL 抗心磷脂IgA抗体(ELISA) ≤9.4APL 抗心磷脂IgM抗体(ELISA) ≤9.4MPL 抗β2糖蛋白1IgG/A/M抗体定性(ELISA) 阴性
肿瘤标志物:癌胚抗原 1.63ng/mL 神经元特异性烯醇化酶 16.44ng/mL 细胞角蛋白19 0.94ng/mL 鳞状细胞癌相关抗原 1.10ng/mL 糖类抗原125 45.0↑U/mL 糖类抗原199 6.6U/mL
胸水B超:右侧胸腔内肺底可见无回声区,最大深度约21mm,不易穿刺,左侧无胸腔积液。
下肢动静脉超声:血流参数未见明显异常,双下肢深静脉血流通畅。
心超:未见明显异常。
肺功能:轻度阻塞性通气功能障碍,弥散功能轻度减退,外周和中心气道阻力均正常,舒张试验阴性。
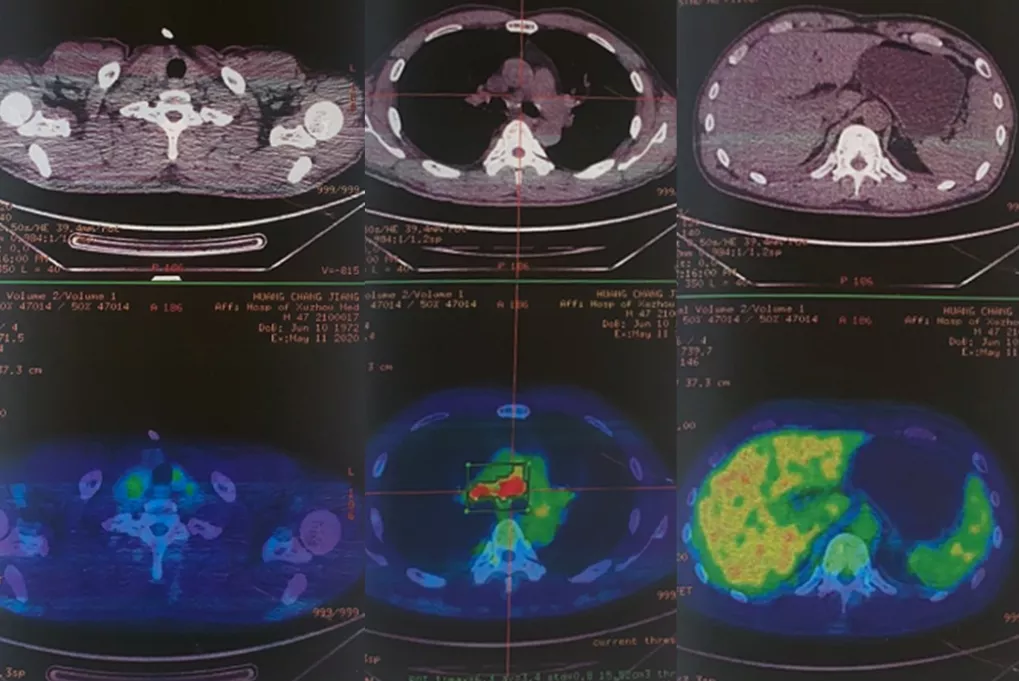
肺动脉CTA:右肺动脉主干栓塞,右肺少许渗出,右侧少量胸腔积液。
骨髓穿刺活检:骨髓涂片见骨髓增生活跃,粒系增生活跃,嗜酸粒细胞可见。AKP积分:40分/100.N.C,红系增生活跃,以中晚幼红细胞为主,成熟红细胞大小不一(+/-)。巨系尚增生,血小板散在或成簇可见。骨髓增生活跃,粒、红二系增生活跃,巨系尚增生,血小板散在或成簇可见。骨髓流式细胞:未见异常造血细胞群体。病理:纤维、骨、碎骨,局部区域小梁间三系造血细胞基本正常范围,粒红比正常范围,嗜酸细胞占比大致正常范围(<5%)。

图2:2020-05-27肺动脉CTA示右肺动脉主干栓塞,右肺少许渗出,右侧少量胸腔积液。
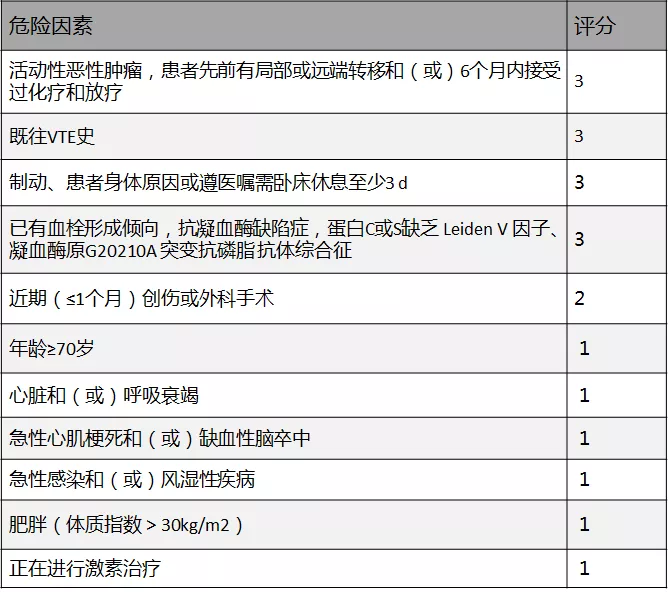
通过一系列检查,最终发现了「肺栓塞」,按肺栓塞分级为中低危,由于胸水较少未再行胸水穿刺引流,故目前嗜酸性粒细胞升高胸腔积液原因尚不明确,推测肺栓塞相关或穿刺创伤引起的可能性较大。患者目前诊断为肺动脉栓塞,按照Padua评分(图3)仅为1分,根据Well评分与Geneva评分患者均属于低度可能。
思考:患者目前诊断为肺栓塞,考虑为慢性肺栓塞还是急性肺栓塞?
剧情再次反转,这类罕见恶性肿瘤,临床症状酷似慢性肺栓塞……通过影像学表现、抗凝治疗无效等可进行鉴别
科内进行了再次讨论,认为,患者为中年男性,既往无血栓危险因素,无下肢深静脉栓塞,起病隐匿,缓慢进展,无突发呼吸困难,胸痛等表现,与急性血栓性肺栓塞不同,结合影像:主干病灶,膨胀性生长,中央强化不均,与血管壁分界模糊,PET-CT局部高代谢等,经MDT讨论后最终诊断为慢性肺动脉栓塞(中低危),同时考虑恶性肿瘤不能排除,予以低分子肝素抗凝治疗,并进一步完善易栓症相关检查,请心脏外科会诊评估能否手术取栓治疗。
图3:Padua评分
图4:简化Wells评分与Geneva评分
图5:外院PET-CT
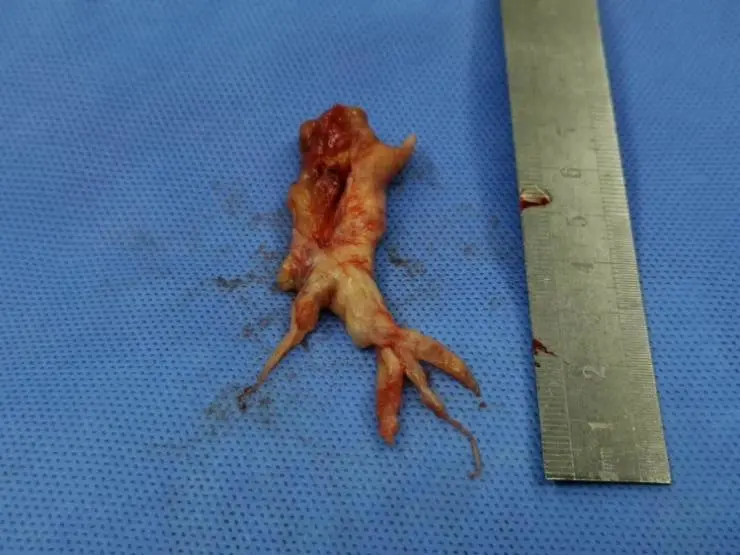
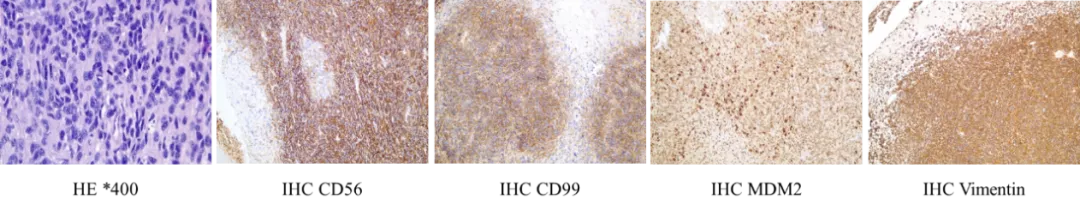
心脏外科会诊后考虑存在手术指征,排除禁忌后在全麻、体外循环下行肺动脉内肿物切除术,术中:至右肺动脉开始完整剥除肺动脉内膜至肺段血管水平。剥除后直接肺动脉测压45/11(21)mmHg。术后病理提示「肺动脉血栓」恶性梭形细胞肿瘤伴坏死,免疫组化Vimentin(+),CD56(+),CD99(+),MDM-2(+),CDK4(少+),Ki67(热点区约30%+) ,SMA(-),MyoD1(-) AE1/AE3(-):Desmin(-) Myogenin(-),S-100(-), CD34(-) CD31(-) Factor8(-) ,BCL-2(-) HHV-8 ALK-1(-),STAB2 FISH检测结果(FISH20-1332)MDM2基因分布情况:簇状分布MDM2基因检测结果:(+),符合「肺动脉血栓」动脉内膜肉瘤,伴坏死,免疫组化标记结果未提示明确分化方向,符合高级别未分化肉瘤。术后患者恢复良好,并接受了3次化疗,方案:多美素60mg d1+异环磷酰胺2.5g d1-3,定期心外随访肺动脉CTA及心超。
图6:手术完整剥除肺动脉内膜至肺段血管水平
图7:术后病理
原发性肺动脉肉瘤是一种罕见的恶性肿瘤,其临床症状酷似慢性肺栓塞(缓慢出现的呼吸困难、劳累性气促),但抗凝无效需考虑这种疾病而非肺动脉栓塞。
国内外文献报道大多少病例在手术前多被误诊为肺栓塞[1]。肺栓塞患者多有栓塞高危因素及下肢深静脉血栓形成或肺血栓栓塞病史,发生部位不定,如发生于肺动脉主干者症状较明显,可有急性呼吸困难、胸痛等,经抗凝或溶栓治疗后症状改善迅速,而发生于肺动脉分支或亚段的患者症状较轻,抗凝治疗效果良好。
肺动脉肉瘤临床表现不典型,起病缓和,静息状态多可代偿,患者多无明确血栓栓塞病史及高危因素,抗凝或溶栓治疗反应不佳。影像上肺动脉肉瘤多以肺动脉主干充盈缺损为主,可累计双侧肺动脉,肿块形态不规则,在面向血流面边缘饱满、隆起,甚至呈分叶改变[1]。
部分CTPA可见肺动脉血管病被浸润的表现,原发性肺动脉肉瘤多起源于肺动脉主干肺动脉瓣部位的一侧肺动脉内膜或中层,在内膜或中层中潜行生长,并逐渐占据肺动脉腔,在接近肺动脉瓣一侧肺动脉壁缺蚀样改变[2],而慢性肺动脉栓塞患者其肺动脉壁光整。有研究报道85%肺动脉肉瘤发生于肺动脉主干,71%累及右肺动脉,部分可累及右室流出道。此外,肺动脉肉瘤患者在诊断时已存在转移病灶,如肺内、纵隔转移病灶,也可作为其主要的鉴别点[1]。
肺动脉肉瘤患者的D-二聚体多为正常也是的重要鉴别诊断依据。MRI可清晰显示肺动脉腔内软组织肿块附着于肺动脉壁向双侧肺动脉分支蔓延,周围可见受压变窄的血管腔呈流空低信号,常伴有右心增大,增强时可见病变中度或明显强化,肿瘤坏死出血时,可出现不均匀强化[3]。PET-CT可见管腔内软组织肿物SUV增高,提示恶性成分。超声心动图可见肺动脉肉瘤表面不规则,多为不均质强回声,并可见包膜回声,呈分叶或息肉状;瘤体早期尚未充满血管腔时,有一定的活动度,而血栓则固定不活动;超声能发现肿瘤内的血流信号,而血栓则无血流信号[4]。如发现肿瘤侵及肺动脉瓣或异常回声肿块随血流「摆动」,则能辅助诊断[3]。
肺动脉肉瘤的预后较差,未经手术治疗平均生存时间仅有1.5-3月,目前以手术切除及放化疗为主要治疗手段。手术治疗后生存时间可延长至12-18个月,少数报告术后放化疗辅助下可存活45-62个月。双侧肺动脉病变、合并向肺动脉外浸润时,患者已失去手术机会。目前无统一化疗方案及指南推荐,常用化疗药物有:表柔比星、阿霉素、异环磷酰胺、顺铂等。可辅助放疗[5]。病理类型可能与预后有一定关系,主要5类:未分化肉瘤(31.2%),平滑肌肉瘤(15.9%),梭状细胞肉瘤(13.8%),恶性纤维组织肉瘤(7.2%),纤维肉瘤(5.1%)。有研究表明平滑肌肉瘤预后最好,横纹肌肉瘤预后最差[6]。
综上结论——肺动脉肉瘤是一类罕见恶性肿瘤,临床症状酷似慢性肺栓塞,通过影像学表现、抗凝治疗无效等可进行鉴别,本例患者以胸水嗜酸性粒细胞升高,通过基于病史资料、肺动脉CTA、PETCT、手术病理等结果,最终联合相应科室共同明确诊断。
多选题答案:肺结核、真菌感染、胸膜创伤、寄生虫感染、肺栓塞
参考文献
1.Blackmon SH, Reardon MJ. Pulmonary artery sarcoma. Methodist DeBakey cardiovascular journal 2010;6:38-43.
2.Gan HL, Zhang JQ, Huang XY, Yu W. The wall eclipsing sign on pulmonary artery computed tomography angiography is pathognomonic for pulmonary artery sarcoma. PloS one 2013;8:e83200.
3.Kim C, Kim MY, Kang JW, Song JS, Lee KY, Kim SS. Pulmonary Artery Intimal Sarcoma versus Pulmonary Artery Thromboembolism: CT and Clinical Findings. Korean journal of radiology 2018;19:792-802.
4.Attinà D, Niro F, Tchouanté P, et al. Pulmonary artery intimal sarcoma. Problems in the differential diagnosis. La Radiologia medica 2013;118:1259-68.
5.Assi T, Kattan J, Rassy E, et al. A comprehensive review on the diagnosis and management of intimal sarcoma of the pulmonary artery. Critical reviews in oncology/hematology 2020;147:102889.
6. 沈凌.原发性肺动脉肉瘤的诊治进展[J].国际呼吸杂志,2009,29(20):1259-1263.
专家介绍

周敏
上海交通大学医学院附属瑞金医院;呼吸与危重医学科 主任医师,科副主任;博士生导师,正教授,法国居里研究所博士后;中华医学会呼吸病分会工作秘书,呼吸治疗学组副组长;中国医师协会呼吸分会慢阻肺委员会委员、政策委员会副主委;上海医学会呼吸病分会委员和慢阻肺学组副组长;上海女医师协会肺部肿瘤专委会副主任委员。

虞有超
上海交通大学医学院附属瑞金医院,呼吸与危重医学科 主治医师;2018级 PCCM学员;法国斯特拉斯堡大学附属市立医院 外籍住院医师。