随着肿瘤免疫治疗的迅速发展,肺癌治疗迈入免疫治疗的新时代。无论是非小细胞肺癌还是小细胞肺癌,主要的免疫治疗方案包括PD-1单抗、PD-L1单抗、以及CTLA-4单抗的治疗等。
关于肺癌免疫治疗的现状和进展,我们将分别从非小细胞肺癌(non-small-cell carcinoma, NSCLC)和小细胞肺癌(small-cell carcinoma, SCLC)两方面作以介绍。
1 NSCLC免疫治疗进展
1.1 IV期:百花齐放,寻求突破
纵观全球,免疫治疗已改变非小细胞肺癌(NSCLC)整体治疗的格局。目前,NSCLC免疫治疗适应症,主要聚焦于晚期驱动基因阴性NSCLC患者一线治疗。经美国食品药品监督管理局(FDA)批准的免疫治疗药物包括默沙东的帕博利珠单抗(Pembrolizumab, Keytruda)、阿斯利康的德瓦鲁单抗(durvalumab)、美百时的纳武单抗(nivolumab, opidivo)、罗氏的阿特朱单抗(Atezolizumab)等。同时,我国的免疫治疗新药也迅速发展,国家药品监督管理局(NMPA)已批准了多种国产免疫治疗新药的相应适应症。
1.1.1 助力长生存----免疫治疗用于晚期驱动基因阴性NSCLC
①驱动基因阴性晚期/转移性NSCLC---多种治疗模式并行
2021年,多个研究报道晚期驱动基因阴性非小细胞肺癌患者应用免疫治疗可使患者获得长期生存。
免疫单药、免疫联合化疗、免疫联合放疗、免疫联合抗血管、双免联合等多种免疫治疗模式,一线治疗晚期NSCLC的多个重要III期临床研究结果均已显示生存获益。2021年美国临床肿瘤学会(ASCO)指出:继续探索免疫策略、优化现有免疫治疗方案、减少癌症治疗的不良后果成为未来研究的重点。
②晚期NSCLC一线免疫单药或联合化疗助力患者长生存
免疫单药长生存数据:
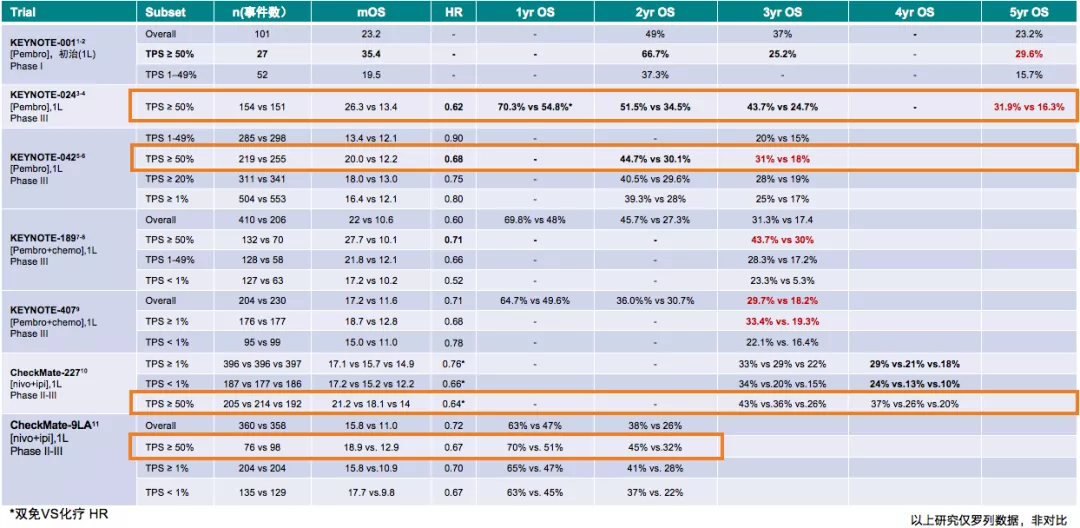
在帕博利珠单抗(Pembrolizumab)一线单药治疗PD-L1阳性NSCLC研究中,早期的KEYNOTE-001研究显示,PD-L1≥50%的患者中,5年生存率为29.6%(约30%),该研究开启长期生存的希望。KEYNOTE-024研究中,5年生存率为31.9%,较单纯化疗组提升1倍。KEYNOTE-042研究中,PD-L1≥50%患者,3年生存率达到了31%,较化疗组提升近1倍。
免疫联合化疗长生存数据:
KEYNOTE-189的帕博利珠单抗联合化疗一线治疗非鳞状NSCLC,和KEYNOTE-407的帕博利珠单抗联合化疗一线治疗鳞状NSCLC研究中,3年生存率都接近1/3,与单纯化疗对照组相比,均显著性延长了患者的生存期。实验研究中,单纯化疗对照组治疗失败后,交叉到免疫治疗组,其生存获益明显提高。
因此,免疫治疗有利于非鳞状和鳞状NSCLC患者长期生存,且越早治疗效果越好。
双免联合:
Checkmate 9LA研究是针对驱动基因阴性晚期NSCLC的开放、随机、Ⅲ期临床试验,旨在探NIVO+IPI+2周期化疗对比4周期化疗一线治疗IV期/复发NSCLC患者作为晚期NSCLC一线治疗方案的疗效和安全性,以及生物标志物对疗效的影响。结果显示,无论病理类型如何,PD-L1表达阳性/阴性,NIVO+IPI联合2周期化疗生存率明确获益,且2年生存率达到38%。
CHECKMATE 227研究,入组的为未经系统治疗亦无驱动基因突变的晚期/复发的NSCLC患者,经PD-1单抗和CTLA-4单抗联合治疗,结果显示:PD-L1≥1%,4年OS率为29%;PD-L1<1%,4年OS率为24%;PD-L1>50%,4年OS率为37%,生存获益非常理想。
对晚期NSCLC患者免疫治疗长生存的各项研究中(表1),患者的2年生存率均体现出了明显生存获益。
随着我国医疗水平的发展,相信,一定会看到国产免疫治疗药物使患者长期生存的情况!
表 1:晚期NSCLC患者免疫治疗长生存研究汇总
1.1.2 扩人群,探寻可获益人群----免疫治疗用于晚期驱动基因阳性NSCLC
中国NSCLC人群EGFR突变率高,人群庞大,这意味着TKI耐药后的治疗需求巨大(图1)。对于这部分人群,除化疗外,能否通过免疫治疗提供更优的治疗策略?

图 1:中国EGFR突变率数据图
①免疫治疗在EGFR突变NSCLC患者中的探索分析
临床研究数据显示,免疫单药治疗EGFR突变NSCLC疗效不尽如人意(表2)。
表 2:免疫治疗EGFR突变NSCLC临床研究数据
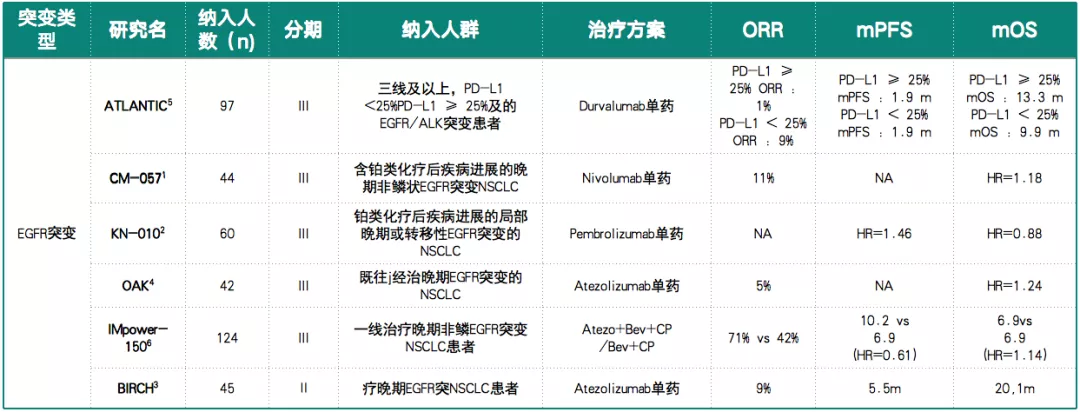
②KEYNOTE-789:一项观察帕博利珠单抗/安慰剂+培美曲塞+铂类化疗治疗TKI耐药、EGFR突变转移性非鳞NSCLC的III期随机双盲临床试验(图2)。
KEYNOTE-789研究结果将会明示,免疫治疗对EGFR阳性NSCLC患者有何作用。
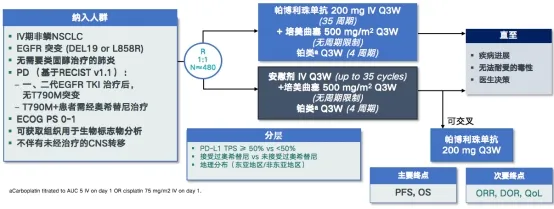
图 2:KEYNOTE-789研究的试验内容
③Meta分析:KRAS+NSCLC可以从免疫治疗中获益
驱动基因阳性NSCLC并非免疫治疗的空白区,比如KRAS基因突变NSCLC患者受益更多。
一项Meta分析比较了一线或二线抗PD-(L)1+/-化疗(CT)与单独CT治疗KRAS突变晚期NSCLC的随机试验数据,主要分析总生存期(OS)和无进展生存期(PFS)。研究结果显示无论一线还是二线,免疫治疗可以为KRAS突变型NSCLC带来生存获益。
④CodeBreaK 100:KRAS G12c突变NSCLC的亚组分析
Ⅱ期CodeBreaK100试验纳入的126例患者中,大多数(81.0%)既往接受过铂类化疗及抗PD-(L)1治疗。本研究评估了sotorasib对于接受过标准治疗的KRAS p.G12C突变晚期NSCLC患者的抗癌活性。研究截止日期为2021年3月15日,研究中位随访时间为15.3个月。
结果显示:经抗PD-(L)1治疗后的患者口服sotorasib患者的中位OS为17.7个月,ORR为69.2%。
研究结论:II期CodeBreaK100试验证明了sotorasib可为经PD-(L)1治疗后的KRAS p.G12C突变非小细胞肺癌带来持久获益。
⑤正在进行中的驱动基因阳性NSCLC患者免疫治疗Ⅲ期临床研究
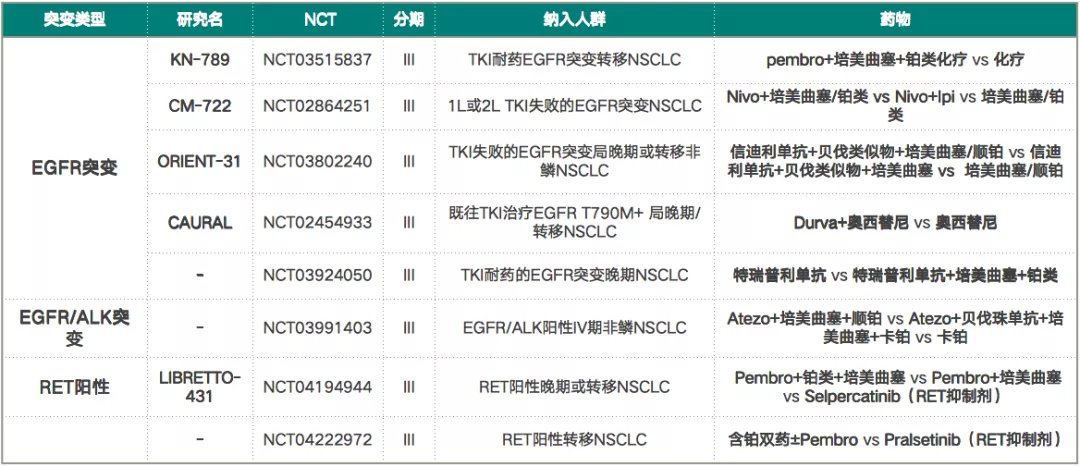
EGFR突变、EGFR/ALK突变、RET阳性等多项免疫治疗的临床试验还在进行中(表3),最终的临床研究数据将会进一步说明免疫治疗对于驱动基因阳性NSCLC患者的治疗效果。
表 3:EGFR突变、EGFR/ALK突变、RET阳性的免疫治疗临床试验
1.1.3 新靶点、新联合---免疫治疗用于晚期驱动基因阴性NSCLC
免疫单药治疗NSCLC只有20%左右的有效率,联合化疗后可以提高很多。那么,如何实现最高获益,如何克服免疫耐药?
①联合是未来的发展方向
从过去10年PD-1/PD-L1单抗联合试验的趋势来看(图3),最主要的是与抗VEGF/VEGFR、化疗和CTLA-4单抗的联合使用。从靶点看,新增的试验靶点(VEGFR、PARP)愈发明确,新靶点(TIGIT、TKI、TIM-3, LAG-3, etc.)崭露头角。
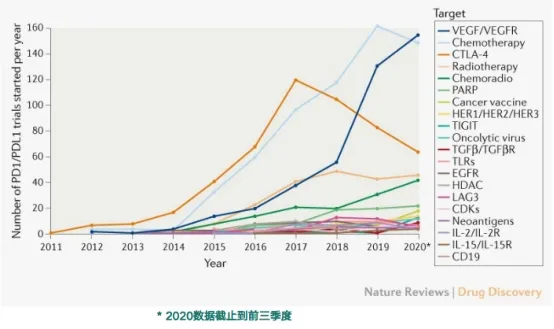
图 3:PD-1/L1单抗联合治疗评估的主要靶点
②探索免疫新靶点及联合策略,提高前线生存获益,克服耐药现状
根据不同免疫分型,更有针对性选择治疗策略,通过温暖冷肿瘤重启免疫反应、改变抑制性免疫微环境、进一步增强抗肿瘤免疫等,都是消灭肿瘤的策略。
③新型治疗药物
KN046(PD-L1/CTLA-4 抑制剂):
KN046是一种新型双特异性抗体,可阻断PD-L1与PD-1/CD80的相互作用以及CTLA-4与CD80/CD86的相互作用;
KN046已在二线治疗晚期非小细胞肺癌(NSCLC)临床研究中显示出良好的耐受性、安全性和有效性。
在一线研究中(图4),假设KN046可以与全疗程化疗相结合,一线治疗并建立更持久的临床益处。KN046联合化疗一线治疗NSCLC的初步研究数据显示ORR达50.6%。
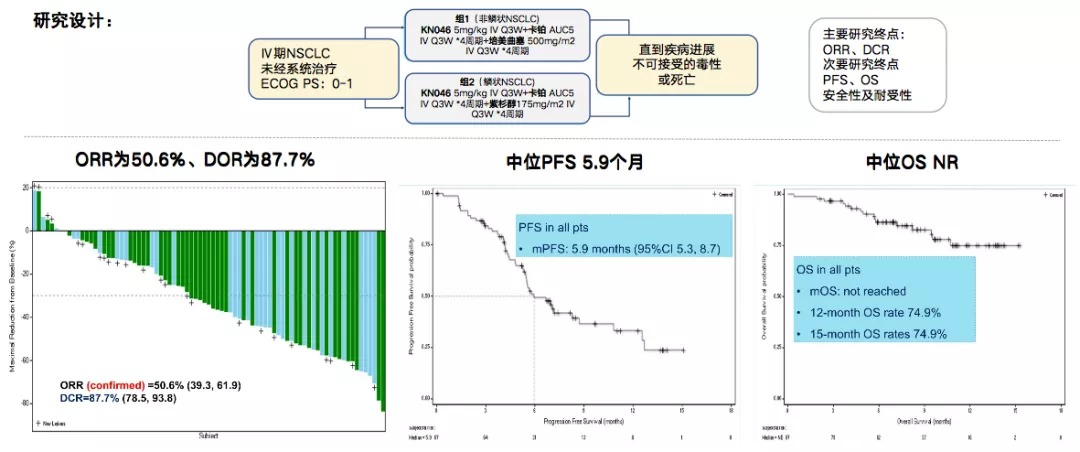
图 4:KN046联合化疗治疗NSCLC研究设计及试验结果
Eftilagimodalpha(LAG-3 融合蛋白):
Eftilagimodalpha是一种可溶性LAG-3融合蛋白。Eftilagimodalpha通过与APC表面的主要组织相容性复合体II(MHC II)相结合,能够激活APCs,这会导致细胞毒性CD8阳性T细胞数量的增加和激活。
本次ASCO大会报告了II期试验(NCT03625323)中Eftilagimodalpha+帕博利珠单抗1L治疗非小细胞肺癌的部分研究结果。
该研究共纳入36例患者,本次报告截止日期到2021年1月,中位随访时间为14个月。
研究结果:
安全性数据:92.3%的患者存在任何级别TRAE。
疗效数据:BICR评估患者的ORR为41.7%,PD-L1≥50%患者的ORR可达53.8%。
Efti联合Pembro耐受性良好,显示令人鼓舞的活性,支持进一步的临床研究,扩展研究正在进行。
Ociperlimab(Anti-TLR3):
ADVANTIG-302研究:抗TIGIT单抗Ociperlimab联合替雷利珠单抗对比帕博利珠单抗单药一线治疗PD-L1高表达、不可切除局部晚期/转移性非小细胞肺癌的国际多中心、随机、双盲的Ⅲ期临床研究。抗TIGIT单抗可作为T细胞、NK细胞活化剂。
BO-112(TLR3激动剂):
BP-112联合Pembro或者Nivo治疗PD-1单抗经治进展实体瘤患者的I期研究队列4中,28例患者总体ORR 11%,DCR 46%。其中2例黑色素瘤患者获得PR。II期黑色素瘤研究正在进行中,结果将明示NSCLC能否借鉴?
Bemcentinib(AXL抑制剂):
Bemcentinib是一种First-in-class高选择性、强效、口服小分子AXL激酶抑制剂,通过靶向并结合AXL受体酪氨酸激酶的细胞内催化激酶结构域并抑制其活性,抑制肿瘤耐药及逃逸相关通路。
KEYNOTE-531(BGBC008)研究是一项II期开放标签的多队列2阶段临床研究,旨在探索Pembrolizumab联合Bemcentinib这一方案在既往治疗失败的NSCLC患者中的疗效和安全性。初步研究结果显示cAXL+患者PFS获益较cAXL-患者显著,安全可耐受,联合治疗的安全性与单独药物的安全性一致。
其他:
目前正在进行中的克服NSCLC免疫治疗耐药相关临床研究,包括Anti-PD-1/L1+靶向治疗、Anti-PD-1/L1+疫苗、Anti-PD-1/L1+其他IO治疗、Master Protocols、以及其他临床研究,将是未来治疗NSCLC、克服免疫耐药、提高生存率的希望。
1.2 局晚期/早期:助攻有道,多角度发展
1.2.1 多模式探索,助力III期获益---免疫治疗用于局晚期NSCLC
①免疫联合放疗具有协同增效作用
放疗增强树突状细胞和巨噬细胞对损伤的肿瘤细胞的吞噬作用,从而促进抗原提呈和肿瘤特异性T细胞的激活;肿瘤乏氧微环境是导致放射治疗抵抗的主要原因之一;免疫治疗通过T细胞依赖的途径诱导血管正常化,改善肿瘤内乏氧微环境,增强放疗效果(图5)。因此,免疫联合放疗具有协同增效作用。

图 5
《非小细胞肺癌指南(2021)》和《非小细胞肺癌诊疗指南(2020)》已明示:同步放化疗(CCRT)→免疫治疗(IO)巩固治疗为局晚期NSCLC标准治疗模式(图6-7)。

图 6:非小细胞肺癌指南2021

图 7:非小细胞肺癌诊疗指南2020
②PACIFIC研究:5年生存数据更新
2021年公布了PACIFIC研究的5年生存数据,中位OS(95% CI)为47.5个月,5年OS率为42.9%。中位无病生存期(PFS)为16.9个月,5年PFS率为33.1%(图8)。

图 8:PACIFIC研究的5年生存数据
③基于PACIFIC模式:头对头比较—Ⅲ期临床研究
在前期的同步放化疗中加入免疫治疗的试验已在开展中,例如纳武尤利单抗和帕博利珠单抗试验等。其研究结果将能够看出早期免疫治疗局晚期NSCLC是否有更好的疗效(图9)。

图 9:纳武尤利单抗和帕博利珠单抗试验内容
④免疫治疗联合放化疗的策略探讨
模式一:同步放化疗→免疫治疗巩固(C(s)CRT→IO),是目前标准治疗模式;
模式二:同步放化疗+免疫治疗→免疫治疗维持(CCRT+IO→IO);
模式三:诱导化疗→同步放化疗+免疫治疗→免疫治疗维持(C→CRT+IO→IO);
模式四:免疫治疗诱导→同步放化疗→免疫治疗维持(IO→CCRT→IO)。
CCRT+IO→IO:
KEYNOTE-799是一项非随机、多中心、开放标签、II期研究,帕博利珠单抗联合同步化放疗一线治疗不可手术的局晚III期NSCLC。纳入216例NSCLC患者,队列分为鳞癌(帕博利珠单抗+紫杉醇)和非鳞癌(帕博利珠单抗+培美曲塞)。两组ORR都达到了70%,已经超过了靶向治疗。两组的PFS和OS都没有达到,12个月的生存率达到了80%以上,研究结果获得了非常好的疗效(图10)。
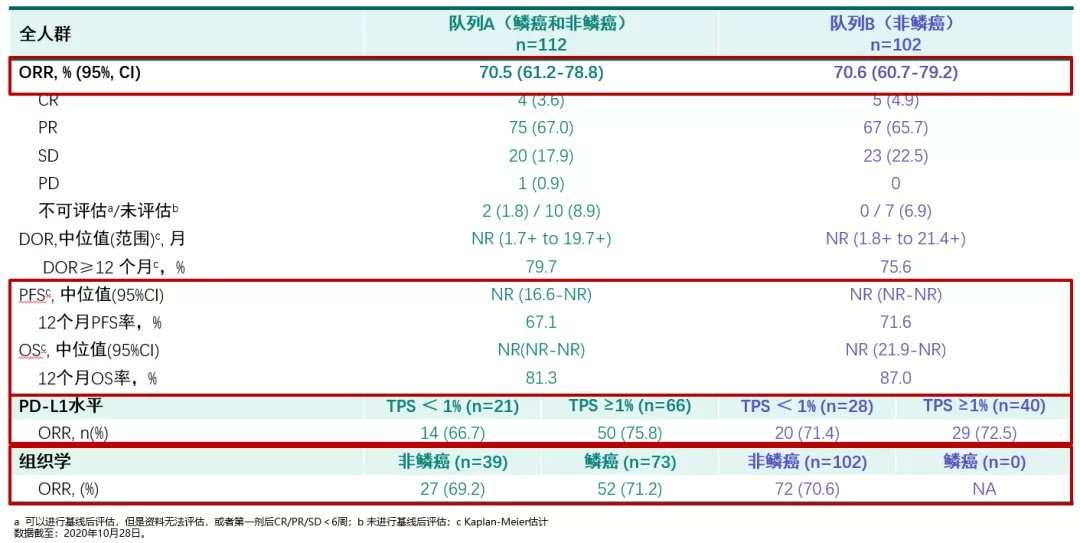
图 10:ORR、DOR、OS和PFS疗效数据更新
EA5181是一项随机、多中心、III期研究,度伐利尤单抗联合同步放化疗与PACIFIC模式作对照的试验研究。目标样本量为660名患者,预计招募时间55个月以上,并随访42个月。研究于04/09/20启动,目前已于02/03/21累积了90名患者。
纳入标准:ECOG PS 0-1;肺功能允许(FEV1 和 DLCO 均 > 40%);无自身免疫性疾病病史;既往未接受过化疗或放疗。
主要终点:OS;
次要终点:PFS、局部/远处转移率、毒性(图11)。

图 11:EA5181研究内容
C+IO→CRT+IO→IO:
局晚期手术不可切除的NSCLC约有20%至25%因CCRT不可耐受或疾病进展而没有资格接受度伐利尤单抗治疗。
已有I/II期研究表明,帕博利珠单抗联合CCRT安全性可耐受;奥拉帕利是唯一在不同瘤种中均获得III期研究阳性结果的PARP抑制剂。帕博利珠单抗联合奥拉帕利治疗对于肺癌(铂敏感瘤种之一)而言,有可能协同增效。
KEYLYNK-012(NCT04380636)是一项在不可切除、局晚III期NSCLC 帕博利珠单抗联合CCRT,继而帕博利珠单抗联合或不联合奥拉帕利维持对比CCRT继而度伐利尤单抗维持的III期临床研究。
全球计划入组870例受试者,涉及24个国家/地区 ,全球约205个研究中心;中国135例受试者,约27个中心(图12)。

图 12:KEYLYNK-012研究内容
IO→CCRT→IO:
AFT-16:阿替利珠单抗新辅助治疗→CCRT→IO辅助治疗。
临床II期研究,纳入64例不可切除的III期NSCLC,PS 0-1,使用Atezo作为辅助治疗或新辅助治疗方案后联合CRT治疗。
主要终点:12周时的疾病控制率(DCR);
次要终点:ORR,安全性,PFS和OS(图13)。
图 13:AFT-16研究内容
结果显示:中位随访24.1个月后,46名患者依然存活;中位PFS为23.7个月(95%CI 13.2-NE),12个月和18个月的PFS率分别为66%(95%CI 55-79)和57%(95%CI 45-71);18个月OS率为84%(95%CI 75-94);完成CRT的患者12个月和18个月的PFS率分别为78%和72%;耐受性良好。
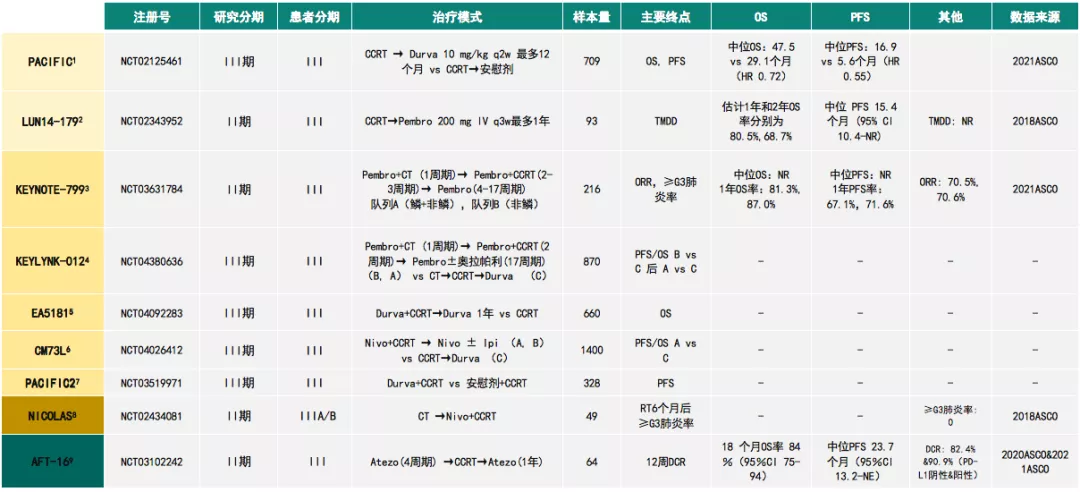
⑤局晚期不可手术NSCLC免疫治疗研究汇总(表4)
综合下表:免疫治疗联合放化疗对局部晚期不可手术NSCLC患者的作用非常明显。
表 4:局晚期不可手术NSCLC免疫治疗研究汇总
1.2.2 多模式探索,助力可切除疗效---免疫治疗用于早期NSCLC
①围手术期免疫治疗的理论优势
早期未治疗的肿瘤中抗原负荷更高,肿瘤异质性更低,而手术会造成全身免疫抑制(图14)。

注:手术切除肿瘤引起炎症、神经内分泌和代谢事件,导致细胞因子水平变化(IL-2、IL-12和IFN-γ降低,IL-6/8、IL-10和TNF-α升高)和生长因子(VEGF、PDGF、TGF-β)、凝血因子和应激激素(儿茶酚胺、前列腺素)的释放。虽然这些事件对于伤口愈合和疼痛处理是必不可少的,但会导致Tregs、MDSC和M2巨噬细胞的扩增。这些调节性免疫细胞的增加导致PD-1/CTLA-4的表达增加,T细胞增殖减少,NK细胞的细胞毒性受损,从而导致免疫抑制。和外科创伤相关,其他的术后因素,包括败血症、失血、低温、麻醉药、镇痛剂和吻合口并发症都会导致免疫抑制。
图 14:手术后免疫抑制的机制
新辅助免疫治疗 vs 新辅助化疗:
新辅助化疗的作用在于术前“缩减(debulk)”肿瘤;新辅助免疫治疗可以增强针对肿瘤抗原的全身性T细胞应答,增强对微转移肿瘤的检测和杀伤,从而减少术后复发。
新辅助免疫治疗 vs 辅助治疗:
辅助治疗可针对微转移,减少复发;新辅助免疫治疗可以利用原发肿瘤中更高水平的内源性肿瘤抗原来增强T细胞启动,促成循环系统中更多的的肿瘤特异性T细胞活化,从而发挥更强的抗肿瘤作用。
②围术期NSCLC免疫治疗的治疗模式
IO-based新辅助:新辅助免疫治疗→手术;
围术期IO-based治疗:新辅助免疫治疗→手术→辅助免疫治疗;
术后辅助IO治疗:手术→辅助免疫治疗。
③早期NSCLC IO新辅助和辅助治疗研究布局(III期研究)
辅助治疗和新辅助治疗两种模式在临床上已经开展应用,各具优势(图15)。

图 15:ASCO 2021推荐的辅助治疗和新辅助治疗的模式
④IMpower010:Atezo联合化疗辅助治疗IB-IIIA期NSCLC
IMpower010研究是一项随机、开放标签、临床III期研究,评估阿替利珠单抗联合辅助化疗来治疗IB-IIIA期NSCLC患者术后辅助治疗的疗效。患者在肿瘤切除手术之后,首先接受多达4个周期的铂类辅助化疗,然后用阿替利珠单抗或最佳支持治疗(BSC)维持治疗(图16)。
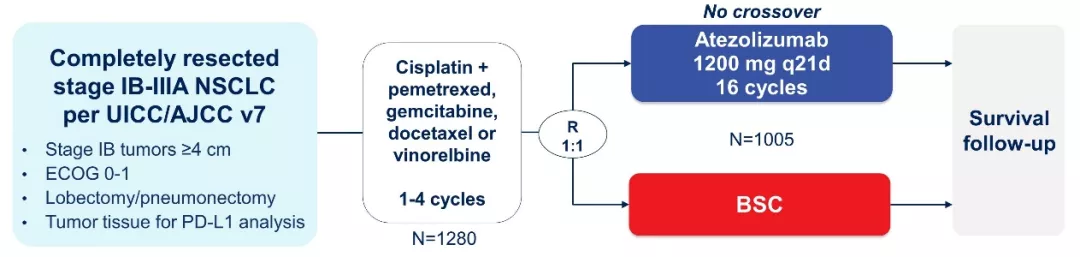
图 16:IMpower010研究
IMpower010达到了DFS的主要终点,在PD-L1 TC≥1%的II-IIIA期人群和所有随机的II-IIIA期人群中,Atezo组与BSC相比显示出统计学上显著的DFS获益;在ITT人群中,DFS没有跨越显著性边界(图17)。但是,对于患者生存期的研究,OS数据更具有意义,这一治疗模式也提示,免疫辅助治疗是有希望的。

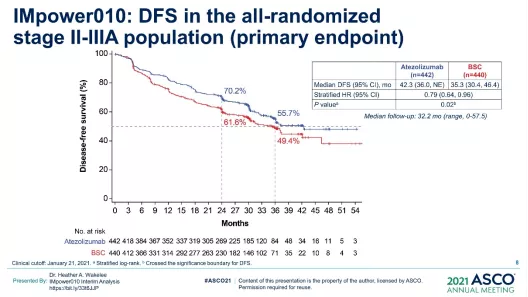
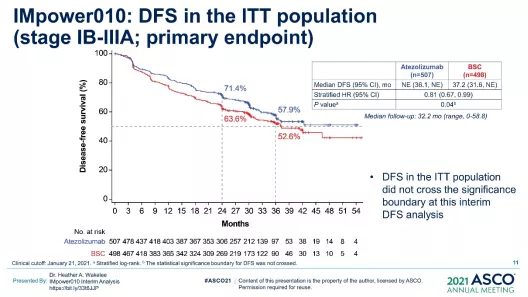
图 17:IMpower010研究的主要分析人群的DFS结果
⑤CheckMate 816:Nivo+CT vs CT新辅助治疗可切除(IB-IIIA期)NSCLC:
新辅助治疗早期疗效显著,如火如荼,患者新辅助治疗之后手术,手术后继续用辅助治疗来维持,能够达到良好的效果。
CheckMate 816研究中,不同分期患者的pCR和病理学消退深度显示,新辅助治疗组的病理学完全缓解率为24%,单一化疗对照组病理学完全缓解率只有2.2%(图18)。因此,在化疗基础上增加免疫治疗作为新辅助治疗,其获益显著。

图 18:不同分期患者的pCR和病理学消退深度
⑥NSCLC围术期免疫治疗已发表证据及正在进行III期研究(表5)
NSCLC围术期免疫治疗在新辅助治疗和辅助治疗上,多项临床试验的研究已经发表,也有很多Ⅲ期的临床试验正在进行中,尤其是新辅助治疗,EFS和OS作为研究的主要终点。其研究结果也许会解答:对于围术期NSCLC患者,新辅助治疗和辅助治疗哪一模式疗效更好?其能成为临床治疗的标准方法?
表 5:NSCLC围术期免疫治疗已发表证据及正在进行III期研究

早期可手术NSCLC免疫治疗正面临诸多挑战,期待后续披露的相关III期研究结果为我们带来更多启示。
2 SCLC免疫治疗进展
近30年来,有关小细胞肺癌的临床试验几乎都呈阴性,自免疫治疗诞生之后,才真正的使小细胞肺癌的临床研究做出突破,尤其体现在晚期小细胞肺癌上。
2.1 SCLC免疫治疗的潜在机制(图19)
①SCLC具有较高肿瘤突变负荷(TMB);
②PD-1/PD-L1信号途径为免疫逃避通路;
③SCLC具有高免疫源性;
④SCLC预后与免疫细胞有关。
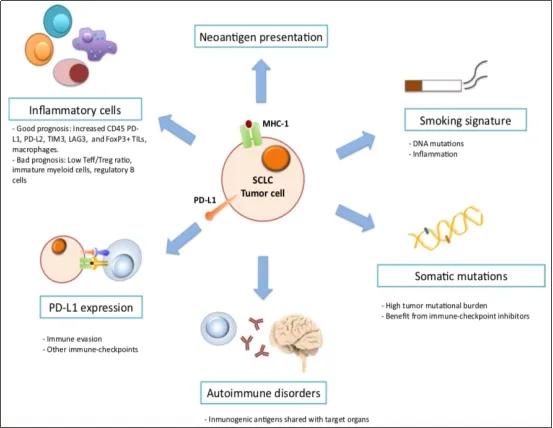
图 19:小细胞肺癌免疫治疗机制
2.2 SCLC免疫治疗关键研究概览
小细胞肺癌重要研究有IMpower133、CASPIAN和KEYNOTE-604,当然,新研究仍在进行中(图20)。

图 20:SCLC免疫治疗关键研究导图
2.3 免疫+化疗建立SCLC一线治疗新标准
IMpower-133:2019年3月,FDA正式批准Atezolizumab联合卡铂/依托泊苷一线治疗ES-SCLC的适应证。
CASPIAN:2019年7月,FDA授予Durvalumab小细胞肺癌孤儿药地位适应证;9月,FDA授予Durvalumab治疗在先前未接受过治疗的ES-SCLC优先审评资格。
KEYNOTE-604:该研究达到了双重主要终点中的一个:与化疗组相比,Pembro联合治疗组PFS观察到统计学意义上的显著改善(HR=0.75)。而另一个主要终点OS方面,与化疗对照组相比,Pembro联合治疗组有所改善,但数据未达到统计学意义的显著差异(HR=0.80)。
2.4 进行中的SCLC免疫治疗研究
2021ASCO报道了派安普利单抗联合安罗替尼二线治疗经含铂化疗失败的小细胞肺癌研究结果。研究结果显示,其中位PFS为4.62个月,比标准二线小细胞肺癌的治疗效果更好。
2021ASCO也报道了普那布林联合纳武利尤单抗和伊匹木单抗治疗复发性小细胞肺癌(SCLC)患者的Ⅰ期临床试验。普那布林(BPI-2358)是首个通过诱导刺激树突状细胞成熟、激活T细胞发挥免疫抗肿瘤作用的选择性免疫调节微管结合剂(SIMBA)。普那布林与纳武利尤单抗和伊匹木单抗联合,对化疗失败后小细胞肺癌体现较好的疗效,且不良反应相对不明显。
2.5 未来:预测免疫治疗OS的标志物探索
在预测免疫治疗OS标志物探索的过程中,SCLC免疫治疗中受益者的界定、疗效的预测和治疗起效因素的研究,十分重要(图22)。
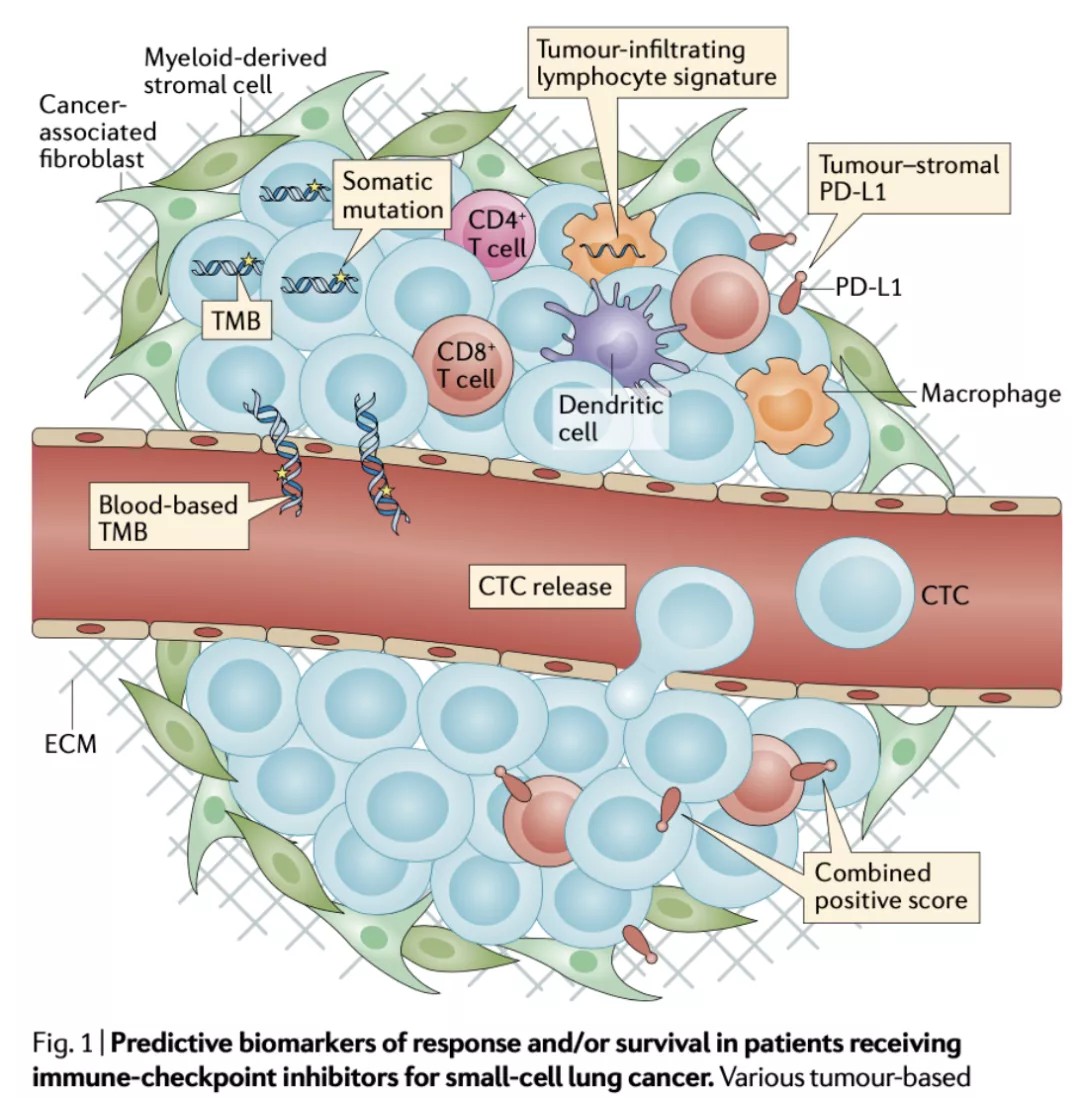
图 22:治疗小细胞肺癌患者OS的预测标志物
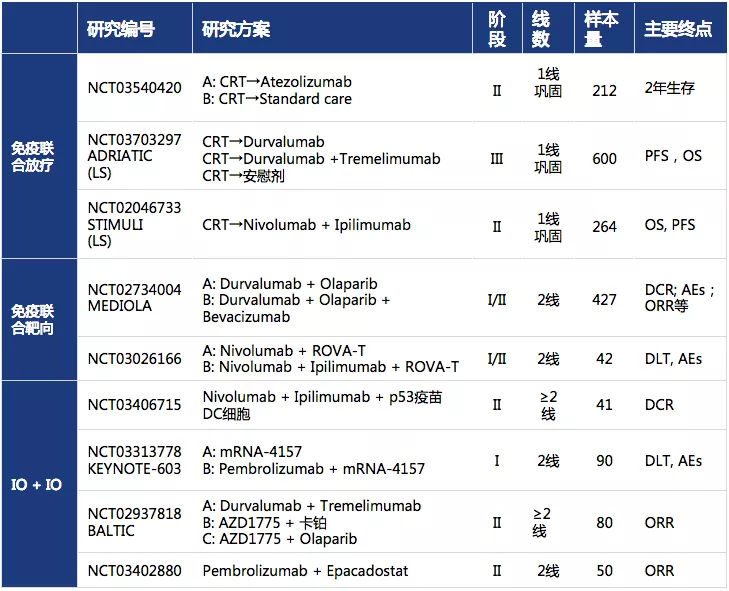
2.6 免疫联合治疗探索前景(表6)
表 6:免疫联合放疗、免疫联合靶向、IO + IO的研究方案
晚期NSCLC免疫治疗已经是全面开花,即将百花齐放,局晚期NSCLC免疫联合治疗和NSCLC围手术期新辅助治疗/辅助治疗都有明确的进展。近30年来免疫治疗是小细胞肺癌研究的唯一进展。未来肺癌免疫治疗的发展让我们拭目以待。
* 参考文献略
专家介绍

王孟昭
教授;北京协和医院呼吸与危重症医学科主任医师,博士生导师;北京肿瘤防治研究会副会长;中国医药教育协会胸部肿瘤分会副主任委员;中国医促会肿瘤内科分会副主任委员;中华医学会呼吸分会肺癌学组成员;老年肿瘤协会委员;中国医师协会肿瘤分会委员;中国抗癌协会化疗专业委员会委员;Clinical Respiratory Journal Associate Editor副主编;中国肺癌杂志编委;临床肿瘤学杂志和国际呼吸杂志编委。