呼出气诊断技术在慢性气道疾病领域非常受关注,它是一种无创的技术手段,能够帮助我们进行疾病诊断、亚型分类以及发病机制的研究。通过呼出气中的生物标志物,还能够指导疾病治疗、判断预后。
外界吸入的气体分子以及一些颗粒物质,部分通过呼吸系统进入体内,部分未经过气体交换呼出体外。人体呼出分子小部分来自呼吸道、胃肠道和机体(即通过肺部血液-空气屏障的系统性分子),大部分分子都来自外界环境。外界有毒有害物质的包括烟草烟雾或PM10、PM2.5等等,这些环境中的气体分子、颗粒物质经过内呼吸、外呼吸的呼吸循环,还会有一部分再从我们的呼吸系统排出,能够通过呼出气检测设备检出 [1] 。

图1. 人体呼出分子的途径。(引自Chem Rev. 2019;119(19):10803-28.)
常见的呼出气检测指标包括呼出气气体信号分子,挥发性有机化合物(VOCs)和呼出气冷凝液(EBC)。挥发性有机化合物(VOCs)和呼出气冷凝液(EBC)目前还在临床前研究阶段,目前临床上常用的呼出气检测技术有呼出气一氧化氮(FeNO)用于评估嗜酸性气道炎症。它能够辅助哮喘等气道嗜酸性炎症疾病的诊疗,通过动态观测测定值的变化,也能评估疾病的控制水平。总体来说,呼气标志物其实能够作为一种无创的生物标志物,来指导我们进行疾病诊断,判断严重程度和预后。2017年欧洲呼吸协会制定了呼出气生物标志物的技术指南,推荐对呼出气采样、检测、分析技术进行标准化,以加强不同研究的可比性,推进未来的研究 [2]。
目前有多种检测方法对呼出气生物标志物进行分析。例如通过呼吸采样对单个或几种气体信号分子进行分析。还有可以采集呼出气冷凝液,采取气相或液相质谱仪,对呼出气成分进行代谢组学分析。未来可能会通过人工智能嗅觉的模式识别来辅助我们对很多疾病进行诊断。
下面我们简单的概述一下气体信号分子、呼出气冷凝液和挥发性有机化合物这三种标志物在气道慢性疾病中的应用。
气体信号分子
1998年,NO生理医学作用获诺贝尔奖,2011年,呼气测定技术获美国医疗创新奖。多种气体信号分子在体内发挥重要的生理调节功能,例如一氧化氮(NO)、一氧化碳(CO),硫化氢(H2S ) 。
最早被关注的就是「一氧化氮」(NO):NO在T2炎症反应中升高。2型炎症的基本特征是体内IL-4、IL-5和IL-13等细胞因子水平升高。IL-4诱导IgE生成,IL-5促进骨髓嗜酸粒细胞(EOS)生成增多和肺内聚集,IL-13参与气道高反应性和高分泌等病理生理过程。

表1.呼出气一氧化氮检测指标。(注:FeNO:呼出气一氧化氮;CaNO:肺泡一氧化氮;FnNO:鼻呼气一氧化氮,引自中华医学杂志, 2021,101:网络预发表)
呼出气NO可以用于多种疾病,包括支气管哮喘、慢性咳嗽、上气道疾病、慢阻肺、变应性支气管肺曲霉病(ABPA)、嗜酸粒细胞性肉芽肿性多血管炎(EGPA)、嗜酸粒细胞性肺炎等。一氧化氮在辅助诊断哮喘方面非常重要,而在慢阻肺诊断方面,目前它是存在争议的,因为吸烟可能会抑制一氧化氮的合成。
图2.两室模型反映近端气道与远端气道释放的NO。(引自Respiratory research. 2010;11:47)
如果有条件的话,可以通过两室模型计算近端支气管(J‘awNO)与远端支气管(CaNO)释放的NO [3],并将哮喘分为4种类型——大气道炎症(FeNO高、CaNO正常)、小气道炎症(FeNO正常、CaNO高)、既有大气道也有小气道的炎症(FeNO、CaNO均高)、非嗜酸粒细胞性炎症(FeNO、CaNO均正常)。研究发现,CaNO升高与夜间症状、哮喘控制不良、ICS抵抗以及哮喘急性发作相关。
另外还可以通过口鼻呼出气NO联检判断上呼吸道炎症与下呼吸道炎症,例如有些患者可能出现过敏性鼻炎在先、下气道的炎症在后;也有患者可能先出现哮喘,之后又出现了过敏性鼻炎;还有患者可能会同时出现。如果有条件,可以上下气道同时测定,由此判断患者气道炎症的部位、种类来指导治疗。鼻腔NO浓度正常值高于下呼吸道,具有保持鼻窦无菌性和调节纤毛运动的功能;虽然鼻FnNO认为是变应性鼻炎的标志物,但目前尚处于临床前研究阶段,结果尚不肯定;而原发性纤毛运动障碍和囊性纤维化的鼻FnNO极低。
第二种气体信号分子是「一氧化碳」(CO),外源性CO来源于吸入受污染的空气,内源性CO由血红素加氧酶(HO)催化产生。吸入毒物可诱导气管支气管上皮和肺泡上皮以及肺泡巨噬细胞中的HO-1产生CO。炎症以及血红蛋白的转换(如脾脏和肝脏)导致的HO激活产生的CO以CO-Hb的形式进入循环系统。CO也可以作为脂质过氧化或某些外源性物质代谢的副产物出现在体循环中。
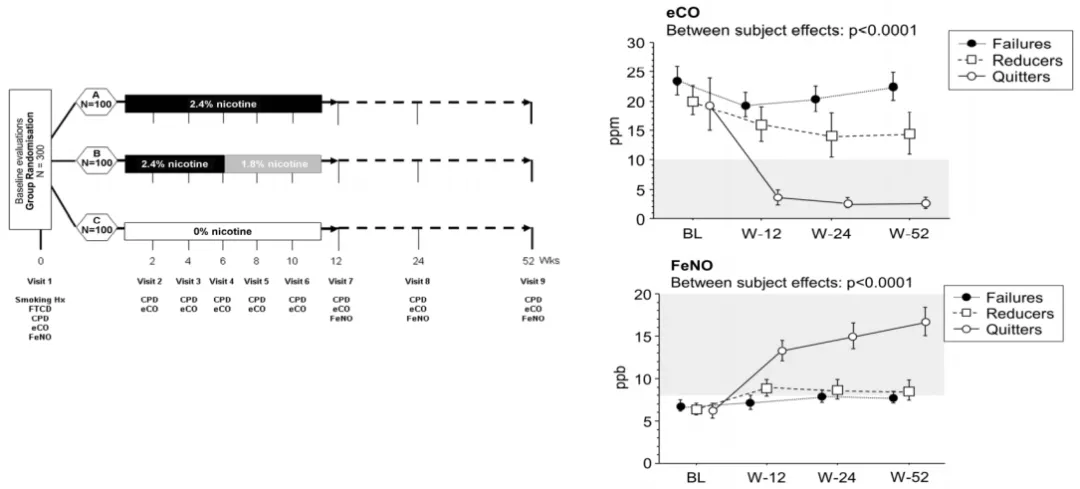
戒烟对呼出气FeNO和eCO有显著影响,且FeNO和eCO变化水平与症状评分(咳嗽、痰多、气短、气喘、胸闷、鼻塞、鼻窦痛、额部头痛)改善相关。通过测定呼出气的CO可以反映尼古丁依赖的程度 [4] 。
图3. 戒烟对呼出气FeNO和eCO有显著影响,且FeNO和eCO变化水平与症状评分改善相关。(引自 Eur J Clin Invest 2016; 46: 698-706.)
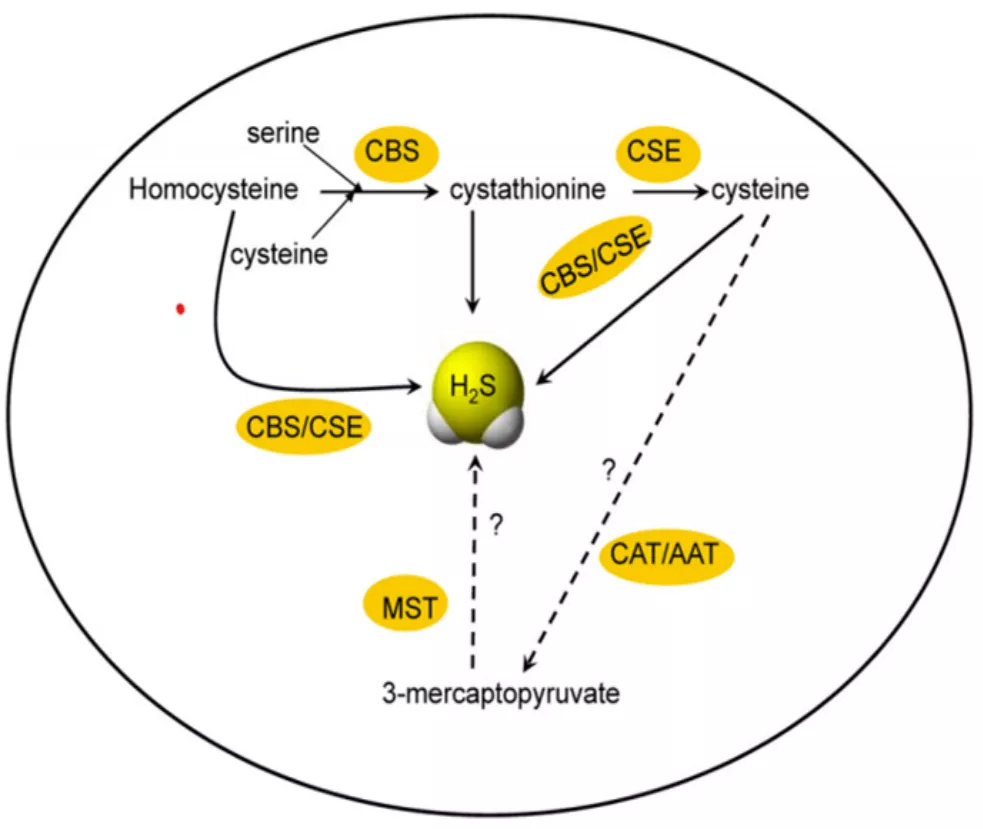
第三种气体信号分子「硫化氢」(H2S),这也是我们最近十几年来一直关注的,既往认为它是一个毒性气体,但现在发现它可以从机体的内源性产生,并调节多种生理过程。早期硫化氢的研究集中在心脑血管疾病、神经系统疾病领域,现今发现它在呼吸系统也发挥着多种生理作用。
图4.内源性含硫气体分子代谢通路示意图(引自Respir Physiol Neurobiol,2012,184:130-138 .)
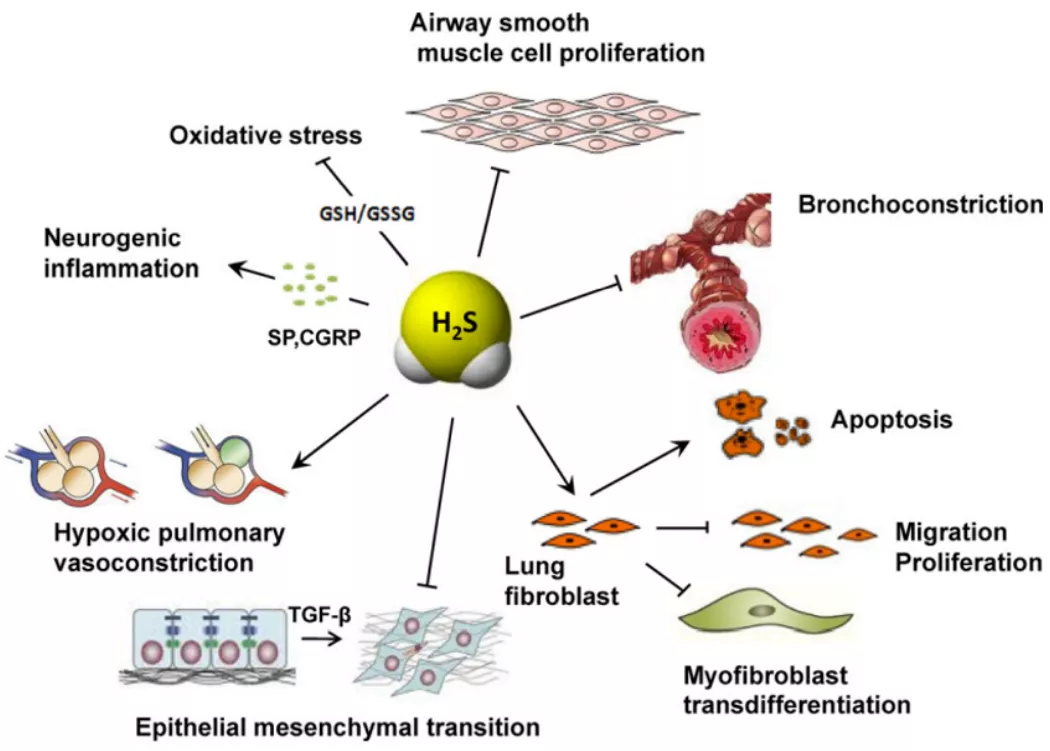
图5.内源性硫化氢在呼吸系统疾病中的作用机制示意图。(引自Respir Physiol Neurobiol,2012,184:130-138.)
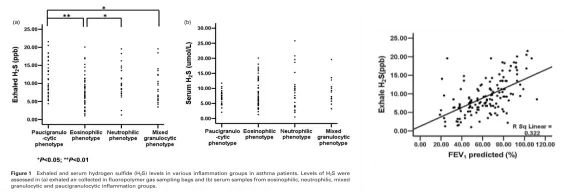
既往的研究发现,内源性硫化氢在慢阻肺患者中的表达下降,通过外源性给予硫化氢可以改善、减轻慢阻肺的气道炎症,发挥抗炎、抗氧化、抗重塑的作用,通过呼出气硫化氢检测也可以在一定程度上反应气道炎症。既往我们的研究中根据诱导痰将哮喘患者分成嗜酸性、中性、混合粒细胞性和低粒细胞性炎症组,发现各组呼出气H2S浓度有明显差异 [5]:
图6. 呼出气H 2S在嗜酸性粒细胞增多的慢阻肺患者中下降,且与FEV1成正相关。(引自Respirology 2014; 19: 1165-1169.)
国外的学者荟萃了国内外的研究,有关慢阻肺患者的研究表明,慢阻肺患者和健康对照组相比,他的血清硫化氢的水平是增高的,同时,在急性加重时要比稳定期下降,其他研究发现痰和血的硫化氢的比值在急性加重时要比稳定期增高。另外,如果这些患者需要用抗菌药物,硫化氢是下降的。
针对哮喘的研究也发现,哮喘患者的血清硫化氢同健康人群相比是下降的,同时,它和肺功能FEV1具有正相关,我们也做了呼出气硫化氢的检测,发现在嗜酸粒细胞增高的哮喘患者中,他呼出气的硫化氢水平是低的,而在肺纤维化患者中,发现硫化氢可以抑制人的肺纤维细胞的迁移、增殖,以及表型的转化,所以也可以发挥抗纤维化的作用。当然,慢阻肺患者、哮喘患者表型具有多样性,需要我们再进一步做分层研究。
对不同的气体信号分子进行联合能够给临床诊疗提供更多的信息,比如「NO与H2S呼气联检」,NO是嗜酸性粒细胞气道炎症标志物,与哮喘高度相关、H2S有可能与嗜中性粒细胞炎症有关,二者联检,或有助于气道疾病的炎症分型与精准治疗。「NO与CO呼气联检」方面,FeNO监测评估空气污染诱发或加重气道疾病的风险,FeCO监测评估一、二手烟诱发或加重气道疾病的风险;烟草与空气污染是肺癌肺病的两大危险因素,可联检联防。不仅是组织细胞可以产生气体信号分子,我们身体里很多的微生态(肠道微生态、肺组织微生态)也会产生很多气体信号分子,包括氢、甲烷、硫化氢与一氧化氮,可以进行呼气联检。所以我们现在也特别关注肠道菌群失衡与气道炎症(肠-肺轴),西医的理念讲究肠-肺轴共同的微生态调节,肠道微生态是否会影响气道的微生态?如果肠道的菌群失调,可能会对慢阻肺、哮喘、间质性肺病、肺癌等等疾病的发生发展造成影响 [6] 。
呼出气冷凝液
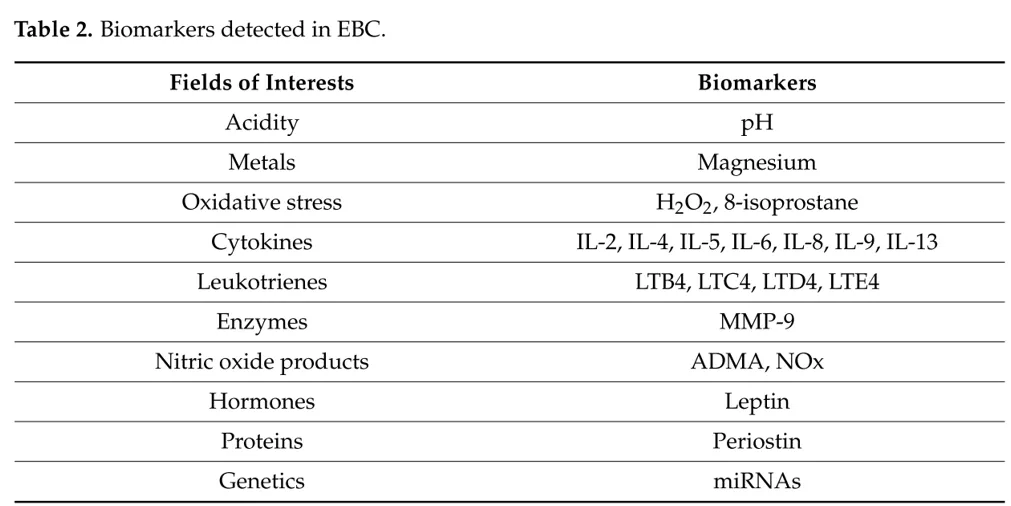
呼出气冷凝液(EBC)是通过冷凝装置收集呼出气,通过冷凝作用可以收集多种代谢产物,如亚硝酸盐、氨及有血管活性的胺类物质、蛋白质、多肽、核酸及一些脂类代谢物等。EBC的影响因素比较多,我们需要关注收集流程的标准化,包括有没有唾液污染、呼吸模式、样品收集时间和温度、是不是存在上呼吸道疾病、收集设备、环境温度和湿度、标记物的节律变化、是不是和运动、吸烟等活动相关,以及是不是服用了药物 [7]。目前大家检测呼出气冷凝液,主要是包括测定pH值、金属离子或者是氧化损伤产物细胞因子,包括酶学、激素蛋白等。
表2.呼出气冷凝液常见检测指标。(引自J. Clin. Med. 2021, 10, 2697. )
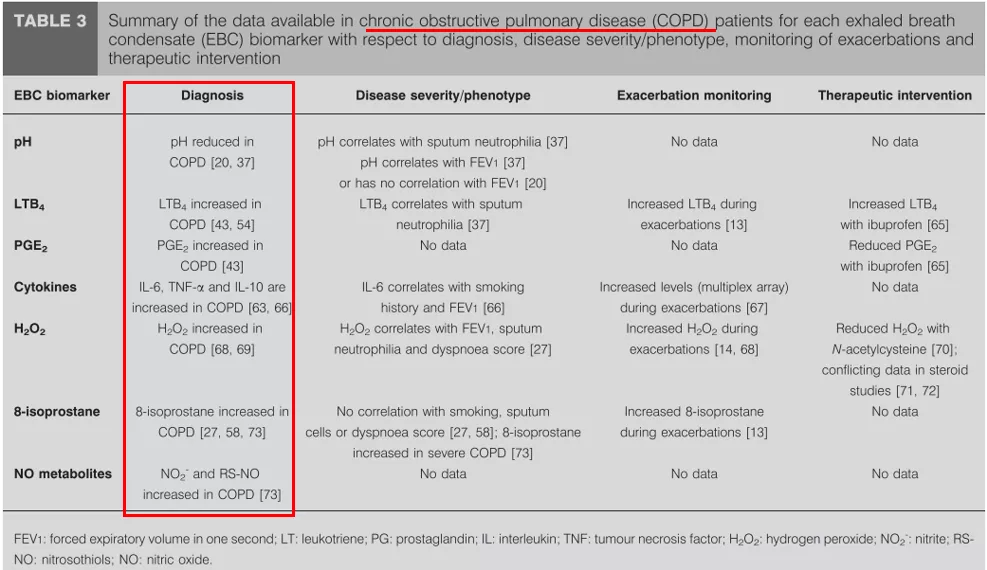
一些研究发现慢阻肺患者呼出气冷凝液PH值下降,PH还与中性粒炎症以及肺功能相关,另外冷凝液中还包含一些炎症因子、炎症介质。总体来说,它可能在疾病的严重程度判断与指导疾病的治疗方面可能具有一定作用 [8]。
表3. 慢性阻塞性肺疾病(COPD)患者每一呼气冷凝物(EBC)生物标志物在诊断、疾病严重程度/表型、恶化监测和治疗干预方面的可用数据摘要。(引自Eur Respir J 2008; 32: 472–486.)
呼吸代谢组学与VOCs
呼吸代谢组学(breathomics)的奠基人美国的鲍林教授2次荣获诺贝尔奖。有许多代谢组学相关的研究,从表型到内型,环境因素、暴露因素、饮食因素,以及我们的基因等,随着对疾病认识的深刻,呼吸代谢组学不仅仅是局限于呼吸疾病的诊断,也可以给其他疾病的诊断带来很多帮助。
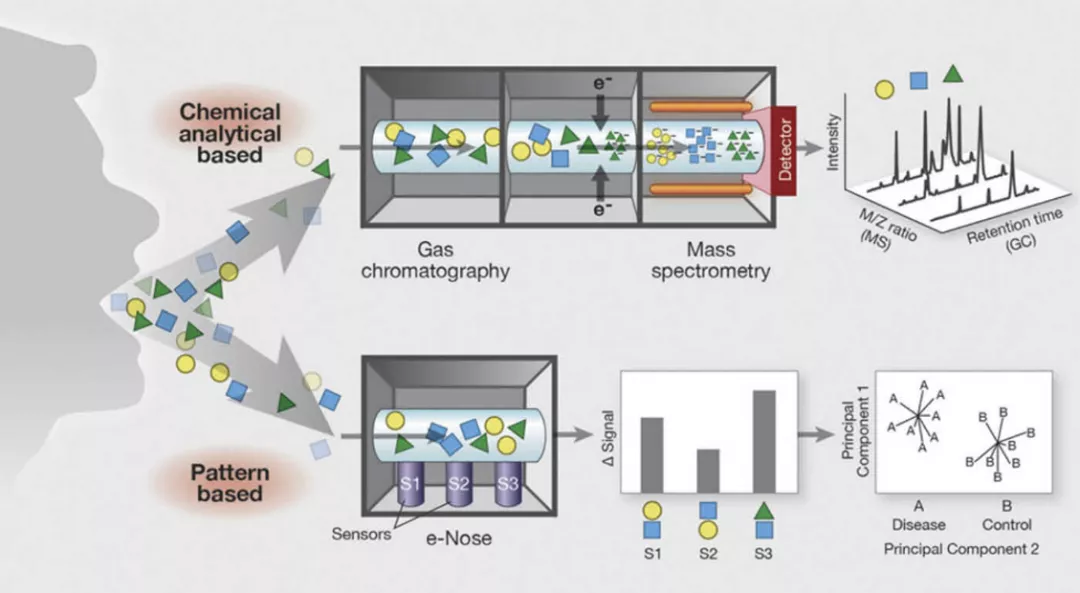
现在质谱方法(气相质谱、液相质谱)已经比较成熟,呼出VOCs分析技术主要包括两种路线:1)气相色谱仪(GC)和质谱分析(MS)作为原型化学分析技术,允许通过与先前建立的参考库比较单个化合物的质量电荷比来识别单个成分。2)基于模式识别技术的电子鼻。e-Nose传感器对VOC混合物中的多种化合物具有交叉反应性,导致传感器响应模式由VOCs混合物驱动并以其为特征。这些模式可以与以前模式识别算法所遇到的模式进行比较,从而对疾病进行分类 [9] 。
图7.呼出气代谢组学:化学分析方法与模式识别。(引自Chest 2015; 147: 224-231.)
呼出气组学检测能够识别多种慢性气道炎性疾病,包括COPD、哮喘以及其他肺部疾病,如阻塞性睡眠呼吸暂停、肺部感染以及囊性纤维化 [10]。目前高通量数据的信息量很大,怎样充分的进行分析来给临床提供比较有用的信息呢?还需要研究者、临床大夫进行更多的工作,以及一些交叉领域的合作。
小结:从既往的一些研究及文献分享中可以看到,针对呼出气检测,主要包括气体信号分子、呼出气冷凝液(EBC)和挥发性有机化合物(VOCs)。总体来说,目前临床上最成熟的应用是利用FeNO反应嗜酸性气道炎症,H2S可能与中性粒气道炎症相关,CO检测能够评估烟雾对气道的影响;通过对EBC和VOCs内含的生物标记分子进行检测以及呼出气分子模式识别,能够诊断多种肺部疾病。
参考文献
[1] Bruderer T, Gaisl T, Gaugg MT, Nowak N, Streckenbach B, Muller S, et al. On-Line Analysis of Exhaled Breath Focus Review. Chem Rev. 2019;119(19):10803-28.
[2] Horváth I, Barnes PJ, Loukides S, Sterk PJ, Högman M, Olin AC, et al. A European Respiratory Society technical standard: exhaled biomarkers in lung disease. Eur Respir J. 2017;49(4).
[3] Puckett JL, Taylor RW, Leu SY, Guijon OL, Aledia AS, Galant SP, et al. Clinical patterns in asthma based on proximal and distal airway nitric oxide categories. Respiratory research. 2010;11:47.
[4] Campagna D, Cibella F, Caponnetto P, Amaradio MD, Caruso M, Morjaria JB, et al. Changes in breathomics from a 1-year randomized smoking cessation trial of electronic cigarettes. Eur J Clin Invest. 2016;46(8):698-706.
[5] Zhang J, Wang X, Chen Y, Yao W. Correlation between levels of exhaled hydrogen sulfide and airway inflammatory phenotype in patients with chronic persistent asthma. Respirology. 2014;19(8):1165-9.
[6] Budden KF, Gellatly SL, Wood DL, Cooper MA, Morrison M, Hugenholtz P, et al. Emerging pathogenic links between microbiota and the gut-lung axis. Nature reviews Microbiology. 2017;15(1):55-63.
[7] Polomska J, Bar K, Sozanska B. Exhaled Breath Condensate-A Non-Invasive Approach for Diagnostic Methods in Asthma. Journal of clinical medicine. 2021;10(12).
[8] Borrill ZL, Roy K, Singh D. Exhaled breath condensate biomarkers in COPD. Eur Respir J. 2008;32(2):472-86.
[9] van der Schee MP, Paff T, Brinkman P, van Aalderen WMC, Haarman EG, Sterk PJ. Breathomics in lung disease. Chest. 2015;147(1):224-31.
[10] Finamore P, Scarlata S, Incalzi RA. Breath analysis in respiratory diseases: state-of-the-art and future perspectives. Expert Rev Mol Diagn. 2019;19(1):47-61.
专家介绍

蒋思敏
北京大学第三医院呼吸与危重医学科 2021级呼吸科在读博士研究生;博士生导师:陈亚红教授;发表SCI论文2篇。

张静
北京大学第三医院呼吸与危重医学科 副主任医师、副教授;毕业于北京大学医学部 临床博士;专业方向:肺血管疾病及慢性气道炎症性疾病;中华医学会呼吸分会肺栓塞与肺血管疾病学组委员;主持及参与多项国家自然科学基金,发表数篇SCI论文及核心期刊论文。

陈亚红
主任医师,教授,博士研究生导师。北京大学第三医院呼吸与危重症医学科副主任、科研伦理综合办公室主任。研究方向:慢性气道疾病。担任第11届中华医学会呼吸病学分会肺功能学组副组长,第8~10届中华医学会呼吸病学分会慢性阻塞性肺疾病学组委员,中国医师协会呼吸医师分会慢性阻塞性肺疾病工作委员会委员,中国基层呼吸疾病联盟副主席,《中国医学前沿杂志(电子版)》编委。承担多项国家级和省部级科研基金,获得北京市科技新星计划支持和教育部新世纪优秀人才支持计划。研究结果获得北京市科技进步三等奖和中华医学科技奖三等奖。
本文由《呼吸界》编辑 Jerry 整理、排版,感谢蒋思敏、陈亚红教授的审阅修改!